菊睛丸改善D-半乳糖致亚急性衰老小鼠视网膜损伤效应评价与作用机制研究
陆韫青,曹程,郑嘉妮,朱梓强,仝佳祥,齐程成,袁磊,郭盛,宿树兰,康宏杰,段金廒,朱悦
(1.南京中医药大学药学院,中药资源产业化与方剂创新药物国家地方联合工程中心,江苏省中药资源产业化过程协同创新中心,江苏省方剂高技术研究重点实验室,江苏 南京 210023;2.宁夏枸杞创新中心,宁夏 银川 750002)
视觉障碍已与肿瘤、心血管疾病共同成为全球严重影响人类生存质量的疾患。尤其在老龄化日趋加剧的当今社会,视网膜疾病中的年龄相关性黄斑变性(Age-related macular degeneration,AMD)已成为导致全球范围内老年人失明的最主要疾病[1]。流行病学研究结果显示,全球45~85岁人群中AMD患病率约为8.7%[2]。到2040年,受AMD影响的人数预计将增加到2.88亿[3-4]。在中国,AMD患者累计人数已超4 000万,AMD也是导致视觉障碍的主要原因[5]。AMD已成为当今社会重大公共卫生问题[2]。
视网膜特定的高氧分压、高光照暴露、高脂质化合物代谢的生理环境,促进了氧自由基的产生,使视网膜特别容易受到氧自由基以及脂类衍生物修饰的氧化蛋白的损害[6],导致视网膜色素上皮细胞凋亡与玻璃膜疣形成,一部分患者引发Bruch膜破裂与脉络膜血管新生而导致湿性AMD[7-8]。而另一部分患者出现视网膜地图样萎缩,最终形成干性AMD[9]。目前,所有上市的AMD药物均是针对湿性AMD,以玻璃体内注射抗VEGF药物作为治疗手段[10]。而干性AMD至今尚未有上市的治疗药物,仅推荐服用AREDS2营养配方补充剂进行预防[11]。因此,干性AMD迫切需要新的预防和治疗方案。
中医眼科中多以“视瞻昏渺”“视直如曲”“暴盲”来描述AMD导致的视力下降[12]。菊睛丸始载于北宋(1078年)《太平惠民和剂局方·卷之七·治眼目疾》[13],在治疗描述其功效为“补不足,强目力”,主治“肝肾不足,眼目昏暗,瞻视不明,茫茫漠漠,常见黑花,多有冷泪”,与AMD尤其是干性AMD视觉缺失的临床症状高度一致。组方药材中的枸杞子、菊花与肉苁蓉为药食同源药材,巴戟天也为可用于保健食品的中药材,因此该方安全性高,具有良好的开发为食品或保健品的应用前景。基于AMD为老年期高发疾病以及氧化应激这一核心病理机制,我们采用小鼠皮下注射D-半乳糖构建亚急性衰老动物模型[14],评价菊睛丸对衰老模型动物视网膜结构影响及其对视网膜氧化应激与细胞凋亡的影响,为衰老所致视网膜部损伤的临床防治与产品开发提供更多的现代科学依据。
1 材料
1.1 实验动物
SPF级ICR小鼠(雄性,8周龄,体质量20~22 g),购自上海斯莱克实验动物有限责任公司,动物许可证号:SCXK(沪)2017-0005,于南京中医药大学动物实验中心SPF级屏障设施中常规饲养。普通饲料喂养,自由饮食,温度(23±2)℃,湿度(60±2)%,光照周期12 h。本实验已获得南京中医药大学动物实验伦理委员会的批准,动物伦理号为202201A028。
1.2 药材
枸杞子(Lycii Fructus,批号:2109099)采购于宁夏明德中药饮片公司,菊花(Chrysanthemi Flos,批号:17320722)、巴戟天(Morinda officinalis How,批号:245200601)、肉苁蓉(Cistanches Herba,批号:260200602)均采购于苏州市天灵中药饮片有限公司,经南京中医药大学段金廒教授鉴定为正品合格药材。PreserVision AREDS2(具体成分剂量为维生素C,100 mg·kg-1·d-1;维生素E,80 U·kg-1·d-1;氧化锌,16 mg·kg-1·d-1;氧化铜,0.4 mg·kg-1·d-1;叶黄素,2 mg·kg-1·d-1;玉米黄质,0.4 mg·kg-1·d-1)购自博士伦(Bausch Lomb)公司。杞菊地黄丸购自仲景宛西制药股份有限公司(批号:200806)。
1.3 实验试剂
包埋剂(4583)购自Sakura公司。四氟乙烯(Polyfluoroalkoxy,PFA)(G1101)购自武汉塞维尔公司。苏木精-伊红(Hematoxylin-eosin staining,HE)染色试剂盒(G1120-10)购自北京索莱宝公司。TUNEL细胞凋亡检测试剂盒(C1086)购自南京金益柏生物科技有限公司。4′,6-二脒基-2苯基吲哚(DAPI)(D4080)购自Sigma公司。蔗糖(57-50-1)、二甲苯(10023418)、无水乙醇(100092683)等购自国药集团化学试剂有限公司。
氧化应激标志物检测相关试剂:小鼠超氧化物歧化酶(SOD)检测试剂盒(A001-3-2)、还原性谷胱甘肽(GSH)检测试剂盒(A006-2-1)、丙二醛(MDA)检测试剂盒(A003-4-1)均购自南京建成生物工程研究所。
组织蛋白提取相关试剂:RIPA裂解液(P0013B)、BCA蛋白浓度测定试剂盒(P0009)购自上海碧云天生物技术有限公司。蛋白酶抑制剂Cocktail(HY-K0010)购自MCE公司。PBS缓冲液(BL601A,BIOSHARP)购自北京兰杰柯科技有限公司。
Western blot相关试剂:一抗β-actin(66009-1-Ig)、Nrf2(16396-1-AP)、HO-1(10701-1-LG)、Cleaved Caspase-3(19677-1-AP)购自武汉三鹰公司,Cleaved Caspase-9(9508S)购自CST公司,Bax(sc-7480)、Bcl-2(sc-7382)购自圣克鲁斯生物技术有限公司。二抗HRP-Linked Anti-mouse IgG(BA1050)、HRP-Linked Anti-rabbit IgG(BA1054)均购自博士德公司。PAGE凝胶快速制备试剂盒(10%,PG112;12.5%,PG113)购自上海雅酶生物医药科技有限公司。蛋白上样缓冲液(5×Loading buffer)、甘氨酸、Tris等购自北京索莱宝公司。预染蛋白Marker(180-6003)、ECL发光液(180-5001)购自上海天能生命科学有限公司。吐温-20(T8220-500)购自南京何苗生物技术有限公司。未特别说明的试剂如氯化钠等购自国药集团化学试剂有限公司。
1.4 实验仪器
激光眼科诊断仪(Spectralis OCT,HEIDELBERG公司),多功能酶标仪(Enspire,Perkin-Elmer公司),微孔板恒温振荡器(ST60-4,Thermo公司),高速冷冻离心机(Microfuge-22R,BECKMAN公司),荧光倒置显微镜(AXIO Vert.A1,Zeiss公司),干式恒温金属浴(SBH130D,STUART公司),凝胶电泳成像系统(ChemiDoc XRS+Imaging System,BIO-RAD公司)。
2 方法
2.1 药物制备
菊睛丸(JJW)提取制备:按枸杞子∶菊花∶巴戟天∶肉苁蓉(3∶4∶1∶2)比例称取药材共53 g,制备水提取物与50%乙醇提取物。水提取物制备按药材质量加入8倍量纯水,回流提取2 h,过滤后加入相同体积纯水重复回流提取2 h后过滤,合并2次滤液后减压浓缩。50%乙醇提取物制备按药材质量加入8倍量50%乙醇,回流提取2 h,过滤后加入相同体积50%乙醇重复回流提取2 h后过滤,合并2次滤液后减压浓缩。冻干后计算得率,水提取物得率为45.28%,50%乙醇提取物得率为50.94%。
2.2 动物造模与分组给药
健康ICR小鼠共80只,适应性饲养1周后,将动物随机分为8组,每组10只。动物按如表1方式分组,除空白组外,其余每日皮下注射D-半乳糖700 mg·kg-1·d-1,持续注射7周,建立D-半乳糖亚急性衰老动物模型。模型建立之后各组灌胃相应药物,灌胃体积为每10 g动物灌胃0.1 mL,持续10 d。采用AREDS2作为西药阳性药,采用杞菊地黄丸作为中成药阳性药。菊睛丸提取物动物给药剂量按照《太平惠民和剂局方》所记载的人用量进行折算,并分为低、高2个剂量组。低剂量组根据人用日常剂量折算,高剂量组根据人用日常剂量的2倍进行折算。

表1 动物分组和给药剂量
2.3 光学相干断层成像检查(OCT)与视网膜厚度测量
小鼠给药周期结束后,1%戊巴比妥钠腹腔注射小鼠(40 mg·kg-1),麻醉后使用复方托吡卡胺散瞳10 min,玻璃酸钠保护角膜后佩戴角膜接触镜,进行小鼠眼底OCT检测。使用Image J对小鼠视网膜横截面图进行平均厚度测量分析小鼠眼底情况。
2.4 眼部组织病理形态分析
2.4.1 眼部组织切片制作 采用OCT拍摄受试动物眼底视网膜结束后,解剖获得动物模型眼球组织,于4%PFA固定24 h,梯度蔗糖、乙醇脱水。之后按步骤浸蜡,再进行OCT包埋,用切片机切片,60 ℃烘箱内烘片后最终制作获得模型动物眼球组织病理石蜡切片。
2.4.2 眼球组织病理切片HE染色 将2.4.1所得的眼球组织石蜡切片脱蜡之后,按步骤进行HE染色,纯水慢速洗涤10 s,乙醇梯度脱水,最后用中性树脂封片。
2.5 TUNEL检测眼部细胞凋亡水平
将“2.4.1”所得的眼球组织石蜡切片脱蜡之后,根据TUNEL试剂盒标准步骤,避光进行染色,洗涤后DAPI染细胞核,乙醇梯度脱水,滴加防荧光淬灭剂后封片。检测模型动物视网膜部细胞凋亡水平。
2.6 血清及组织蛋白提取
行为学测试结束后,异氟烷吸入麻醉小鼠,眼眶取血,常温条件下800×g离心10 min,小心吸取上清血清。解剖获得模型动物眼球组织,液氮迅速冷冻、粉碎,称取20~30 mg组织,PBS制备匀浆(含Cocktail蛋白酶抑制剂),4 ℃条件下800×g离心10 min,小心吸取上清。保存于-80 ℃冰箱内待测。
按照BCA试剂盒所列步骤,建立BSA标准曲线,96孔板加入样品与BCA工作液,37 ℃孵育20~30 min,于562 nm处检测OD值,根据标准曲线计算各样品眼球组织蛋白浓度。
Western blot所需的蛋白样品用含Cocktail蛋白酶抑制剂的RIPA组织裂解液提取制备,提取步骤及蛋白浓度检测步骤同上。
2.7 眼球组织及血清中氧化应激标志物水平检测
吸取20 μL待测样品(制备过程2.6),按照SOD、MDA、GSH微量法检测试剂盒说明书进行操作,试剂盒中标准品进行梯度稀释后绘制标准曲线,采用酶标法在相应波长处测量吸光度OD值,并计算模型动物血清及眼球组织中相关因子表达。
2.8 Western blot法检测小鼠眼部组织目的蛋白表达
将2.6中RIPA裂解液提取所获得的眼球组织蛋白样品,根据所测蛋白浓度加入PBS将各样品蛋白浓度稀释至相同水平。将蛋白上样缓冲液与蛋白样品按照1∶4混合均匀,98 ℃金属浴高温变性15 min,保存于-80 ℃冰箱内待用。
按照凝胶试剂盒所列实验步骤,制备10%、12.5%的PAGE凝胶,上样后120 V恒压电泳跑至合适位置,切胶后转膜至PVDF膜,300 mA恒流条件转相应时间,5%脱脂奶粉室温下摇床低速封闭2 h,Tris-buffered saline plus Tween(TBS-T)洗膜5 min×3次,孵育目的蛋白一抗Cleaved Caspase-3、Cleaved Caspase-9、Bax、Bcl-2、Nrf2、HO-1(稀释比例1∶2 000),4 ℃过夜。恢复室温1 h后用TBS-T洗膜15 min×4次,加入2.5%脱脂奶粉稀释配制的二抗HRP-Linked Anti-mouse IgG/HRP-Linked Anti-rabbit IgG(稀释比例1∶10 000),室温下摇床低速孵育1 h,TBS-T洗膜10 min×6次,ECL显色液显色,凝胶成像曝光检测,利用Image J数字成像软件将条带图像进行可视化分析,以β-actin作为内参蛋白,分析计算目的蛋白条带相对灰度值。
2.9 统计学方法
采用SPSS24.0软件进行统计与分析,组间比较采用One-wayANOVA,数据以P<0.05表示差异有统计学意义。
3 结果
3.1 菊睛丸对D-半乳糖亚急性衰老模型小鼠眼底和视网膜的影响
如图1所示,模型小鼠视网膜厚度与空白组小鼠相比显著变薄(P<0.01),给予菊睛丸后,视网膜有相应增厚的趋势,其中JJW-S-L和JJW-50-L给药组小鼠视网膜厚度显著增厚(P<0.05),与西药阳性药AREDS2作用趋势一致(P<0.01),作用趋势优于中药阳性药杞菊地黄丸。
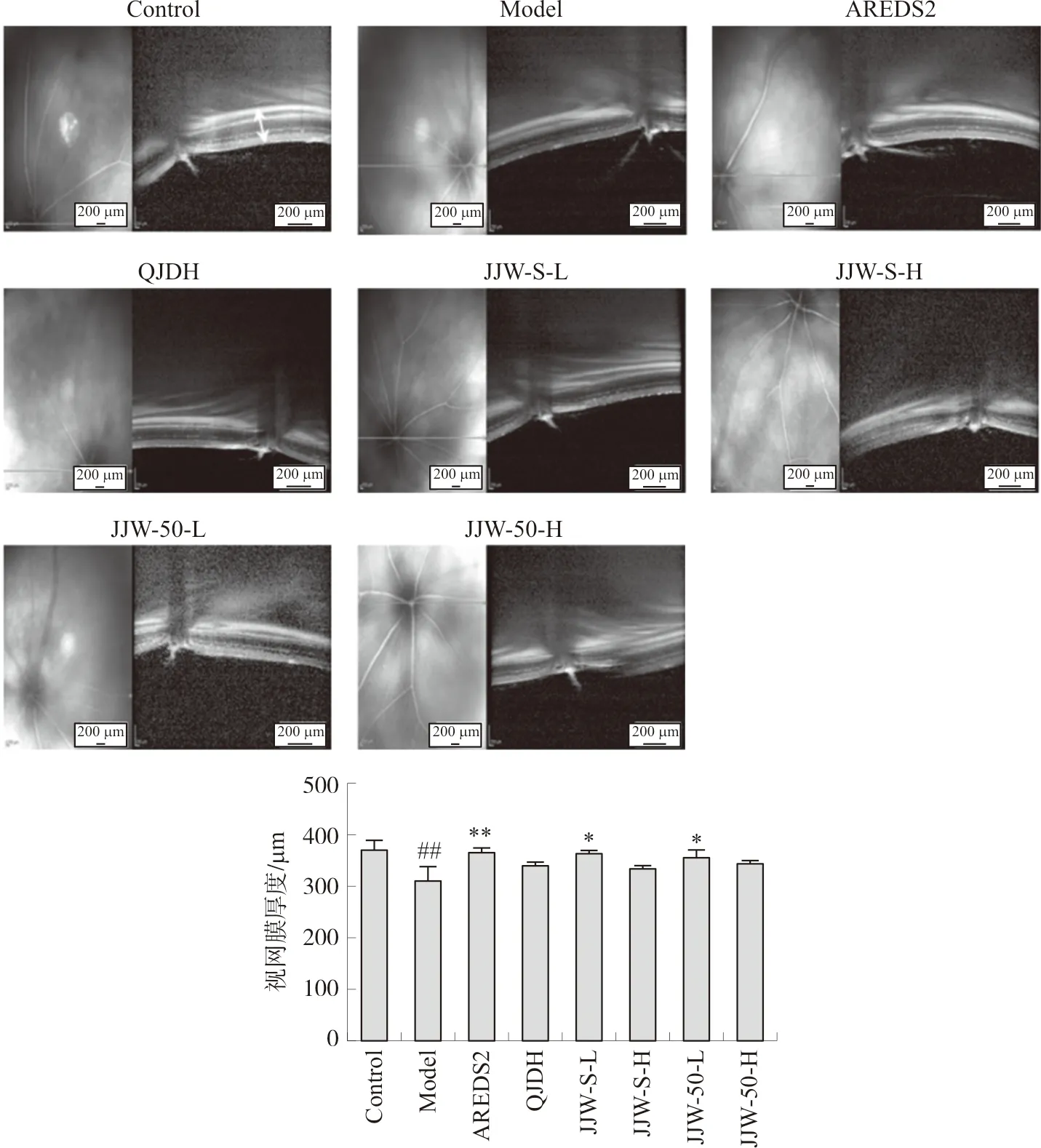
注:与空白组比较,##P<0.01;与模型组比较,比例尺=200 μm。
采用HE染色评价小鼠视网膜部细胞病理组织形态改变情况,如图2所示。空白组HE切片显示,小鼠视网膜厚度适中,内核层(INL)、外核层(ONL)、丛状层(PL)均清晰可见,各层细胞排列规则、紧密,无炎细胞浸润。模型组小鼠INL显著变薄弯曲,部分呈现空泡状,ONL细胞排列紊乱。感光细胞层局部变薄,RPE细胞皱缩。菊睛丸提取物均可改善视网膜细胞排列紊乱,恢复视网膜厚度,并且对视网膜ONL、INL和PL厚度均具有显著的恢复作用。分别测量ONL、INL、GL的厚度发现,模型组小鼠视网膜各层厚度显著变薄(P<0.05),菊睛丸提取物可以显著增加视网膜各层厚度(P<0.05),与西药阳性药AREDS2有相同的作用趋势,JJW-S-L、JJW-50-L、JJW-50-H的作用趋势略优于杞菊地黄丸。以上病理学HE染色结果及视网膜各层厚度的测量结果表明,D-半乳糖注射导致小鼠视网膜细胞排列紊乱,视网膜ONL、INL和PL变薄,视网膜色素上皮细胞皱缩,菊睛丸水提物和50%乙醇提取物均可恢复视网膜厚度,改善细胞排列紊乱情况。菊睛丸水提物低剂量组的作用趋势优于杞菊地黄丸。
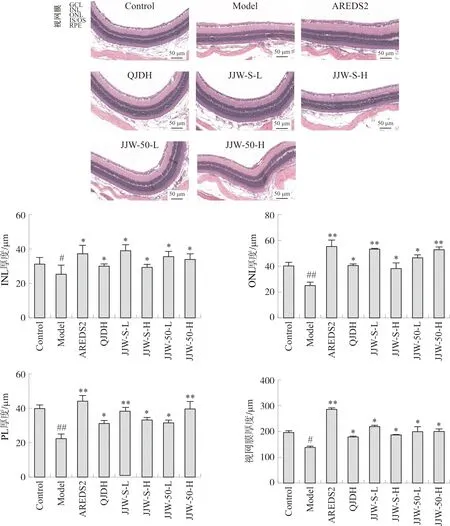
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,比例尺=50 μm。
3.2 菊睛丸对D-半乳糖亚急性衰老模型动物眼球组织及血清氧化应激标志物水平的影响
如图3所示,和空白组相比,模型组小鼠眼球组织中SOD活力和GSH含量显著下降(P<0.01),MDA含量显著上升(P<0.01),表明D-半乳糖模型动物眼部氧化水平显著增高。与模型组相比,菊睛丸水提取物及50%乙醇提取物低剂量显著上调眼球组织中SOD活力(P<0.01)和GSH含量(P<0.05,P<0.01),显著下调MDA含量(P<0.01)。提示菊睛丸可通过提高抗氧化酶的表达和降低氧化物的产生来发挥抗氧化作用,作用趋势与AREDS2一致,其中对MDA表达的效用优于杞菊地黄丸。菊睛丸水提物在上调SOD、下调MDA作用与醇提物的效用相当,上调GSH效用优于醇提物。
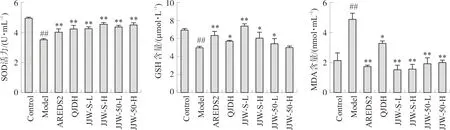
注:与空白组比较,##P<0.01;与模型组比较,
对小鼠血清氧化应激标志物水平进行检测,考察氧化应激对小鼠全身状况的影响。如图4所示,和空白组相比,模型组小鼠血清中SOD活力和GSH含量显著下降(P<0.01),MDA含量显著上升(P<0.01),表明D-半乳糖亚急性衰老模型动物全身氧化水平显著增高。与模型组相比,不同提取溶剂的菊睛丸提取物显著上调血清中SOD活力(P<0.01)和GSH含量(P<0.01),显著下调MDA含量(P<0.01),作用趋势与AREDS2一致。菊睛丸50%乙醇提取物低剂量组具有较优的作用趋势,并优于杞菊地黄丸。
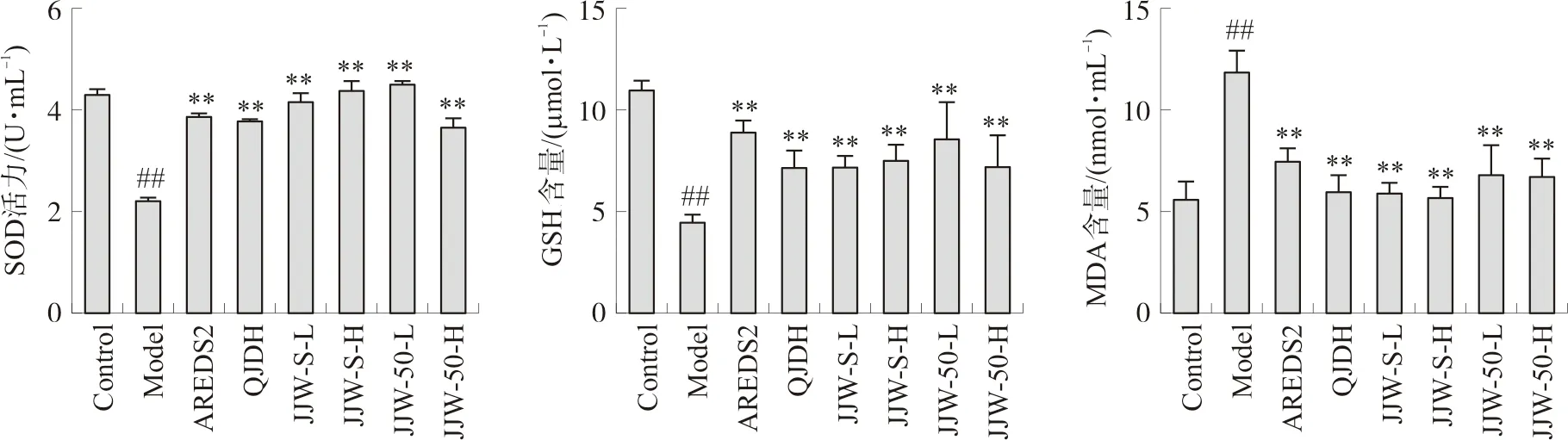
注:与空白组比较,##P<0.01;与模型组比较,
3.3 菊睛丸对D-半乳糖亚急性衰老模型小鼠眼球组织抗氧化蛋白表达的影响
结果如图5所示,模型组小鼠Nrf2和HO-1蛋白表达较空白组显著下降(P<0.05)。给药后,菊睛丸水提取物和50%乙醇提取物能显著提高抗氧化蛋白Nrf2和HO-1表达(P<0.05,P<0.01),作用趋势与AREDS2一致,优于杞菊地黄丸。提示菊睛丸可通过调控Nrf2/HO-1抗氧化通路发挥抗氧化作用。菊睛丸水提物低剂量组具有较优的作用趋势。
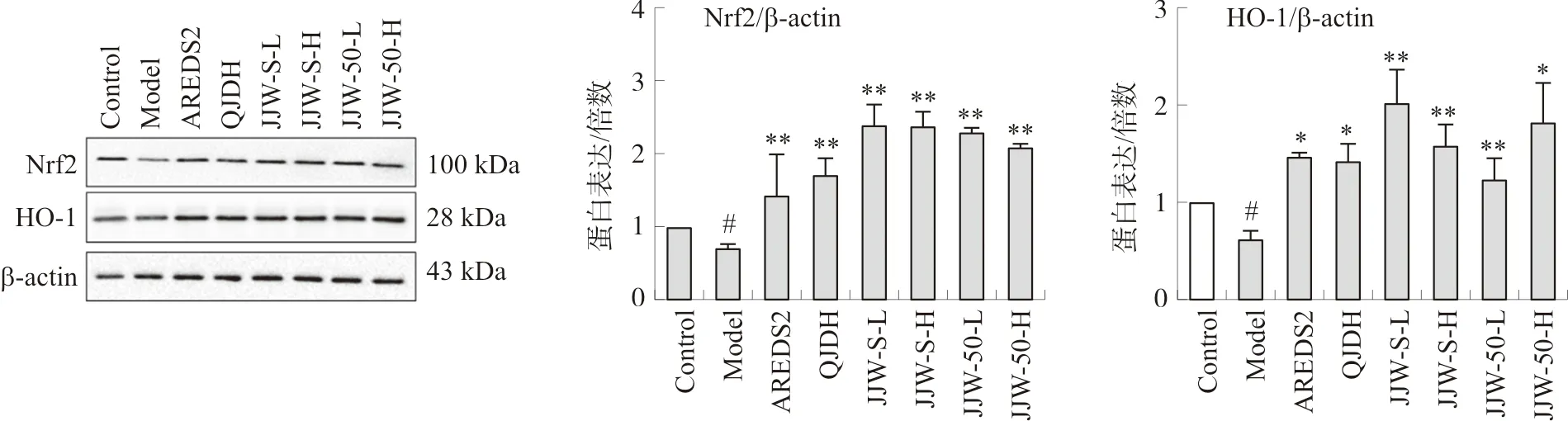
注:与空白组比较,#P<0.05;与模型组比较,
3.4 菊睛丸对D-半乳糖亚急性衰老模型小鼠视网膜细胞凋亡的影响
进一步采用TUNEL染色考察模型小鼠视网膜细胞凋亡情况。如图6所示,模型组小鼠视网膜细胞较空白组凋亡显著增强(凋亡细胞呈现绿色荧光,P<0.01),给予菊睛丸水提取物和50%乙醇提取物后,视网膜部细胞凋亡显著减少(P<0.05,P<0.01),提示菊睛丸可以通过抑制细胞凋亡保护视网膜部细胞,作用趋势与西药阳性药AREDS2一致。菊睛丸水提物高剂量组具有较优的作用趋势。
3.5 菊睛丸对D-半乳糖亚急性衰老模型小鼠眼球凋亡通路蛋白表达的影响
采用Western blot法检测小鼠眼球凋亡相关蛋白的表达,考察菊睛丸对凋亡相关通路的调控作用。如图7所示,模型组小鼠眼球Bcl-2/Bax比值显著降低(P<0.05),凋亡蛋白Cleaved Caspase-3、Cleaved Caspase-9表达含量显著增加(P<0.05)。给予菊睛丸水提取物和50%乙醇提取物后,Cleaved Caspase-3和Cleaved Caspase-9表达显著下降(P<0.05,P<0.01),Bcl-2/Bax比值显著上升(P<0.05,P<0.01),作用趋势与AREDS2一致。提示菊睛丸调节凋亡通路抑制眼球细胞凋亡。
4 讨论
随着人类平均寿命延长和生育率下降,社会老龄化加剧。按照世界卫生组织标准,我国也即将步入中度老龄化社会[15]。因此,衰老引起的疾病逐步得到重视,衰老机制和抗衰老措施逐渐成为研究热点。氧化应激学说是目前公认的衰老假说,其核心内容是机体代谢产生的活性氧(ROS)攻击细胞内包括DNA、蛋白质和脂质等在内的大分子物质而造成氧化损伤,氧化损伤物质在体内的不断积累导致线粒体功能丧失与生物体衰老[16]。D-半乳糖本身存在于食物和人体内。长期接触高剂量D-半乳糖可被半乳糖氧化酶催化转化为醛糖和过氧化氢,产生ROS而导致氧化应激、炎性反应、线粒体功能障碍和细胞凋亡[17]。因此D-半乳糖小鼠皮下注射常用于构建亚急性衰老动物模型而用于抗衰老研究或药物效用评价。在本研究中我们同样发现,D-半乳糖皮下注射导致小鼠视网膜INL层显著变薄弯曲,部分呈现空泡状,外核层细胞排列紊乱。感光细胞层局部变薄,视网膜上皮色素细胞皱缩,与干性AMD临床视网膜萎缩具有高度相似性,同时该病理现象可被唯一推荐的干性AMD预防与控制膳食添加剂AREDS2[18]所抑制。与公认的小鼠NaIO3注射拟干性AMD模型[19]相比,该模型同时还兼具了衰老的因素,更符合AMD的实际病理情况。与自然衰老小鼠模型相比,实验周期也大大缩短,因此该模型可作为干性AMD病理研究与药物评价模型。
中医认为,年事日高,精血暗耗,肝肾渐亏,水不涵木,阴虚火旺,肝阳上亢则疏泄失权,水谷不归正化则湿聚为痰,积聚眼底变生玻璃膜疣;同时,肾精亏虚,肝血不足,气血生化乏源,目睛失养,眼底萎缩,形成干性AMD。病程进一步发展为肝失疏泄,木横伐土,肝失藏血之责,脾失摄血之权,导致津血不能循经,停留眼底形成瘀血痰湿,形成湿性AMD。“肝肾不足,阴虚火旺”的病机贯穿于AMD病程发展全过程,因此,“滋肝补肾,平肝明目”也相应成为了干性AMD遣方用药的主要原则。菊睛丸最早以“傅延年酒”之名记载于唐代王冰《元和纪用经》,其功效为“利血气,耐老轻身,明目安神,养志,补劳伤”[20],记载其具有延缓衰老与明目之效。《局方》则首次明确了菊睛丸在眼科的具体应用。此后,同样四味药又以“内养丸”“草还丹”(《圣济总录》[21])与“菊花丸”(《三因极一病证方论》[22])等同方异名见于多本代表性方书著作,且被描述为有清利头目,益寿延年之效,足见该方抗衰老与明目效用之确切。方中枸杞子滋肝血,益肾精,补肝肾阴而明目;肉苁蓉补肾助阳,润燥益精;巴戟天温阳助火,补益精血。三药相伍,阴阳既济,则肝血肾精得充而目明,本患得除。菊花疏风散邪,清热平肝,标患得解;又可籍其升散之功引三药上滋于目,补益肝肾明目之功益彰;复以其“清”之性防枸杞子、肉苁蓉滋腻碍脾,杜巴戟天温燥伤阴之患。同时,方中的枸杞子与菊花为滋肝肾阴常用药对,肉苁蓉与巴戟天为温补肾阳常用药对,共同伍用,不仅体现了中医理论“善补阳者,必于阴中求阳;善补阴者,必于阳中求阴”的治则,更与老年人精血亏虚,肾阳虚衰的体质特征丝丝入扣。与AMD的另一味常用中成药杞菊地黄丸偏于补肝肾阴[23]相比,似乎更吻合老年人易于阴阳两虚的体质特征。而本研究也发现,菊睛丸提取物在改善模型小鼠视网膜厚度、调控氧化应激与视网膜细胞凋亡等环节上,比杞菊地黄丸给药组有更好的改善趋势。
现代研究表明,菊睛丸方中药味虽为药食同源类药材,但其所含成分对视疲劳缓解与视网膜保护具有显著效用。枸杞子中所含枸杞多糖可通过抗氧化、调节血管、神经保护以及免疫调节等多种途径发挥视网膜保护作用[24];玉米黄质和叶黄素、类胡萝卜素类成分是国际公认的可显著降低白内障与晚期AMD发生风险的物质[25]。菊花所含黄酮成分可抵御视网膜色素上皮细胞氧化损伤与细胞凋亡[26]。本课题组前期研究同样发现,枸杞子和菊花配伍可改善氢醌诱导的AMD小鼠视网膜INL紊乱,降低视网膜炎症因子的表达,降低多种因素损伤的视网膜部细胞凋亡,增加保护视网膜区细胞结构的完整性,且效用强于单独使用枸杞子[27]。相对而言,肉苁蓉与巴戟天中的成分对AMD的改善作用报道较少,更多则集中于抗衰老的研究,如巴戟天多糖具有抗氧化、抗衰老和免疫调节等功效[28],肉苁蓉所含松果菊苷与多糖成分具有提升机体免疫力与调节免疫的效用[29]。上述研究均充分证明了菊睛丸在抗老年期视网膜退行性疾病方面的开发与应用价值。值得注意的是,枸杞子中的玉米黄质、叶黄素、类胡萝卜素及菊花所含黄酮成分均属脂溶性成分,支持了菊睛丸以丸剂用药的合理性。但是在考察该方的历史应用发现,方中四味药材也常作汤剂应用。因此我们在研究中比较了菊睛丸水提物与50%乙醇提取物的效用差异,但未发现有显著性差异。在后续研究中,我们将深入探索菊睛丸改善衰老模型小鼠视网膜部损伤的作用机制与功效物质基础,以期为菊睛丸的临床应用与产品开发提供更多的现代科学依据支持。

