血管紧张素II通过抑制原癌基因c-SKI表达促进小鼠高血压性心肌纤维化*
吕忠英, 李红建, 张 颖, 王 娟
(新疆医科大学第五附属医院心内科,新疆 乌鲁木齐 830001)
心肌纤维化(myocardial fibrosis)是多种心血管疾病发展到终末阶段的必然过程,是其发病率和病死率的独立危险因素[1]。高血压病可以引起肾素-血管紧张素系统(renin-angiotensin system, RAS)激活、内皮素以及醛固酮分泌增多,是促进心肌纤维化的主要原因之一。高血压心肌纤维化的关键原因是促进和抑制纤维化细胞因子的失衡,是一个复杂病理过程,与肾素-血管紧张素-醛固酮系统(renin-angiolensin-aldosterone system, RAAS)、氧化应激、炎性反应、多种细胞因子、血管内皮功能障碍、微小RNA 等多种因素存在联系[2-5]。靶向干预或者逆转高血压引起心肌纤维化是缓解心肌纤维化病理进程的重要环节。
血管紧张素II(angiotensin II, Ang II)是RAS 系统中重要的效应分子之一[6]。Ang II 增加可引起包括心脏成纤维细胞增生在内的多种高血压性病理改变[7]。在培养的大鼠心肌成纤维细胞及心肌细胞中加入Ang II,诱导转化生长因子β1(transforming growth factor-β1, TGF-β1)表达,从而促进成纤维细胞有丝分裂和心肌细胞的原癌基因表达[6]。原癌基因c-SKI(cellular Sloan-Kettering Institute)属于Ski 家族成员,是从Sloan-Kettering 逆转录病毒中分离出的v-Ski原癌基因的细胞同源物,编码c-SKI核蛋白。在成纤维细胞发育与分化、肿瘤发生、创伤愈合、代谢疾病、脏器纤维化等均具有重要作用[8-11]。Cunnington 等[12]发现,过表达c-SKI降低心肌成纤维细胞胶原蛋白的合成、分泌和收缩功能,诱导细胞凋亡,降低其生存能力。另外,c-SKI 通过上调Meox2 表达抑制ZEB2 的功能,减少TGF-β1 诱导的肌成纤维细胞生成,抑制心肌纤维化[13]。有研究表明,c-SKI 可以诱导肌成纤维细胞凋亡[14]。然而c-SKI 表达变化对Ang II 诱导的高血压性心肌纤维化的影响及作用机制报道较少,有待研究。
本研究通过Ang II 注射小鼠或处理人冠状动脉内皮细胞(human coronary artery endothelial cells,HCAECs),构建高血压性心肌纤维化动物和细胞模型。在观察内源性c-SKI表达变化的基础上,通过给予外源性慢病毒c-SKI过表达载体,探讨外源性过表达c-SKI对高血压所致心肌纤维化细胞的作用。本研究旨在探寻靶向干预高血压性心肌纤维化的关键因子,为心肌纤维化的预防和治疗提供参考资料。
材 料 和 方 法
1 动物
SPF 级雄性C57BL/6J 小鼠,8~10 周龄,18~22 g,共12 只,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2019-0004。HCAECs 和DMEMF12培养液购于ATCC。
2 主要实验试剂
Ang II 购自北京索莱宝科技有限公司;c-SKI、CD31、Twist、Smad2/3、平滑肌蛋白22(smooth muscle protein 22, SM22)、I 型胶原(collagen type I, Col I)和α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体购自Abcam;Snail 和p-Smad2/3 抗体分别购自arigo Biolaboratoriers 和Cell Signaling Technology;Ecadherin、N-cadherin和vimentin抗体购自Affinity。
3 主要方法
3.1 小鼠高血压纤维化模型的构建 将12 只雄性C57BL/6J 小鼠随机分成两组:PBS 组(n=6)和Ang II组(n=6),分别利用渗透压微泵皮下植入小鼠慢性持续给予等体积的PBS 和Ang II(1.4 mg·kg-1·d-1),给药4 周,采用尾袖法检测小鼠血压,并评价心肌肥厚[15]。处死小鼠,取心脏组织进行病理检测。
3.2 HE 染色 取小鼠心脏组织经0.9% NaCl 溶液清洗并固定后,经乙醇脱水、二甲苯透明、浸蜡、包埋、切片、脱蜡至水、苏木精染色液染色、伊红复染、脱水封片,镜检观察并拍照。
3.3 Masson 染色 取各组小鼠心脏组织经0.9%NaCl 溶液清洗并固定后,加入Masson 复合液(苏木精水溶液-Masson蓝化液-丽春红品红染色液)进行染色,经磷钼酸溶液漂洗切片、苯胺蓝染色液复染、脱水、透明、封片,镜检观察并拍照[16]。
3.4 免疫组织化学染色 将石蜡包埋的小鼠心脏组织切片,经脱蜡/复水、0.01%枸橼酸钠缓冲液浸泡、3% H2O2灭活、5%牛血清白蛋白封闭、Ⅰ抗孵育、相应Ⅱ抗孵育、二氨基联苯胺(diaminobenzidine,DAB)或3-氨基-9-乙基咔唑(3-amino-9-ethylcarbazole, AEC)显色、苏木素复染、脱水、透明、封片,镜检观察并拍照。
3.5 细胞培养及分组 将HCAECs 培养于含10%胎牛血清、1%青/链霉素双抗的DMEM-F12 培养液中,于37 ℃、5% CO2培养箱培养至对数生长期进行后续实验。用不同浓度(0、5、10 和15 µmol/L)Ang II处理HCAECs。用10 µmol/L Ang II处理HCAECs,细胞分为PBS 组和Ang II 组。使用Lipofectamine 3000将vector 质粒和c-SKI过表达质粒转染HCAECs,并联合10 µmol/L Ang II 处理,细胞分为vector 组、c-SKI组、Ang II+vector 组和Ang II+c-SKI组。收集细胞用于进一步分析。
3.6 CCK-8 实验 细胞按实验分组进行处理后,接种至96 孔板[(1~5)×107cells/L],分别培养0、24 和48 h,弃去上清液,每孔加入10 µL CCK-8 并继续孵育4 h,酶标仪测定450 nm处吸光度。
3.7 免疫荧光染色 将HCAECs接种于内置细胞爬片的24 孔板中,按实验分组处理后,经4%多聚甲醛室温固定30 min、0.1% Triton X-100 室温通透10 min、PBS 冲洗、5% PBS-牛血清白蛋白室温封闭30 min、Ⅰ抗4 ℃孵育过夜、荧光标记的Ⅱ抗室温避光孵育40 min、1 mg/L DAPI染核、90%甘油或抗猝灭剂封片,荧光显微镜下观察并拍照,或4 ℃避光保存。
3.8 Western blot 实验 提取组织和细胞总蛋白,BCA 法测定蛋白浓度后,取适量蛋白样品进行电泳分离,转至PVDF 膜上,5%脱脂奶粉室温封闭2 h,4 ℃过夜孵育Ⅰ抗(c-SKI、CD31、Col I、α-SMA、Twist、p-Smad2/3、Smad2/3、E-cadherin、N-cadherin 和vimentin 抗体,1∶1 000;Snail 抗体,1∶500),室温孵育Ⅱ抗2 h,显影拍照,使用ImageJ 软件进行灰度分析并计算相对表达量。
3.9 流式细胞术 收集细胞沉淀,加入400 µL结合缓冲液重悬细胞,按1∶1 比例加入annexin V-FITC 和propidium iodide 各5 µL 并轻微混匀,室温避光反应5~15 min后,使用流式细胞仪检测细胞凋亡情况。
4 统计学处理
用SPSS 18.0 统计软件进行分析。实验数据以均数±标准差(mean±SD)表示,两组比较采用t检验,多组间比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 Ang II诱导小鼠高血压性心肌纤维化
与PBS组相比,Ang II组小鼠尾动脉压力显著增加(P<0.01),见图1A;HE 和Masson 染色结果显示,Ang II组小鼠心肌细胞肥大,心肌纤维化和心肌细胞周围蓝色胶原纤维显著增加、心肌内小血管周围可见明显胶原纤维沉积,见图1B、C;免疫组织化学染色结果表明,Ang II 组小鼠心肌组织c-SKI、CD31 和SM22 表达显著下调(P<0.01),见图1D~F;Western blot 结果显示,Ang II 组小鼠心肌组织CD31 表达显著下调(P<0.01),Col I 和α-SMA 表达显著上调(P<0.01),见图1G。
2 Ang II 对HCAECs 形态、活力和c-SKI 表达的影响
随着Ang II 浓度的增加,HCAECs 形态发生改变,细胞连接松散,见图2A;10和15 µmol/L Ang II处理48 h 后,细胞活力显著下降(P<0.01),见图2B。选用10 µmol/L作为Ang II的最低有效剂量进行后续实验。免疫荧光染色结果显示,与PBS 组相比,Ang II(10 µmol/L)组HCAECs 中c-SKI 表达显著下调(P<0.01),见图2C。
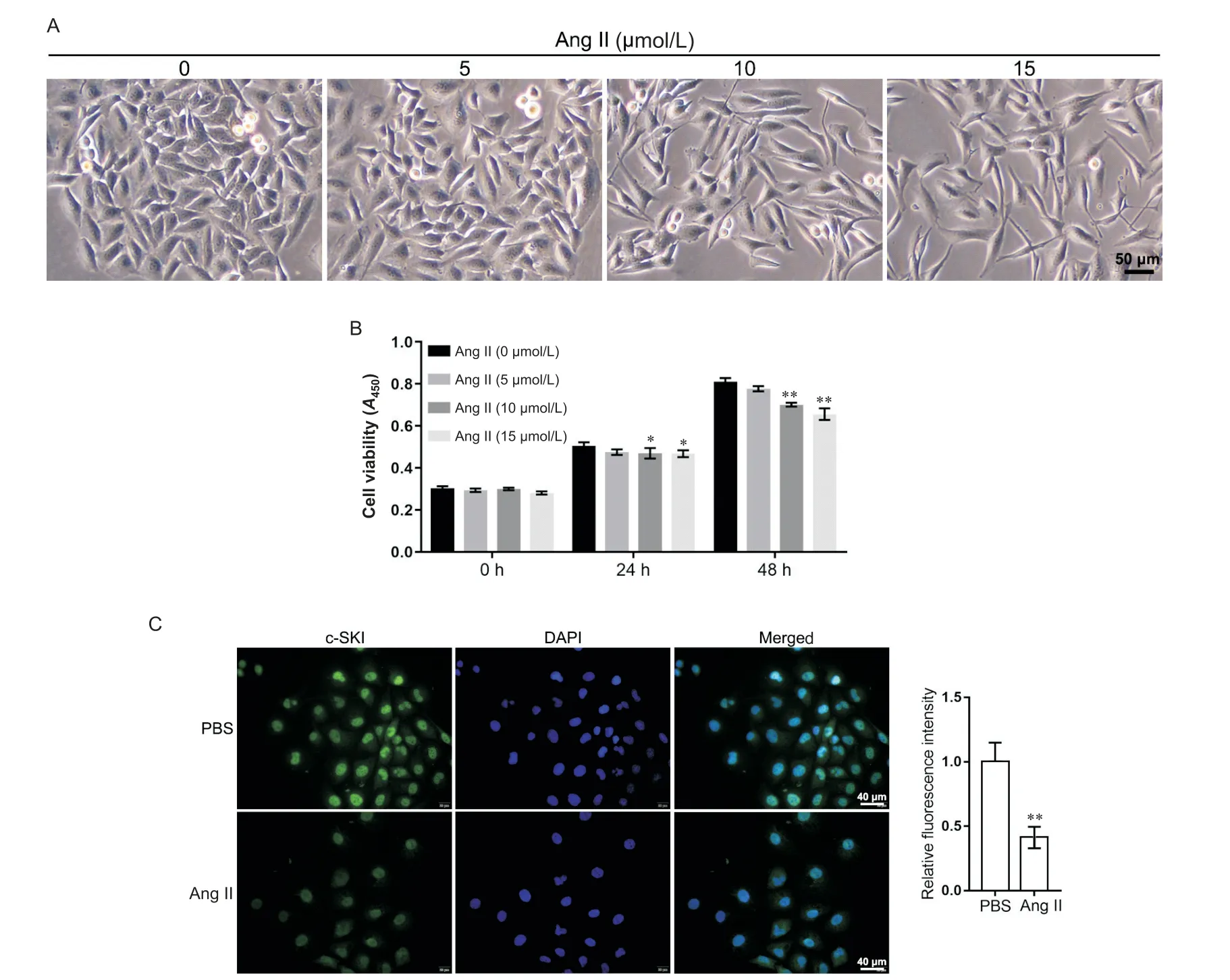
Figure 2.Effects of angiotensin II(Ang II) treatment on the morphological changes, viability and c-SKI expression in human coronary artery endothelial cells (HCAECs).A: the morphological changes of HCAECs observed by microscopy (scale bar=50µm); B: the cell viability measured by CCK-8 assay; C: immunofluorescence staining of c-SKI in HCAECs treated with 10 µmol/L Ang II (scale bar=40 µm).Mean±SD.n=3.**P<0.01 vs 0 µmol/L Ang II or PBS group.图2 Ang II处理对HCAECs形态、活力和c-SKI表达的影响
3 Ang II 对HCAECs 中CD31、α-SMA 及上皮-间充质转化(epithelial-mesenchymal transition, EMT)通路蛋白表达的影响
免疫荧光染色结果显示,与PBS 组相比,Ang II组HCAECs 中CD31 表达显著下调,α-SMA 显著上调(P<0.01),见图3A、B;Western blot 结果显示,Ang II组HCAECs 中CD31 表达显著下调,Col I、α-SMA、Twist、Snail 和p-Smad2/3 显著上调(P<0.01),Smad2/3无显著差异(P>0.05),见图3C、D。

Figure 3.Effects of angiotensin II(Ang II) treatment on the expression of CD31, α-smooth muscle actin(α-SMA) and epithelialmesenchymal transition (EMT) pathway proteins in human coronary artery endothelial cells (HCAECs).A and B: the expression of CD31 and α-SMA in HCAECs detected by immunofluorescence (scale bar=40 µm); C and D: the protein levels of CD31, collagen type I (Col I), α-SMA, Twist, Snail, p-Smad2/3 and Smad2/3 in HCAECs detected by Western blot.Mean±SD.n=3.**P<0.01 vs PBS group.图3 Ang II对HCAECs中CD31、α-SMA及EMT通路蛋白表达的影响
4 c-SKI过表达联合Ang II处理对HCAECs的影响
CCK-8 结 果 显 示,与vector 组 相 比,c-SKI 组HCAECs 的活力显著上升(P<0.01),Ang II+vector 组细胞活力显著下降(P<0.01);与Ang II+vector 组相比,Ang II+c-SKI 组细胞活力显著升高(P<0.01),见图4A。流式细胞术结果显示,与vector组相比,c-SKI组细胞凋亡率显著降低(P<0.01),Ang II+vector组细胞凋亡率显著升高(P<0.01);与Ang II+vector 组相比,Ang II+c-SKI 组细胞凋亡率显著降低(P<0.01),见图4B。免疫荧光染色结果显示,与vector 组相比,c-SKI 组α-SMA 表达显著下调(P<0.01),Ang II+vector 组α-SMA 表达显著上调(P<0.01);与Ang II+vector 组相比,Ang II+c-SKI 组α-SMA 表达显著下调(P<0.01),见图4C。Western blot 结果显示,与vector 组相比,c-SKI 组c-SKI、CD31 和E-cadherin 表达显著上调(P<0.01),α-SMA、Col I、Twist、Snail、p-Smad2/3、N-cadherin 和vimentin 显著下调(P<0.01),Smad2/3无显著差异(P>0.05),Ang II+vector 组c-SKI、CD31和E-cadherin 表达显著下调(P<0.05),α-SMA、Col I、Twist、Snail、p-Smad2/3、N-cadherin 和vimentin 显著上调(P<0.01),Smad2/3 无显著差异(P>0.05);与Ang II+vector 组相 比,Ang II+c-SKI 组c-SKI、CD31 和Ecadherin 表达显著上调(P<0.01),α-SMA、Col I、Twist、Snail、p-Smad2/3、N-cadherin 和vimentin 显著下调(P<0.01),Smad2/3 无显著差异(P>0.05),见图4D~F。
讨 论
心血管疾病是全球慢性非传染性疾病致死的主要原因之一,其中约有1750 万非传染性疾病的死亡是由心血管疾病引起,严重威胁着人类的健康,造成沉重的社会负担[1,17]。慢性心血管疾病的核心病理改变是以心肌肥厚、心肌细胞丢失及心肌组织纤维化为特征的心脏组织异常重构。其中,心肌纤维化是多种心血管疾病发展到终末阶段的必然过程,与心律失常、心功能障碍甚至心源性猝死密切相关,是心血管疾病发病率和病死率的独立危险因素[1]。因此,基于对心肌纤维化的干预甚至逆转已成为心脏病防治的新靶标[18]。
高血压病作为心血管疾病不良预后的首要危险因素,是引起心力衰竭的主要原因之一,可以引起RAS 激活、内皮素和醛固酮分泌增多,是促进心肌纤维化的主要原因之一。高血压心肌纤维化的关键原因是促进和抑制纤维化细胞因子的失衡。研究表明,Ang II在高血压心脏重构和心肌纤维化的发生发展中起着重要作用[19-21]。c-SKI既抑制成纤维细胞表型转换,也促进成纤维细胞增殖[22]。Cunnington等[12]的研究显示,c-SKI 主要通过改变成纤维细胞表型参与调控心肌纤维化。然而c-SKI 表达变化对Ang II诱导的高血压性心肌纤维化的影响及其作用机制报道较少。
给予Ang II,能直接影响心肌,诱发高血压,是一种公认的诱导高血压心肌纤维化的方法[23-24]。本研究通过注射Ang II 构建高血压性心肌纤维化小鼠模型后,小鼠血压升高,心肌细胞肥大、周围出现较多蓝色胶原纤维、沉积明显,结果与研究报道一致[15-16]。Ang II 组CD31 显著下调,Col I 和α-SMA 显著上调,进一步提示了高血压性心肌纤维化小鼠模型构建成功。在动物体内,Ang Ⅱ导致高血压心肌纤维化的同时引起c-SKI 下调。通过Ang II 处理HCAEC 构建细胞模型,结果与上述动物实验一致。进一步研究c-SKI对Ang II 诱导的HCAECs 模型的影响,表明过表达c-SKI能部分消除Ang II诱导的HCAECs活力降低,使细胞凋亡率降低,α-SMA、Col I、Twist、Snail、p-Smad2/3、N-cadherin 和vimentin 显 著 下 调,c-SKI、CD31 和E-cadherin 显著上调。这揭示c-SKI在高血压心肌纤维化进展中具有重要作用,为高血压心肌纤维的治疗提供了参考资料。
综上所述,本研究应用Ang II 持续性输注形成高血压心肌纤维化模型,结果显示在小鼠体内高水平Ang II 导致高血压纤维化的同时引起心脏组织中c-SKI显著下调,而过表达c-SKI能够减轻Ang II诱导的心肌纤维化。本研究仅探讨c-SKI表达变化对心肌纤维化的影响,未对c-SKI表达与心肌纤维化的潜在机制和靶点进行阐释说明,这些问题需要进一步的实验来探索。

