新生儿败血症并发心肌损害患儿血清miR-16、CF-6、Copeptin水平变化意义*
杨慧洁,刘定远,黄久浪,彭 好,罗晓斌
遂宁市中心医院儿科,四川遂宁 629000
新生儿败血症是由多种微生物感染所致的全身感染性疾病,病情危重者28 d死亡率高达33.2%左右,其中心肌损害发生率约13.8%,会导致病死率上升至70%~90%,防治形势极为严峻[1-2]。既往临床多选择经典的心肌损害标志物,如心肌肌钙蛋白I(cTnI)、心脏型脂肪酸结合蛋白(H-FABP)进行早期诊断,但由于新生儿败血症并发心肌损害的机制较为复杂,单纯依靠上述标志物难以准确反映心肌损害发生发展机制和具体病情,需寻找更多相关标志因子[3]。有研究表明,微小RNA-16(miR-16)在炎症反应病理机制中发挥重要作用,参与心肌炎症反应发生发展过程[4]。线粒体偶联因子-6(CF-6)属于线粒体三磷酸腺苷(ATP)合酶的主要组成部分,在炎症、心肌损害中呈异常升高状态[5]。和肽素(Copeptin)作为精氨酸加压素(AVP)原羧基末端的一部分,具有加快炎症介质释放、诱发过度炎症反应作用,异常表达会损害心肌细胞[6]。目前,三者在新生儿败血症并发心肌损害患儿中的检测价值仍有待验证。为此,本研究尝试探讨新生儿败血症并发心肌损害患儿miR-16、CF-6、Copeptin的水平变化及检测价值,现报道如下。
1 资料与方法
1.1一般资料 选取本院2020年1月至2022年9月收治的105例新生儿败血症患儿作为研究对象。纳入标准:(1)均经血培养证实细菌或病毒阳性;(2)实验室检查显示白细胞计数>20×109/L或<5×109/L,C反应蛋白>100 mg/L,血小板计数<100×109/L;(3)符合《新生儿败血症诊断及治疗专家共识(2019年版)》中新生儿败血症诊断标准[7]。排除标准:(1)合并先天性心脏病、支气管肺发育不良及其他脏器结构畸形等先天性疾病;(2)伴有凝血功能障碍、血液疾病、窒息;(3)存在免疫缺陷疾病、遗传代谢性疾病、染色体疾病;(4)入院前接受抗感染治疗。本研究经医院伦理委员会审批通过,患儿监护人均知情本研究,自愿签订知情同意书。根据105例新生儿败血症患儿是否并发心肌损害分为心肌损害组(43例)与无心肌损害组(62例)。判定标准[8]:心肌损害标志物血清cTnI>0.1 ng/mL、H-FABP>10.0 ng/mL即可判定为并发心肌损害。
1.2方法 于所有患儿入院次日清晨采集空腹外周静脉血3 mL,采用日本久保田KA-220型血清离心机进行离心处理,离心半径为10 cm,离心速率为3 000 r/min,离心时间为10 min,取上清液,保存于-80 ℃条件下,备用。
1.2.1血清miR-16水平检测 按照德国Qiagen公司miRNeasy Serum/Plasma Kit试剂盒说明书提取mRNA,采用中国TianGen公司FastQuant RT试剂盒将mRNA进行逆转录为cDNA,使用美国Applied Biosystems公司Sequence Detection系统及中国TianGen公司SYBR Green PCR试剂盒进行荧光定量聚合酶链反应(qPCR),扩增条件:95 ℃预变性10 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共40个循环。采用U6基因作为内参基因。引物序列:miR-16正向引物为5′-TCGGCGTAGCAGCACGTAAAT-3′,反向引物为5′-GTATCCAGTGCAGGGTCCGAGGT-3′;U6正向引物为5′-GCAACTAGGATGGTGTGGCT-3′,反向引物为5′-TCCCATTCCCCAGCTCTCATA-3′。采用2-ΔΔCt计算血清miR-16的相对表达水平。
1.2.2血清cTnI、H-FABP、CF-6、Copeptin水平检测 检测仪器为购自武汉明德生物科技股份有限公司的QMT 8000免疫定量分析仪及配套试剂盒,采用快速固相免疫层析法检测血清cTnI、H-FABP水平,放射免疫固相法检测血清CF-6水平,酶联免疫吸附试验检测血清Copeptin水平,实验过程由专业人员严格按照试剂盒说明书执行。
1.2.3病情判定 (1)败血症病情程度判定:参考文献[9]根据新生儿危重病例评分(NCIS)将所有患儿分为非危重(>72分)、危重(56~72分)、极危重(<56分)。(2)心肌损害组病情判定:心功能采用纽约心脏协会(NYHA)心功能分级[10]判定,分级越高,提示心功能越差;心脏收缩功能障碍参考文献[11]将左心射血分数(LVEF)<50%判定为心脏收缩功能障碍,LVEF≥50%判定为无心脏收缩功能障碍。
1.3观察指标 (1)两组一般资料、心肌损害标志物水平,一般资料包括胎龄、性别、出生体重、败血症类型、感染类型、败血症病情程度等资料;(2)两组血清miR-16、CF-6、Copeptin水平;(3)心肌损害组血清miR-16、CF-6、Copeptin与心肌损害标志物相关性;(4)血清miR-16、CF-6、Copeptin对新生儿败血症并发心肌损害的诊断价值;(5)心肌损害组不同病情患儿血清miR-16、CF-6、Copeptin水平;(6)血清miR-16、CF-6、Copeptin与新生儿败血症并发心肌损害患儿病情的关系。
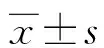
2 结 果
2.1两组一般资料、心肌损害标志物水平 两组胎龄、性别、出生体重、败血症类型、感染类型差异无统计学意义(P>0.05),心肌损害组败血症病情严重程度及血清cTnI、H-FABP水平高于无心肌损害组(P<0.05)。见表1。

表1 两组一般资料、心肌损害标志物水平比较[n(%)或
2.2两组血清miR-16、CF-6、Copeptin水平 心肌损害组血清miR-16、CF-6、Copeptin水平高于无心肌损害组(P<0.05)。见表2。
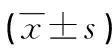
表2 两组血清miR-16、CF-6、Copeptin水平比较
2.3心肌损害组血清miR-16、CF-6、Copeptin与心肌损害标志物相关性 Pearson相关性分析显示,心肌损害组血清miR-16、CF-6、Copeptin与cTnI(r=0.702、0.536、0.524)、H-FABP(r=0.683、0.609、0.558)均呈正相关(均P<0.001)。
2.4血清miR-16、CF-6、Copeptin对新生儿败血症并发心肌损害的诊断价值 ROC曲线分析显示,血清miR-16、CF-6、Copeptin诊断新生儿败血症并发心肌损害的曲线下面积(AUC)分别为0.726(95%CI:0.630~0.808)、0.743(95%CI:0.649~0.824)、0.846(95%CI:0.762~0.909),三者联合诊断新生儿败血症并发心肌损害的AUC为0.913(95%CI:0.842~0.959),优于三者单一指标诊断。见图1。

图1 血清miR-16、CF-6、Copeptin对新生儿败血症并发心肌损害的诊断价值
2.5心肌损害组不同病情患儿血清miR-16、CF-6、Copeptin水平 心肌损害组心功能分级为Ⅲ~Ⅳ级患儿血清miR-16、CF-6、Copeptin水平高于Ⅱ级患儿及Ⅰ级患儿,Ⅱ级患儿高于Ⅰ级患儿,差异有统计学意义(P<0.05);心肌损害组有心脏收缩功能障碍患儿血清miR-16、CF-6、Copeptin水平高于无心脏收缩功能障碍患儿,差异有统计学意义(P<0.05)。见表3。
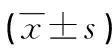
表3 心肌损害组不同病情患儿血清miR-16、CF-6、Copeptin水平比较
2.6血清miR-16、CF-6、Copeptin水平与新生儿败血症并发心肌损害患儿病情的关系 Spearman相关性分析,血清miR-16、CF-6、Copeptin水平与新生儿败血症并发心肌损害患儿心功能分级(r=0.622、0.605、0.581)、心脏收缩功能障碍(r=0.613、0.630、0.596)呈正相关(均P<0.001)。
3 讨 论
新生儿败血症是一个复杂的、多系统损伤的病理生理学改变过程,心脏被认为是其病情进展过程中累及最严重的脏器,通常表现为心肌损害、左心收缩功能下降,一旦累及心脏,则极易导致病死风险显著增加,是临床诊治新生儿败血症的重要关注点。
miR-16是一种参与炎症反应及免疫调节的miRNA因子,祁宏亮等[12]研究表明,与健康新生儿比较,新生儿败血症患儿miR-16表达显著上调,与新生儿败血症炎症反应密切相关。本研究尝试探讨miR-16在新生儿败血症并发心肌损害患儿中的水平变化,结果显示,心肌损害组血清miR-16水平高于无心肌损害组,与心肌损害标志物cTnI、H-FABP呈正相关。考虑为以下几点原因:miR-16能通过抑制Toll样受体4、白细胞介素-1受体相关激酶1的表达促进炎症反应进展,从而增加累及心脏风险[13];动物实验显示,miR-16过度表达会降低心肌细胞活力,加快心肌细胞凋亡,导致心功能不全加重,而敲除miR-16基因能够逆转上述变化,减轻心肌损害[14]。此外,miR-16相关信号通路改变是心肌细胞氧化应激损伤的重要机制之一[15]。由此可知,miR-16在新生儿败血症并发心肌损害过程中发挥重要作用。本研究进一步研究证实,血清miR-16诊断新生儿败血症并发心肌损害的价值良好,且miR-16水平与心功能分级、心脏收缩功能障碍显著相关,能为临床早期诊断、心肌损害程度评估提供数据支持。
CF-6主要依赖线粒体存在于人体血管内皮细胞膜、心肌组织等多种组织中,一旦线粒体发生损伤,CF-6便会释放入血,并随着线粒体损伤加重不断释放,导致其在血液循环中的含量明显升高[16]。线粒体作为全身性感染的主要靶器官,在新生儿败血症发生早期就出现损伤,这与刘雨等[17]报道中血清CF-6水平在新生儿败血症早期呈明显上升趋势的结果相符。在此基础上,本研究结果表明,心肌损害组血清CF-6水平高于无心肌损害组,与cTnI、H-FABP水平呈正相关,可见CF-6参与新生儿败血症并发心肌损害的过程。有研究显示,新生儿败血症并发心肌损害时血管内皮细胞损伤、内皮功能改变,导致血管内皮细胞膜上的CF-6迅速释放入血,致使炎性细胞活化,释放出大量炎症介质,介导心肌损害,并经氧化应激、炎症应答等途径明显增加线粒体膜通透性,进一步促使CF-6过多释放,形成恶性循环[18-19]。同时,本研究发现,血清CF-6可作为临床诊断新生儿败血症并发心肌损害的重要辅助指标,且其水平变化与心功能分级、心脏收缩功能障碍联系紧密,有助于临床准确评估病情进展。
Copeptin是AVP前体的一个稳定片段,在AVP的成熟与转运过程中扮演着关键角色,且与AVP相比,在机体代谢中具有稳定性好、易检测等优点,故临床通常选择Copeptin来取代AVP检测[20]。本研究结果表明,新生儿败血症并发心肌损害患儿血清Copeptin水平高于无心肌损害患儿,与孙瑞雪等[21]报道的结果一致。本研究结果还发现,Copeptin水平与cTnI、H-FABP水平呈正相关,提示血清Copeptin水平变化与新生儿败血症并发心肌损害有关。原因可能在于:AVP是一种下丘脑-垂体-肾上腺轴的重要激素,在促肾上腺皮质激素分泌的内分泌应激反应中发挥重要作用,能够加快皮质醇、促肾上腺皮质激素的释放,从而介导多种炎症介质过度表达,诱发并加重机体内炎症反应,间接损伤心肌组织[22]。Copeptin本身也是心肌损害的危险因素之一,其表达异常升高会增加心肌细胞坏死、心功能不全风险[23]。本研究结果还证实,血清Copeptin不仅在新生儿败血症并发心肌损害诊断中有较高的价值,还与心功能分级、心脏收缩功能障碍密切相关,可作为其诊治的重要参考指标。
此外,单一指标在检测过程中出现的偏差及临床实际中多种因素的干扰会影响指标检测效能,因此本研究尝试探讨血清miR-16、CF-6、Copeptin联合检测价值,结果发现三者联合诊断新生儿败血症并发心肌损害价值明显优于单一诊断,三者联合不仅能提高诊断准确性,还有利于准确评估心肌损害改变情况,为临床提供更可靠的参考依据。本研究的不足之处在于未详细探讨血清miR-16、CF-6、Copeptin水平变化对新生儿败血症并发心肌损害患儿预后情况的影响,今后需做进一步探讨与分析。
综上所述,血清miR-16、CF-6、Copeptin联合检测可作为新生儿败血症并发心肌损害的重要辅助诊断途径,且三者水平变化与病情显著相关,可为临床早期诊断、病情评估提供参考依据。

