黑龙江省甜菜根腐病的病原菌分离与鉴定
刘永龙,李 泰,崔汝菲,耿 贵,於丽华,王宇光
(黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
甜菜是两年生草本植物,在世界范围内被广泛地种植,是世界两大糖料作物之一,具有很高的经济价值,其加工产品市场潜力很大[1]。随着市场的不断扩大,生产不断集约化导致土传病害不断加剧,造成了一定的经济损失,甜菜土传病害主要有立枯病、褐斑病、根腐病等,其中甜菜根腐病是由多种真菌或细菌侵染引起的块根腐烂病的总称[2-4]。全国甜菜栽植区每年遭受此病害不同程度的危害,特别是种植甜菜多年的区域发病更严重。此病害通常可导致甜菜减产10%~40%,使含糖率大幅降低,甚至会造成绝产[4]。王文君等[5]研究提及甜菜根腐病首次被发现是在美国,之后诸多国家先后发现了此病的存在,包括中国、印度等。曲文章等[6]研究发现,由于此疾病,美国每年损失约5%的甜菜产量。可以看出,甜菜根腐病是一种影响所有品种甜菜的疾病,其危害性较大,可导致种植甜菜经济利益降低。
甜菜根腐病通常出现于甜菜块根膨大期之后,致病菌是由诸多真菌或细菌组成,已发现的此类真菌与细菌包括:Fusariumspp.(镰刀菌)[7]、Rhizoctoniaspp.(丝核菌)[8]、Sclerotiumspp.(小核菌)[9]、茎点属真菌(Phomaspp.)[10]、Aphanomycesspp.(丝囊菌)[11]、Bacillusspp.(黄湿腐杆菌)[12]、Pythiumaphanidermatum(瓜果腐霉)、Pythiummonospermum(简囊腐霉)和Pythiumspp.(腐霉属)[13]。病原菌种类多而复杂,且受环境因素影响较大,一般症状可分为以下3种:(1)干腐,又称作根茎腐烂病,发病期会从叶柄基部形成暗褐色病斑,叶片出现萎蔫下垂;(2)尾腐,即根尾腐烂,通常出现于直根上,黑色腐烂产生于根尾,再慢慢朝上蔓延,病部维管束呈黄褐色,当遇到潮湿或多雨环境,病部见水渍状软腐现象,散发酸臭味,容易拔起,但大多会将烂根部留于土壤内,属于一类细菌病害;(3)黑腐则是发病从根头向下侵染,病组织变黑,一般腐烂发生在后期,先从块根一侧表皮侵染,出现褐色小斑点,逐渐扩大成为凹陷斑,然后向四周和根部扩散,有的从根冠部侵染,导致腐烂,感染由根部表面开始,慢慢发展至根体内部,导致块根内部组织发生腐烂,当处于干燥环境下,病部常会失水产生空洞,块根外皮呈皱缩状态,出现裂缝。诸多病原菌皆可引发甜菜根腐病,国内外长期以来,关于甜菜病害的发生、分析和预防的报告很多,但由于对甜菜根腐病的病原体缺乏了解,这会导致对病害原因的错误评估,延误病害的及时防治,从而造成经济损失。本试验通过对甜菜块根膨大期根腐病病害进行调查,并对致病病原菌进行分析,旨在初步研究甜菜致病病原菌类型[14],为甜菜根腐病防治工作提供参考。
1 材料与方法
1.1 供试材料
1.1.1 供试样品
2022年9月于黑龙江省哈尔滨市黑龙江大学呼兰校区试验基地田间采集具有明显发病症状的甜菜块根,进行分离和培养。此外,还收集了健康的甜菜块根。
1.1.2 培养基
使用PDA(马铃薯葡萄糖琼脂)碳水化合物培养基(含有20 g葡萄糖,20 g琼脂,250 g马铃薯)。过滤后的马铃薯汁与葡萄糖和琼脂混合,然后将滤液与蒸馏水混合,稀释为1 L的总量,121 ℃灭菌,培养基温度降低到50~60 ℃,转移到经过消毒的培养皿中完成培养基的制备分离和培养病原真菌。
1.1.3 仪器设备
PCR扩增仪、离心机、光学显微镜、恒温培养箱和超净工作台。
1.2 试验方法
1.2.1 病原菌分离与培养
用自来水清洗受感染的甜菜块根,于块根段病健组织相交部位采样,切成5 mm×5 mm的小块,将病组织小块浸入75%酒精溶液30 s后,用无菌镊子取出,灭菌水洗涤3遍,灭菌滤纸将留存水分吸除干净,移至PDA培养基平板上,各平板放置的病组织数量皆为3块,用密封膜来封闭培养皿。将培养皿倒置在设定为恒温(25 ℃)的培养箱中,定期观察,并观察菌落的生长情况,有菌丝长出时,于无菌超净工作台上,用无菌接种针对菌落边缘进行挑取,转移到1个新鲜的培养基平板上进行纯化培养,建立与之前相同的培养条件,再使用平板稀释法进行单孢分离,将分离的真菌培养,观察是否有单个菌落的生长[15]。4 ℃存放,待用。
1.2.2 病原菌致病性的测定
根据科赫法则进行致病性测试。选择健康的甜菜块根,在流水下清洗,并向接种部位添加75%的酒精(按体积分数)。当酒精挥发时,用穿孔法冲打甜菜块根,并将菌丝体侧覆盖在待接种的甜菜块根上。作为对照,接种无菌PDA培养基块。每种真菌设3次重复,在25 ℃黑暗中培养,监测接种菌饼甜菜块根观察发病情况。再次从病斑区提取致病菌培养。如果在形态学比较方面与原始接种菌株相匹配,则可以得出结论与致病菌属于同一物种。
1.2.3 病原菌的形态学鉴定
对致病菌的菌落的颜色,形状等进行观察,选择菌丝用于创建致病显微镜载玻片,并使用光学显微镜检查菌丝分生孢子和分生孢子的大小、颜色和形状,分生孢子梗的形态特征及厚垣孢子的有无,完成病原微生物的分类鉴定[16-17]。
1.2.4 病原菌的分子生物学鉴定
当培养基被纯化后的病原菌几乎完全覆盖时,将菌丝体刮入研钵中,将其放入液氮中,然后快速研磨。使用快速提取DNA的试剂盒(上海生物技术的产品),提取菌株的基因组并将其用作PCR扩增步骤的模板。使用热裂解法提取DNA,在-20 ℃保存。使用真菌通用引物ITSl(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTYATYGATATGC-3′)对致病菌基因进行PCR扩增。扩增步骤如下:在94 ℃下预变性4 min、94 ℃下变性45 s、55 ℃退火、72 ℃下延伸1 min,共 35 个循环;72 ℃环境下10 min修复延伸。25 μL 的PCR 反应体系:Template基因组 DNA (20~25 ng/μL) 0.5 μL、10×Buffer(with Mg2+)2.5 μL、dNTP(各2.5 mmol/L)1 μL、酶0.2 μL、引物 ITS1(10 μmol/L)、ITS4 (10 μmol/L),加 ddH2O至25 μL。PCR扩增产物的测序由上海生工公司使用放置在琼脂糖凝胶(8 g/L)中的4~5μL PCR扩增产物进行电泳分析。
构建系统发育树:通过将分离的ITS序列上传到NCBI(www.ncbi.nlm.nih.gov)来创建系统发育树,根据同源性对待检病菌的生物类型进行初步诊断,进行了在线BLAST核酸序列比对。连接了NCBI数据库中的属和外群的序列。利用MEGA-X构建进化树,比较确认致病菌的生物学种。
2 结果与分析
2.1 病原菌的分离、纯化与回接再分离
田间甜菜块根部腐烂的皮层从根的外部扩散到内部,使块根变成棕色或黑褐色并出现腐烂。最终,整个根部腐烂(图1)。
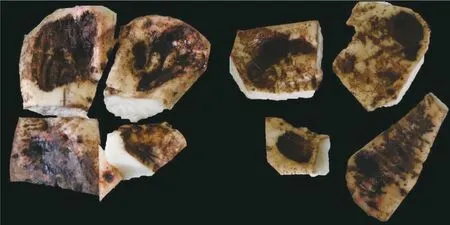
图1 田间根腐病危害的甜菜块根Fig.1 Sugar beet taproots damaged by root rot in the field
从发病甜菜块根中分离得到3种真菌分离株,为了确定这3种分离株的致病性,将这些分离株的纯化菌株接种到健康的甜菜块根部。然后将接种的块根在遮光的培养箱(25 ℃)中以恒温培养15 d。致病性测定结果显示,从患病甜菜块根中分离纯化的1种菌株具有致病性,可导致甜菜块根的根腐病(图2-A、B、C)。另外2种真菌被确定不是甜菜根腐烂的原因,与对照组没有差异(图2-D)。根据科赫法则,对病变组织实施再次组织分离培养,分离纯化所得菌株在形态上相符于原菌株。通过这种方式初步可以确定在测试样品中引起根腐病的病原体为镰刀菌,下一步进行分子生物学鉴定。

图2 分离病原菌回接健康甜菜块根发病情况Fig.2 Inoculation of isolated pathogens on healthy sugar beet taproots
2.2 病原菌的形态鉴定
在PDA培养基上,菌株BY-1发育得较快,菌落是灰白色的。从显微镜下看,分生孢子呈镰刀状。小孢子的大小为(16.28~24.28)μm×(5.52~9.4)μm,形状为卵形或椭圆形。大孢子的大小为(33.21~49.72)μm×(7.75~9.21) μm;大多数有0~3个隔膜;它们分散在气生菌丝上,分生孢子梗隔膜顶端有孢子脱落痕迹,有厚垣孢子,呈现圆形(图3-A、B)。

图3 病原菌菌株BY-1在PDA培养上的菌落形态特征(A)、菌丝和分生孢子形态(B)Fig.3 Morphological characteristics of colonies(A),mycelium and conidia morphology(B) of pathogenic strain BY-1 on PDA culture
2.3 病原菌的分子生物学鉴定
对于纯化菌株rDNA-ITS,经由真菌通用引物ITSl/ITS4实施PCR 扩增处理,并测序,BY-1菌株的ITS区序列长为542 bp(图4)。序列提交NCBI数据库GenBanK,获得基因序列登录号为 BALST,序列比对结果表明,菌株BY-1为镰孢属腐皮镰孢菌(图5)。

图4 菌株PCR产物的1%琼脂糖凝胶电泳Fig.4 Electrophoresis of 1% agarose gel of strain PCR products

图5 菌株BY-1序列系统发育树Fig.5 Phylogenetic tree of strain BY-1 sequence
3 讨论
甜菜根腐病是由土源性病原菌引起的根腐病,致病菌可以通过菌丝体或菌核在土壤或植物病害残留物中存活长达2~3年。该病害可通过患病甜菜(块根或幼苗)、降雨、土壤作为载体进行传播。大多资料表明,当地的气象条件和土壤环境因素与甜菜根腐病的流行有着密不可分的关系。在老的生产区,土壤为粘土,排水不良,连作以及地势低洼的区域,再加上高温、高湿环境,会加剧甜菜根腐病的发生。
镰孢真菌属于一类主要的植物病原真菌[18],其在较大程度上影响到多种植物的生长,是全球粮食生产体系中一类关键性的致病因素。病发严重时导致作物产量骤减[19],不同的地理位置、气候、土壤等条件又导致镰孢菌的组成各不相同[20-21]。本研究的试验地位于黑龙江省的半干旱地区,推测区域气候的影响是导致该病害在甜菜块根膨大期后侵染的原因。块根膨大期处于高温、高湿的生长环境中导致根腐病容易发生,国外品种在我国,尤其在黑龙江省,受到当地气候的影响常会发生根腐病。在早期调查中,像ITS、tef1等方法最常被利用[22]。如高园园等[23]根据ITS和tef1基因序列的分子鉴定,建立了系统发育树,发现尖孢镰孢菌(Fusariumoxysporum)是引起山东大蒜根腐病的主要病原真菌。刘文杰等[24]以rDNA-ITS序列为基础,进行系统发育树的构建,确定腐皮镰刀菌(Fusariumsolani)和匍枝根霉菌(Rhizopusstolonifer)是引起山东青岛胶州南瓜果实腐烂的病原菌。在本试验中,通过形态学观察、ITS和tef1基因序列的分子鉴定以及建立基因系统发育树,可以将分离出的BY-1菌株鉴定为腐皮镰孢菌,为该病原菌甜菜的防治提供了理论依据。除此之外,腐皮镰孢菌的可侵染植物种类较多[25],不但能造成甜菜的根腐病,还可以侵染其他农产品,例如桃子[26]、咖啡[27]、香蕉[28]等,造成其果实腐烂,还可以造成茶叶、刺桐等的叶斑病和枯萎病[29]。本试验鉴定所得BY-1菌株的具体侵染面积需要通过更为深入的研究来明确,此研究能为更深入地研究此病害的防控管理给予指导。
4 结论
综上所述,黑龙江大学呼兰校区根腐病甜菜中分离出菌株BY-1。致病性测试和形态学观察得出的初步结论为镰孢菌是导致甜菜根腐烂的病原体。经进一步鉴定病原体,并在验证科赫氏法则后,运用分子生物学技术PCR扩增致病菌基因,建立系统发育树后确定该致病菌为腐皮镰孢菌(Fusariumsolani)。

