阿托伐他汀联合尿激酶在慢性硬膜下血肿患者神经内镜术后治疗中的应用效果及对疾病复发的影响
江金文,吴维蒲,刘卫兵
作者单位: 332000 江西省九江市第一人民医院神经外科
慢性硬膜下血肿(CSDH)是一种常见的神经外科病症,多见于老年人群。CSDH患者发生血肿的部位多为硬脑膜和蛛网膜之间,血肿可见包膜且进展缓慢,患者早期多见头痛、恶心呕吐等症状,缺乏特异性,难以引起重视。随着疾病进展可能出现偏瘫、失语等现象,少数患者可伴有癫痫发作,至疾病后期可发生脑萎缩,严重危害患者的生命安全[1]。目前临床多采用手术对血肿进行引流。神经内镜术具有头皮创口小、骨窗小、手术时间短等优势,对脑皮质损伤小,有利于术后恢复[2],但CSDH术后复发率仍较高,仅进行硬膜下疏通并不能完全缓解,因此给予有效的术后治疗具有重要意义。临床通常在清除血肿后给予尿激酶进行治疗,但临床效果有限。阿托伐他汀可缓解动脉硬化程度,促进血管新生[3]。现观察阿托伐他汀联合尿激酶在CSDH患者神经内镜术后治疗中的应用效果及对疾病复发的影响,报道如下。
1 资料与方法
1.1 临床资料 选取2020年2月—2022年5月九江市第一人民医院收治的CSDH患者88例,按照红蓝球法分为对照组与观察组,每组44例。对照组:男23例,女21例;年龄46~72(65.97±5.32)岁;病程4~9(6.48±0.70)周。观察组:男25例,女19例;年龄48~73(66.08±5.07)岁;病程3~10(6.52±0.75)周。2组临床资料比较,差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准。所有患者对本研究知情并签署知情同意书。
1.2 病例选择标准 纳入标准:(1)符合《慢性硬膜下血肿药物治疗专家共识》[4]中CSDH相关标准,并经相关检查确诊;(2)年龄46~75岁;(3)符合神经内镜手术指征;(4)近期未使用激素等药物进行治疗。排除标准:(1)对本研究药物过敏;(2)合并心、肝、肾、肺等脏器功能障碍;(3)合并恶性肿瘤;(4)合并血液系统疾病;(5)存在免疫系统疾病;(6)近1年内接受过抗凝药物治疗;(7)长期服用他汀类药物;(8)随访脱落。
1.3 治疗方法 所有患者入院后给予常规术前检查和生命体征监测及对症支持治疗等。患者均行神经内镜术治疗:在颅脑CT定位下确定血肿范围,于中心部分行切口,切开头皮、皮下组织,颅骨钻孔形成骨窗,硬膜切小口,注意避开功能区,采用脑穿针对血肿部分进行穿刺,在神经内镜下切除部分血肿,颅内压下降后再切开硬膜,完全清除血肿,采用0.9%氯化钠注射液经引流装置进行冲洗至引流液清亮。术后,对照组给予注射用重组人尿激酶原(上海天士力药业有限公司生产)2万~6万U与0.9%氯化钠注射液混合至10 ml经引流管注入,引流管夹闭4 h后开放,引流结束后重复注入注射用重组人尿激酶原至术后2 d,复查颅脑CT,若血肿消除则拔除引流管。观察组在对照组基础上给予阿托伐他汀钙片(辉瑞制药有限公司生产)20 mg/次,口服,1次/d,共治疗3个月。
1.4 观察指标与方法 (1)血肿量:于术前及术后3个月进行颅脑CT检查,以计算血肿量。(2)血清血管内皮生长因子(VEGF)、乙酰肝素酶(HPA)水平:于术前及术后3个月抽取2组患者清晨空腹肘静脉血5 ml,以3 000 r/min速度离心10 min后取上清液,置于冰箱待检。采用酶联免疫吸附试验对血清VEGF、HPA水平进行测定。(3)脑神经营养因子水平:于术前及术后3个月检测血清神经元特异性烯醇化酶(NSE)、脑源性神经营养因子(BDNF),检测方法同(2)。(4)血清炎性因子水平:检测血清白介素-6(IL-6)、超敏C反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α),检测方法同(2)。(5)神经功能:于术前及术后3个月采用美国国立卫生研究院卒中量表(NIHSS)[5]对2组患者神经功能进行评估,评分与神经功能损伤程度呈正比。(6)疾病情况:于术前及术后3个月采用Markwalder慢性硬膜下血肿分级量表(MGS-GCS)[6]对2组患者血肿进行评价,采用5级评分法(0~4分),评分与血肿程度呈正比。(7)日常活动能力:于术前及术后3个月采用日常生活活动能力量表(ADL)[7]对2组患者自理能力进行评价,总分100分,评分越高表明自理能力越好。(8)并发症:统计患者硬膜下积液、继发性水肿、颅内积气发生情况。(9)疾病复发率:统计术后6个月内的疾病复发情况。

2 结 果
2.1 血肿量和VEGF、HPA水平比较 术前,2组血肿量及血清VEGF、HPA水平比较,差异无统计学意义(P>0.05);术后3个月,2组血肿量少于术前,血清VEGF、HPA水平低于术前,且观察组降低幅度大于对照组(P<0.01),见表1。
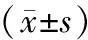
表1 对照组与观察组手术前后血肿量和VEGF、HPA水平比较
2.2 脑神经营养因子水平比较 术前,2组血清NSE、BDNF水平比较,差异无统计学意义(P>0.05);术后3个月,2组血清NSE、BDNF水平低于术前,且观察组低于对照组(P<0.01),见表2。

表2 对照组与观察组手术前后脑神经营养因子水平比较
2.3 血清炎性因子水平比较 术前,2组血清IL-6、hs-CRP、TNF-α水平比较,差异无统计学意义(P>
0.05);术后3个月,2组血清IL-6、hs-CRP、TNF-α水平低于术前,且观察组低于对照组(P<0.01),见表3。
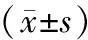
表3 对照组与观察组手术前后炎性因子水平比较
2.4 NIHSS评分、MGS-GCS评分及ADL评分比较 术前,2组NIHSS评分、MGS-GCS评分及ADL评分比较,差异无统计学意义(P>0.05);术后3个月,2组NIHSS评分、MGS-GCS评分低于术前,ADL评分高于术前,且观察组降低/升高幅度大于对照组(P<0.01),见表4。
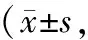
表4 对照组与观察组手术前后NIHSS评分、MGS-GCS评分及ADL评分比较分)
2.5 并发症和疾病复发率比较 观察组与对照组并发症总发生率比较,差异无统计学意义(9.09% vs. 18.18%,χ2=1.544,P=0.214),见表5。观察组术后6个月内疾病复发率为2.27%(1/44),低于对照组的18.18%(8/44)(χ2=4.456,P=0.035)。

表5 对照组与观察组并发症比较 [例(%)]
3 讨 论
CSDH早期症状并不明显,多表现为头痛、恶心等,随着疾病进展,患者临床表现为颅内压增高和神经功能缺损,部分患者可并发偏瘫、语言功能障碍等,还可能引发癫痫,若治疗不及时,还可诱发脑疝[8]。因此,对CSDH患者进行及时干预对于挽救患者生命、改善其生命质量具有重要意义。尽管临床对CSDH的手术和非手术治疗进行了广泛的研究,但CSDH的复发率仍较高,且近年来没有明显下降,采用何种治疗方案可有效降低疾病复发率仍是临床讨论热点。神经内镜术为微创手术,可尽可能少地对脑皮质进行牵拉,且具有小骨窗的特点,经神经内镜可直观地观察病灶,有利于血肿清除,但复发是由于炎症、水肿等病理因素造成,简单的硬膜下疏通并不能完全缓解。临床多采用尿激酶直接注射、冲洗患处,以达到吸附血栓纤维蛋白、溶栓的效果,有利于血肿的排出,但对于炎症和神经功能的改善作用十分有限。
本研究结果显示,术后3个月,观察组血肿量及血清IL-6、hs-CRP、TNF-α、NSE、BDNF、VEGF和HPA水平较对照组更低,提示阿托伐他汀联合尿激酶应用于CSDH患者神经内镜术后治疗,可有效缓解炎症,减轻神经元损伤,促进血肿吸收。CSDH的炎性反应复杂,在血肿周围形成胶原蛋白膜,以促进炎性递质的释放,使得血管壁更加脆弱,促使出血现象的发生,进而形成慢性微出血[9]。VEGF具有促进血管新生的作用,使得血肿包膜上出现新生血管,其表达上升会抑制血管成熟,使得血肿包膜上的血管难以进一步发育,阻止血肿的吸收。阿托伐他汀属于羟甲基戊二酸辅酶A还原酶抑制剂,其可降低血浆胆固醇水平,脂蛋白水平也可得到控制,进而下调炎性因子的表达,具有调脂及抗炎效果,对于血肿吸收有促进作用[10]。NSE较少存在于血清中,而多存在于成熟神经元和神经内分泌细胞中,神经元受损后其在血清中表达上升。BDNF也是脑神经营养因子之一,其表达水平与神经功能损伤有较大关系。阿托伐他汀可促进血肿吸收,并对血管内皮功能有一定改善作用,可减轻脑部缺血再灌注损伤,有利于神经功能的恢复[11]。本研究结果显示,观察组术后6个月内疾病复发率及术后3个月NIHSS评分、MGS-GCS评分较对照组更低,ADL评分较对照组更高,提示阿托伐他汀联合尿激酶应用于CSDH患者神经内镜术后治疗,可有效改善患者神经功能,促进肢体运动功能恢复,降低疾病复发率。小剂量阿托伐他汀可促进血管成熟及血肿吸收,不仅可以降低疾病复发率,还可减轻血肿对脑组织的压迫,保护脑组织,促进神经血管单元的生长,形成有效的静脉回流,从各个层面改善神经功能,以使患者获得良好预后[12]。阿托伐他汀抑制炎性反应后还可改善脑水肿等并发症,降低颅内压,减少术后并发症发生。但本研究中2组并发症总发生率比较无明显差异,可能是由于本研究样本量较小。受限于本研究选取样本量和研究时长等因素影响,可能造成部分指标差异不明显,对神经功能的远期影响还待在日后进行进一步观察,相关理论还有待完善。
综上所述,阿托伐他汀联合尿激酶在CSDH患者神经内镜术后治疗中的应用效果确切,可有效促进神经功能恢复,减轻炎性反应,促进血肿清除,降低疾病复发率,且安全性较高。
利益冲突:所有作者声明无利益冲突。

