九寨沟两种常见藓类植物对模拟氮沉降的生理响应
雷睿 邹佳城 杜杰 文庄海 罗治 雷泞菲







摘 要:為探讨氮沉降对九寨沟藓类植物的影响,该研究以当地优势藓类植物锦丝藓(Actinothuidium hookeri)和塔藓(Hylocomium splendens)为对象,以NH4NO3为氮源,设置对照(0 kg N·hm-2·a-1)、低浓度(20 kg N·hm-2·a-1)、高浓度(50 kg N·hm-2·a-1)3种处理,开展为期6个月的氮沉降模拟实验。结果表明:(1)氮沉降处理导致两种藓类植物的活性氧、丙二醛、叶绿素、脯氨酸和可溶性蛋白含量显著增加,同时锦丝藓过氧化氢酶、过氧化物酶、超氧化物歧化酶、抗坏血酸过氧化物酶活性增加。(2)对于生长旺期和生长末期的塔藓,氮沉降导致其过氧化物酶、过氧化氢酶、抗坏血酸过氧化物酶活性降低。(3)锦丝藓的综合隶属函数值随氮沉降浓度增大而增加,在生长旺期和生长末期,塔藓综合隶属函数值对氮沉降的响应存在差异。综上认为,两种藓类植物对氮沉降处理的生理响应存在差异,高浓度氮沉降能促进锦丝藓生长,塔藓在自然氮沉降条件下能正常生长且能承受一定程度的氮沉降,但当氮沉降过高时则会对其造成伤害,新陈代谢下降,生长受到抑制,长时期的氮沉降可能导致未来九寨沟藓类植物群落发生改变。
关键词: 氮沉降, 锦丝藓, 塔藓, 生理特征, 硝酸铵
中图分类号:Q945
文献标识码:A
文章编号:1000-3142(2023)09-1578-10
收稿日期:2022-11-10
基金项目: 四川省灾后重建遗产保护恢复专项(5132202019000128); 九寨沟湖泊沼泽化及河道生态恢复研究项目(N5132112022000246)。
第一作者: 雷睿(1999-),硕士研究生,主要从事植物与环境响应机制研究,(E-mail)1605755697@qq.com。
*通信作者:雷泞菲,博士,教授,主要从事生态修复研究工作,(E-mail)470226504@qq.com。
Physiological responses of two common mossesto
simulated nitrogen deposition in Jiuzhaigou
LEI Rui1, ZOU Jiacheng1, DU Jie2, WEN Zhuanghai1, LUO Zhi1, LEI Ningfei1*
( 1. Chengdu University of Technology, College of Ecological Environment, Chengdu 610051, China; 2. Jiuzhaigou National
Nature Reserve Administration, Aba Tibetan and Qiang Autonomous Prefecture 623400, Sichuan, China )
Abstract:In order to explore the effect of nitrogen deposition on physiological response of mossesin Jiuzhaigou, Sichuan Province,the local dominant mosses Actinothuidium hookeri and Hylocomium splendens were taken as the research objects, and NH4NO3 was used as the nitrogen source. Nitrogen deposition treatments were applied with control (0 kg N·hm-2·a-1), low (20 kg N·hm-2·a-1) and high (50 kg N·hm-2·a-1). The experiment lasted six months. The results were as follows: (1) The contents of reactive oxygen species, malondialdehyde, chlorophyll, proline and soluble protein were significantly increased by application of NH4NO3 solution. At the same time, the activities of its catalase, peroxidase, superoxide dismutase and ascorbate peroxidase were significantly increased when Actinothuidium hookeri was subjected to nitrogen deposition. (2) During the vigorous and late periods, the activities of its catalase, peroxidase and ascorbate peroxidase were significantly decreased when Hylocomium splendens was subjected to similar nitrogen deposition. (3) During the experiment, subordinate function value of Actinothuidium hookeri significantly increased with increase of NH4NO3 solution concentration. Response pattern of subordinate function value was different when Hylocomium splendens was subjected to different concentrations of NH4NO3 solution in the vigorous and late growth periods. In conclusion, physiological responses aredifferent between two mosses subjected to nitrogen deposition. High concentration of nitrogen deposition can promote the growth of Actinothuidium hookeri. Hylocomium splendens can grow normally under the natural nitrogen deposition conditions and can withstand a certain degree of nitrogen deposition, but when the nitrogen deposition is too high, it will cause damage to it, the metabolism decreases and its growth is inhibited. Long-term nitrogen deposition may lead to future change of moss community composition in Jiuzhaigou, Sichuan Province.
Key words: nitrogen deposition, Actinothuidium hookeri, Hylocomium splendens, physiological trait, NH4NO3
自工業革命以来,全球氮沉降速率一直在上升,预计到2050年将增加1 ~ 2倍(Garcia et al., 2008)。我国氮沉降速率在过去40年里也一直在增加,已成为世界上仅次于欧洲和美国的第三大氮沉降区域(Valliere et al., 2017)。有研究表明,我国平均氮沉降速率在1980年到2000年间从13.2 kg N·hm-2·a-1增长到21.1 kg N·hm-2·a-1,在20年间增长了约8 kg N·hm-2·a-1 (Liu et al., 2013)。因此,在氮沉降全球化背景下,研究和预测氮沉降对森林生态系统的影响极为重要(王晓荣等,2016)。
氮沉降对植物光合作用、有机质分解、营养结构状况、生物多样性、抗逆性等多方面均有影响(李德军等,2005;Reay et al., 2008; Zhao et al., 2010)。不同植物对氮的响应机制不同,氮沉降在一定范围内能够刺激植物生长,但超过一定浓度时可使生长受到抑制。钱燕萍和祝遵凌(2016)比较不同氮素水平对欧洲鹅耳枥(Carpinus betulus)幼苗生长及光合特性的影响发现,鹅耳枥幼苗苗高、叶片数、各部分生物量、净光合速率、蒸腾速率等指标均随氮沉降增加呈先上升后下降的趋势,在施氮量为每株200 mg时达到最佳。王晓荣等(2016)发现氮素的增加显著增加了麻栎(Quercus acutissima)、栓皮栎(Q. variabilis)和短柄枹栎(Q. glandulifera var. brevipetiolata)的地径和株高,但不同树种的生长对氮沉降响应具有明显的差异性。李德军等(2005)对木荷(Schima superba)和黄果厚壳桂(Cryptocarya concinna)的研究表明,0~150 kg N·hm-2·a-1氮处理可促进黄果厚壳桂幼苗的生长,在300 kg N·hm-2·a-1高氮处理下,两种植物幼苗生长均受到抑制。
藓类植物作为森林生态系统的重要组成部分,有着二氧化碳固定、水土保持、森林更新和养分循环等作用(吴玉环等,2003)。大多数藓类植物的叶状体是由单层细胞构成,没有蜡质角质层保护,可直接从空气和雨水中吸收养分,因而对氮沉降非常敏感(胡人亮,1987)。不同种类的藓对氮沉降的耐受程度不同,氮沉降的加剧会改变藓类植物的群落结构,进而影响整个森林生态系统(Tomassen et al., 2003; Paulissen et al., 2005)。刘滨扬等(2009)研究发现,0~60 kg N·hm-2·a-1氮施加可促进大灰藓(Hypnum plumaeforme)生长,刺边小金发藓拟刺亚种(Pogonatum cirratum subsp. fuscatum)在施氮超过40 kg N·hm-2·a-1时其生长就受到抑制,这表明不同浓度处理后的大灰藓和刺边小金发藓拟刺亚种具有不同的响应。有研究证明,低氮沉降浓度增加藓类叶绿素含量和可溶性蛋白含量,抗氧化酶活性一般随氮沉降浓度增加而升高,适量的氮沉降可促进藓类生长,但过量则会抑制其生长,甚至死亡(Skrindo & Kland, 2002; Belnap et al., 2007; 周晓兵等,2016)。
九寨沟国家级自然保护区,植被覆盖率超过80%,是我国重要的森林生态系统之一。2010—2011年九寨沟全氮沉降年通量速率已经大于10 kg N·hm-2·a-1(乔雪等,2014)。氮沉降已经对九寨沟森林生态系统产生了负面影响,如植物枯死、藻类生产力下降和钙华退化等(Qiao et al., 2015),未来九寨沟氮沉降问题可能进一步加剧。关于氮沉降对九寨沟藓类植物的影响未见报道。本研究以九寨沟常见的两种藓类植物锦丝藓(Actinothuidium hookeri)和塔藓(Hylocomium splendens)为实验材料,模拟不同浓度的氮沉降,探究氮沉降对两种藓类植物的影响,并采用隶属函数法综合评价两种藓类植物抗逆性强弱,初步了解九寨沟优势藓类植物对氮沉降的生理响应特征,同时预测了随氮沉降增加两种藓类植物的变化趋势,旨在为进一步评估全球变化背景下森林生态系统的发展和演替动态提供理论证据。
1 材料与方法
1.1 材料
两种藓类:锦丝藓、塔藓;实验地点位于九寨沟自然保护区内(103°55′22″ E、33°04′13″ N)。海拔约3000m,气候类型属于高原湿润气候,夏天平均气温为19 ~ 22 ℃,秋天昼夜温差大,气温为7 ~ 18 ℃,10月下旬后出现冻土,温度多在0 ℃左右。选择具有相似林型、相距200 m的两片冷杉林,并且藓类种类分别以锦丝藓和塔藓为主,盖度大于95%,两种藓类各选择面积1 m × 1 m的15个样方。
1.2 方法
按照1980—2000年我国平均氮沉降速率增加趋势,现在九寨沟氮沉降速率可能超过20 kg N·hm-2·a-1。实验以硝酸铵(NH4NO3)为氮源,设置N0 (纯净水对照)、N1(低浓度,20 kg N·hm-2·a-1)、N2(高浓度,50 kg N·hm-2·a-1)3种浓度处理,每个处理设置5个重复(刘滨杨等,2009,2011)。当地藓类植物生长期一般为每年5—10月,于2021年5—10月将一年的氮沉降量平均分成6次进行喷施处理,每次将准确称量的硝酸铵溶于1 L纯净水中进行均匀喷施。分别于8月和11月取藓类植物尖端1 ~ 5 cm的绿色生长部分进行生理指标测定,样品用液氮速冻后置于-80 ℃超低温冰箱中保存。
为综合评价两种藓类抗逆性强弱,使用模糊数学的隶属函数对所有生理指标进行定量转换,并计算隶属函数值,各生理指标隶属函数值总和为综合隶属函数值,该值越大表示抗逆性越强(张幸幸,2020)。隶属函数值算法如下:
當生理指标与抗逆性呈正相关时:
Zij=(Xij-Xi min)/(Xi max-Xi min)(1)
当生理指标与抗逆性呈负相关时:
Zij(反)= 1-(Xij-Xi min)/(Xi max-Xi min) (2)
Xi=1n∑nj=1Zij(3)
式中:Zij表示i藓类植物j指标的抗逆性隶属函数值;Xij表示i藓类植物j指标的测定值;Xi max、Xi min分别表示各指标的最大测定值和最小测定值;Xi表示i藓类植物综合隶属函数值。
1.3 指标测定
采用过氧化氢法测定过氧化氢酶(CAT)活性,采用氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性,采用愈创木酚法测定过氧化物酶(POD)活性,采用硫代巴比妥酸法测定丙二醛(MDA)含量,采用羟胺法测定超氧阴离子(O2-·)含量,采用生化法测定抗坏血酸过氧化物酶(APX)活性,采用丙酮法测定叶绿素含量,采用茚三酮法测定游离脯氨酸含量,采用考马斯亮蓝G-250染色法测定可溶性蛋白含量,采用氯化钛法测定过氧化氢含量。
1.4 数据分析
采用软件Excel、SPSS、Origin对实验数据进行分析和绘图处理。
2 结果与分析
2.1 不同氮浓度对锦丝藓和塔藓叶绿素含量的影响
叶绿素作为光合色素,其含量高低可以反映植物光合能力的强弱。由图1可知,氮沉降可以提高锦丝藓和塔藓的叶绿素含量(P<0.05)。在生长旺盛期锦丝藓和塔藓的叶绿素含量上升,尤其在N1浓度下,相对于N0分别提高了121.2%、26.3%,在N2浓度下,与N0相比分别提高了85.1%、20.3%。
在生长末期九寨沟已经进入冬天,昼夜温差大,温度最低可到0 ℃以下,对藓类植物形成低温胁迫。锦丝藓叶绿素含量随氮浓度增高而增高,分别增加42.7%、82.5%,而塔藓叶绿素含量呈先增加后降低趋势,先增加15.6%后降低5.6%。可见,施氮能显著增加两种藓类的叶绿素含量,但在生长末期高浓度N2会降低塔藓叶绿素含量。
2.2 不同氮浓度对锦丝藓和塔藓丙二醛含量的影响
由图2可知,在生长旺盛期,锦丝藓和塔藓丙二醛含量变化不同,锦丝藓丙二醛含量先增加后小幅减小,N1、N2浓度下相对于N0分别增加了50.8%、42.7%,而塔藓丙二醛含量随氮浓度增加而增加,N1浓度下增加不显著,N2浓度下增加了135.3%。在生长末期,锦丝藓丙二醛含量相对于N0,在N1浓度下增加了58.3%,N2浓度下降低了17.2%;而氮沉降增加了塔藓丙二醛含量,在N1、N2浓度下分别增加了49.6%、49.7%。
2.3 不同氮浓度对锦丝藓和塔藓渗透调节物质脯氨酸和可溶性蛋白含量的影响
脯氨酸可作为渗透调节物质、酶类保护物等来降低环境胁迫对植物的损伤,清除体内的ROS,维持氧化还原动态平衡(Xiao & Veste, 2017)。由图3可知,在生长旺盛期,锦丝藓和塔藓脯氨酸含量变化随氮浓度增加具有不同变化趋势,氮沉降显著增加了锦丝藓脯氨酸含量,而塔藓脯氨酸含量先减少后显著增加。与N0相比,N1、N2浓度下锦丝藓分别增加了119.4%、104.6%,塔藓在N1浓度下降低了9.6%,N2浓度下增加了75.7%;在生长末期,锦丝藓和塔藓脯氨酸含量均增加,N1、N2浓度下锦丝藓脯氨酸含量分别增加了42.6%、48.6%,塔藓脯氨酸含量分别增加了29.8%、30.9%。在生长旺盛期,锦丝藓可溶性蛋白含量只在N1浓度时显著增加,增加了33.2%,塔藓可溶性蛋白含量增加不明显。在生长末期,锦丝藓和塔藓可溶性蛋白相对N0显著增加,锦丝藓在N1、N2浓度处理下分别增加了170.1%、390.7%,塔藓在N1、N2浓度处理下分别增加了225.4%、305.7%。
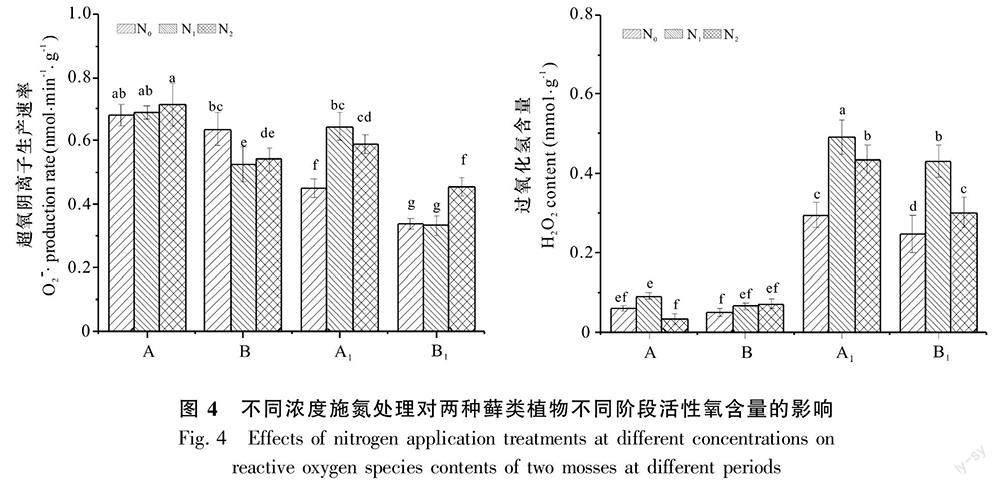
2.4 不同氮浓度对锦丝藓和塔藓活性氧含量的影响
由图4可知,不同时期锦丝藓和塔藓超氧阴离子生产速率随氮浓度不同而具有不同的变化趋势。在生长旺盛期, 氮沉降对锦丝藓超氧阴离子生产速率影响不明显,而塔藓超氧阴离子生产速率显著下降,N1、N2浓度下比N0分别下降了17.2%、14.9%。在生长末期,锦丝藓超氧阴离子生产速率在N1、N2浓度下分别增加了42.9%、30.6%,而塔藓只有N2浓度下才显著增加了34.6%。对于过氧化氢含量而言,在生长旺盛期,锦丝藓过氧化氢含量随氮浓度增加呈先上升再下降趋势,塔藓为上升趋势(不显著)。在生长末期,两种藓类过氧化氢含量比N0显著上升,锦丝藓在N1、N2浓度下分别增加了66.7%、47.7%,塔藓在N1、N2浓度下分别增加了74.8%、21.7%。
2.5 不同氮浓度对锦丝藓和塔藓抗氧化酶的影响
由图5可知,在生长旺盛期,不同浓度对锦丝藓和塔藓SOD活性影响不显著,其中塔藓SOD活性随施氮浓度增加而增加。在生长末期,锦丝藓SOD活性在N1浓度下比N0增加了8.6%,塔藓SOD活性随施氮浓度增加而显著增加,N1、N2浓度下比N0分别增加了43.3%、30.7%。
在生长旺盛期,锦丝藓POD活性在N1、N2浓度下比N0显著增加,分别增加了340.4%、381.9%;塔藓POD活性随施氮浓度增加而显著降低,N1、N2浓度下分别降低了11.3%、36.9%。在生长末期,锦丝藓POD活性在N1、N2浓度下分别增加了303.4%、386.2%,塔藓只在N2浓度下显著增加了101.9%。
在生长旺盛期,锦丝藓CAT活性在N1浓度下显著增加了36.1%,塔藓CAT活性随氮浓度增加而增加,N1、N2浓度下分别增加了14.0%、24.7%。在生长末期,氮沉降显著增加了锦丝藓CAT活性,N1、N2浓度下分别增加了261.3%、288.3%,而塔藓CAT活性显著降低,N1、N2浓度下比N0分别降低了47.2%、46.9%。
在生长旺盛期,锦丝藓和塔藓APX活性都在N1浓度下下降,分别下降了17.3%、34.6%。在生长末期,氮沉降显著增加了锦丝藓APX活性,N1、N2浓度分别增加了70.1%、285.7%,塔藓APX活性随氮沉降浓度增加而下降,N1、N2浓度下分别下降了15.7%、46.9%。
2.6 不同氮浓度对锦丝藓和塔藓的综合效果
为探究氮沉降对锦丝藓和塔藓生长影响的综合效果,采用隶属函数法对两种藓类的各项生理指标进行分析,综合隶属函数值越大表明施氮处理对其生长越有利。由表1可知,锦丝藓在整个生长周期综合隶属函数值均随氮沉降浓度增加而增加。塔藓在生长旺盛期综合隶属函数值随氮沉降浓度增加而增加,但是在生长末期综合隶属函数值随氮浓度增加而降低。不同氮浓度条件对塔藓和锦丝藓形态影响也较大(图6)。在N1浓度下,塔藓能适应环境的变化,长势较好,锦丝藓叶片出现轻微发黄现象;而在N2浓度下,塔藓叶片出现明显发黄现象,锦丝藓则叶片转绿,长势较好。
3 讨论
植物光合作用受有效氮的强烈影响,大量研究表明,适宜浓度的氮沉降能使植物叶绿素含量升高,光合能力增强,但是过量的氮沉降反而会抑制其光合能力(樊后保和黄玉梓,2006)。本研究发现,低浓度氮可以显著增加锦丝藓和塔藓的叶绿素含量,但是高浓度氮的添加使其含量下降,这与董向楠(2016)和周晓兵等(2016)的研究结果一致。在生长旺盛期,两种藓类叶绿素含量均高于生长末期,但高浓度的氮抑制其生长,生长末期其叶绿素含量降低,主要是由于九寨沟昼夜温差大,最低可达零下,受低温影响,生长变缓,其叶绿素含量均有所降低,但锦丝藓叶绿素含量下降幅度要小于塔藓,其光合能力强于塔藓,依旧具有一定的生长能力,长势好于塔藓。
丙二醛(MDA)含量的高低可以反映植物在受胁迫下生物膜的损伤程度(赵晓玉等,2014;阮志平等,2016)。活性氧(ROS)的生产和清除是一种动态平衡,当植物处于环境胁迫时其体内ROS含量升高,相应的抗氧化酶(SOD、CAT、POD、APX等)活性会升高以清除ROS,从而缓解或消除其对植物体所产生的损伤,保护细胞免受自由基诱发的损害(王强等,2012;Hashempour et al., 2014; 李静静等,2016)。本研究中,只有生长旺盛期塔藓的POD和生长末期的CAT、APX活性降低,其余时期两种藓类SOD、POD、CAT、APX活性均升高。这也表明氮沉降对两种藓类产生了膜脂过氧化和其他氧化损伤,降低塔藓和锦丝藓抗氧化能力,而且塔藓抗氧化能力降低幅度强于锦丝藓。随着氮浓度增加,塔藓不能适应高浓度氮,叶片出现发黄现象,部分塔藓死亡。锦丝藓中4种酶活性均升高,其抗氧化能力增加,保护植物体免受损伤,因此锦丝藓在高浓度氮处理下生长仍然较好,这与何刚(2014)和Liu等(2015)的研究结果一致。
渗透调节物质在一定程度上能缓解植物的氧化损伤(Koranda et al., 2007),可溶性蛋白可以反映植物的氮代谢水平以及对环境变化的响应,周先容等(2012)研究表明,氮沉降可以增加植物叶片中的可溶性蛋白含量,一般而言,可溶性蛋白含量越高表明生长状况越好,同时可溶性蛋白也可以提高植物的抗逆能力。本研究发现,随氮浓度增加,锦丝藓和塔藓的脯氨酸和可溶性蛋白含量显著增加,而且锦丝藓增加幅度大于塔藓,这与陶晨悦等(2019)和徐瑞阳等(2013)的研究结果一致。两种藓类脯氨酸和可溶性蛋白含量的增加能促进蛋白质的合成,增强其渗透调节能力和清除ROS的能力,由于锦丝藓的抗氧化酶活性高于塔藓,因此其缓解ROS对膜脂过氧化损伤能力强,更能适应高浓度氮的环境。
通过隶属函数值法发现,锦丝藓在整个生长周期综合隶属函数值随氮浓度增加而增加,塔藓在生长旺盛期与锦丝藓一致,而在生长末期随氮浓度增加而降低,并且在高浓度氮下,锦丝藓综合隶属函数值始终高于塔藓,表明锦丝藓对氮沉降耐受能力强于塔藓。
植物對不同形态的氮素响应不尽相同,NO3-和NH4+是氮沉降过程中的主要成分,受植物种类、形态建成、性别、代谢情况等影响(马道承等,2022)。王铖等(2015)用3种氮源 [硝态氮为Ca(NO3)2,铵态氮为NH4HCO3,硝铵态氮为NH4NO3]对桧叶白发藓进行处理,研究结果表明,3种氮源均使桧叶白发藓的叶绿素、可溶性蛋白、脯氨酸等含量先上升后下降,但对硝态氮胁迫的响应比铵态氮和硝铵态氮敏感。潭鹰等(2012)研究大灰藓对硝态氮和硝铵态氮的生理响应发现,施加硝铵态氮有利于大灰藓对氮的同化利用并降低对植物造成的威胁,效果优于硝态氮。由此可见,植物对不同氮源胁迫响应有所差异,本研究中不同形态的氮源处理对锦丝藓和塔藓有何影响还需进一步研究。
4 结论
在目前氮沉降的条件下,人工施氮明显促进了九寨沟锦丝藓的生长,在施氮量为50 kg N·hm-2·a-1时,锦丝藓各项生理指标均呈现出本实验组内的最佳状态。塔藓在自然氮沉降条件下能正常生长且能承受一定程度氮浓度的升高,但当氮浓度过高时则会对塔藓造成伤害,使植物整体新陈代谢水平下降,抑制其生长。若九寨沟氮沉降问题继续加剧,而锦丝藓对高浓度氮的耐受能力高于塔藓,锦丝藓将能很好地适应高浓度氮的环境,塔藓则可能不再成为九寨沟优势藓类,这可能会改变九寨沟藓类的群落结构进而影响九寨沟森林生态系统的稳定性。
参考文献:
BELNAP J, PHILLIPS SL, FLINT SD, et al., 2007. Global change and biological soil crusts: Effects of ultraviolet augmentation under altered precipitation regimes and nitrogen additions [J]. Glob Change Biol, 14(3): 670-686.
DONG XN, 2016. Effects of nitrogen addition on bryophytes in Taiyue Mountain of Shanxi [D]. Beijing: Beijing Forestry University: 29-31.[董向楠, 2016. 氮素添加对山西太岳山苔藓植物的影响 [D]. 北京: 北京林业大学: 29-31.]
FAN HB, HUANG YZ, 2006. Ecophysiological mechanism underlying the impacts of nitrogen saturation in terrestrial ecosystems on plants [J]. J Plant Physiol Mol Biol, 32(4): 395-402.[樊后保, 黄玉梓, 2006. 陆地生态系统氮饱和对植物影响的生理生态机制 [J]. 植物生理与分子生物学学报, 32(4): 395-402.]
GARCIA R, OCHOA V, HINOJOSA MB, et al., 2008. Suitability of enzyme activities for the monitoring of soil quality improvement in organic agricultural systems [J]. Soil Biol Biochem, 40(9): 2137-2145.
HASHEMPOUR A, GHASEMNEZHAD M, GHAZVINI RF, et al., 2014. Olive (Olea europaea L.) freezing tolerance related to antioxidant enzymes activity during cold acclimation and non acclimation [J]. Acta Physiol Plant, 36(12): 3231-3241.
HE G, 2014. Physiological responses of bryophytes to warming and nitrogen deposition in alpine ecosystems [D]. Chengdu: Sichuan Normal University: 57-69.[何刚, 2014. 高山生态系统苔藓植物对升温和氮沉降的生理响应 [D]. 成都: 四川师范大学: 57-69.]
HU RL, 1987. Bryology[M]. Beijing: Higher Education Press: 440-442.[胡人亮, 1987. 苔藓植物学 [M]. 北京: 高等教育出版社: 440-442.]
KORANDA M, KERSCHBAUM S, WANEK W, et al., 2007. Physiological responses of bryophytes Thuidium tamariscinum and Hylocomium splendens to increased nitrogen deposition [J]. Ann Bot, 99(1): 161-169.
LI DJ, MO JM, FANG YT, et al., 2005. Effects of simulated nitrogen deposition on seedling biomass and allocation of two species of trees in subtropical Asia [J]. Chin J Plant Ecol, 29 (4): 543-549.[李德军, 莫江明, 方运霆, 等, 2005. 模拟氮沉降对南亚热带两种乔木幼苗生物量及其分配的影响 [J]. 植物生态学报, 29(4): 543-549.]
LI JJ, CHEN YJ, ZHANG L, et al., 2016. Effects of water-nitrogen interaction on physiological-biochemical indexes and turf quality of Poa pratensis L. [J]. Chin J Grassl, 38(4): 42-48.[李靜静, 陈雅君, 张璐, 等, 2016. 水氮交互作用对草地早熟禾生理生化与坪用质量的影响 [J]. 中国草地学报, 38(4): 42-48.]
LIU BY, LEI CY, JIN JH, et al., 2015. Physiological responses of two moss species to the combined stress of water deficit and elevated N deposition (II): Carbon and nitrogen metabolism [J]. Int J Plant Sci, 176(5): 446-457.
LIU BY, LIU WQ, LEI CY, et al., 2009. Physiological responses of three bryophytes to simulated N deposition [J]. Chin J Plant Ecol, 33(1): 141-149.[刘滨扬, 刘蔚秋, 雷纯义, 等, 2009. 三种苔藓植物对模拟N沉降的生理响应 [J]. 植物生态学报, 33(1): 141-149.]
LIU BY, LIU WQ, ZHANG YS, et al., 2011. Physiological responses of bryophytes experienced low temperature stress to simulated nitrogen deposition [J]. Chin J Plant Ecol, 35(3): 268-274.[刘滨扬, 刘蔚秋, 张以顺, 等, 2011. 低温胁迫后苔藓植物对模拟氮沉降条件的生理响应 [J]. 植物生态学报, 35 (3): 268-274.]
LIU XJ, ZHANG Y, HAN WX, et al., 2013. Enhanced nitrogen deposition over China [J]. Nature, 494(7438): 459-462.
MA DC, PANG YP, TIAN X, et al., 2022. The molecular mechanism of nitrogen absorption and fertilization with different nitrogen form ratio in plants: A review [J]. J W Chin For Sci, 51(5): 165-166.[马道承, 庞艳萍, 田湘, 等, 2022. 植物不同氮素形态配比施肥及其分子机制研究进展 [J]. 西部林业科学, 51(5): 165-166.]
PAULISSEN MPCP, BESALU LEA, DE BRUIJN H, et al., 2005. Contrasting effects of ammonium enrichment on fen bryophytes [J]. J Bryol, 27(2): 109-117.
PEARCE ISK, WOODINS SJ, VAN DWR, 2003. Physiological and growth responses of the montane bryophyte Racomitrium lanuginosum to atmospheric nitrogen deposition [J]. New Phytol, 160: 145-155.
QIAN YP, ZHU ZL, 2016. Effects of nitrogen nutrition on growth and photosynthetic characteristics of Carpinus betulus seedlings [J]. J NW A & F Univ, 44(6): 71-77.[钱燕萍, 祝遵凌, 2016. 氮素营养对欧洲鹅耳枥幼苗生长及光合特性的影响 [J]. 西北农林科技大学学报, 44(6): 71-77.]
QIAO X, JIANG LJ, TANG Y, et al., 2014. The fluxes and possible aquatic impacts of atmospheric nitrogen, sulfur and phosphorous deposition in Jiuzhaigou [J]. Mt Res, 32(5): 633-640.[乔雪, 江丽君, 唐亚, 等, 2014. 九寨沟大气氮、磷和硫沉降的通量及水环境意义 [J]. 山地学报, 32(5): 633-640.]
QIAO X, XIAO WY, JAFFE D, et al., 2015. Atmospheric wet deposition of sulfur and nitrogen in Jiuzhaigou national nature reserve, Sichuan Province, China [J]. Sci Total Environ, 511(1): 28-36.
REAY DS, DENTENER F, SMITH P, et al., 2008. Global nitrogen deposition and carbon sinks [J]. Nat Geosci, 1(7): 430-437.
RUAN ZP, TANG YJ, ZENG MJ, 2016. Influence of drought stress on photosynthetic characteristics and activity of antioxidant enzymes of four species of palm seedlings [J]. Chin J Trop Crops, 37(10): 1914-1919.[阮志平, 唐源江, 曾美涓, 2016. 干旱胁迫对4种棕榈植物幼苗光合特性及抗氧化酶活性的影响 [J]. 热带作物学报, 37(10): 1914-1919.]
SKRINDO A, KLAND RH, 2002. Effects of fertilization on understorey vegetation in a Norwegian Pinus sylvestris forest [J]. Appl Veg Sci, 5(2): 167-172.
TAN Y, SHU T, ZHAO YJ, et al., 2012. Physiological responses of Hypnum plumaeforme to different inorganic nitrogen forms [J]. Chin J Ecol, 31(11): 2823-2827.[譚鹰, 舒婷, 赵艳君, 等, 2012. 大灰藓对硝态氮及混合态氮的生理响应 [J]. 生态学杂志, 31(11): 2823-2827.]
TAO CY, SHAO SL, SHI WH, et al., 2019. Effects of nitrogen deposition on biomass and protective enzyme activities of Phyllostachys edulis seedlings under drought stress [J]. Sci Silv Sin, 55(9): 31-40.[陶晨悦, 邵珊璐, 史文辉, 等, 2019. 氮沉降对干旱胁迫下毛竹实生苗生物量和保护酶活性的影响 [J]. 林业科学, 55(9): 31-40.]
TOMASSEN H, SMOLDERS A, LAMERS L, et al., 2003. Stimulated growth of Betula pubescens and Molinia caerulea on ombrotrophic bogs: role of high levels of atmospheric nitrogen deposition [J]. J Ecol, 91(3): 357-370.
VALLIERE JM, IRVINE IC, SANTIAGO L, et al., 2017. High N, dry: Experimental nitrogen deposition exacerbates native shrub loss and nonnative plant invasion during extreme drought [J]. Glob Change Biol, 23(10): 4333-4345.
WANG C, YIN LJ, ZHU RL, 2015. Growth and physiological responses of Leucobryum jiniperoideum to different nitrogen stresses [J]. Guihaia, 35(4): 520-525.[王铖, 尹丽娟, 朱瑞良, 2015. 桧叶白发藓对不同氮源胁迫的形态和生理响应 [J]. 广西植物, 35(4): 520-525.]
WANG Q, JIN ZX, PENG LQ, 2012. Effects of nitrogen deposition on leaf physiological and ecological characteristics of Lindera aggregata seedlings [J]. Chin J Appl Ecol, 23(10): 2766-2772.[王强, 金则新, 彭礼琼, 2012. 氮沉降对乌药幼苗生理生态特性的影响 [J]. 应用生态学报, 23(10): 2766-2772.]
WANG XR, PAN L, PANG HD, et al., 2016. Effects of simulated nitrogen deposition on growth, biomass accumulation and photosynthetic characteristics responses of Quercus seedlings in mid-subtropics of China [J]. J Cent S Univ For & Technol, 36(1): 78-85.[王晓荣, 潘磊, 庞宏东, 等,2016. 模拟氮沉降对亚热带栎属树种幼苗生长、生物量累积及光合特性的影响 [J]. 中南林业科技大学学报, 36(1): 78-85.]
WU YH, CHENG GD, GAO Q, 2003. The ecological function of bryophytes and their role in vegetation restoration and reconstruction[J]. J Desert Res, 23(3): 215-220.[吴玉环, 程国栋, 高谦, 2003. 苔藓植物的生态功能及在植被恢复与重建中的作用 [J]. 中国沙漠, 23(3): 215-220.]
XIAO B, VESTE M, 2017. Moss-dominated biocrusts increase soil microbial abundance and community diversity and improve soil fertility in semi-arid climates on the Loess Plateau of China [J]. Appl Soil Ecol, 117(7): 165-177.
XU RY, BAI L, WANG XH, et al., 2013. Effects of simulated nitrogen deposition on nitrogen assimilation accumulation in two grassland plants [J]. Pratac Sci, 30(4): 501-505.[徐瑞陽, 白龙, 王晓红, 等, 2013. 模拟氮沉降对两种草地植物氮同化物积累的影响 [J]. 草业科学, 30(4): 501-505.]
ZHANG XX, 2020. Cold resistance and comprehensive evaluation of nine evergreen pine tree species [D]. Jinzhong: Shanxi Agricultural University: 15-16.[张幸幸, 2020. 九种常绿针叶乔木树种抗寒性及其综合评价 [D]. 晋中: 山西农业大学: 15-16.]
ZHAO CS, HU CX, HUANG W, et al., 2010. A lysimeter study of nitrate leaching and optimum nitrogen application rates for intensively irrigated vegetable production systems in central China [J]. J Soils Sediments, l0(1): 9-17.
ZHAO XY, XUE X, LU CF, et al., 2014. Signal transduction and detection methods of reactive oxygen species in plants [J]. J Chin Electron Microsc Soc, 33(2): 188-196.[赵晓玉, 薛娴, 卢存福, 等, 2014. 植物中活性氧信号转导及其检测方法研究进展 [J]. 电子显微学报, 33(2): 188-196.]
ZHOU XB, YIN BF, ZHANG YM, 2016. Effects of simulated nitrogen deposition on growth and photosynthetic physiology of different types of biological soil crusts [J]. Acta Ecol Sin, 36(11): 3197-3205.[周晓兵, 尹本丰, 张元明, 2016. 模拟氮沉降对不同类型生物土壤结皮生长和光合生理的影响 [J]. 生态学报, 36(11): 3197-3205.]
ZHOU XR, WANG JH, ZHANG H, et al., 2012. Effects of elevated CO2 and nitrogen deposition on leaf nutrient quality of Fargesia rufa Yi[J]. Acta Ecol Sin, 32(24): 7644-7653.[周先容, 汪建华, 张红, 等, 2012. CO2浓度升高和模拟氮沉降对青川箭竹叶营养质量的影响 [J]. 生态学报, 32(24): 7644-7653.]
(责任编辑 邓斯丽 周翠鸣)

