microRNA-588通过调控USP22基因表达对神经母细胞瘤增殖和迁移的影响及机制研究①
许雅丽 李笃妙 吴强 林俊山 (福建医科大学附属第一医院儿外科,台江 350005)
神经母细胞瘤(neuroblastoma,NB)是儿童中最常见的恶性肿瘤[1]。免疫抑制在肿瘤的发生和进展中起着重要作用,NB的发生会影响机体T淋巴细胞亚群并抑制细胞免疫,而免疫抑制与癌症的免疫逃逸机制有关,使肿瘤细胞可以免受机体细胞免疫的清除,并促进肿瘤细胞浸润[2]。泛素特异性蛋白酶22(ubiquitin-specific protease 22,USP22)可以催化组蛋白H2A和H2B的去泛素化,是调控细胞周期的关键蛋白。研究显示沉默USP22会抑制NB细胞的增殖[3]。新近研究显示USP22的抑制以免疫系统依赖性的方式抑制肝癌的生长,增加了肿瘤的免疫原性和肿瘤浸润的淋巴细胞,并且可以提高铂类化合物的治疗效果[4]。但USP22对NB转移和免疫抑制的影响尚不清楚。微小RNA(micro-RNA,miRNA)是一种内源性的、长度为22~25个核苷酸长度的RNA,虽然miRNA不具备编码能力,但是miRNA可靶向结合信使RNA(message RNA,mRNA)的3'端的非翻译区域(3'-untranslated region,3'-UTR)使其降解[5]。miR-588是近年来发现的与NB肿瘤有关的miRNA,最新研究显示miR-588在乳腺癌组织中下调,并且与不良预后有关[6]。也有研究发现miR-588可以抑制NB细胞的迁移和侵袭,但其在NB中的作用仍不清楚[7]。本文主要分析miR-588通过靶向调控USP22的表达对NB细胞增殖、凋亡和转移的影响,并初步探究作用机制。
1 材料与方法
1.1 材料 人正常神经细胞视网膜色素上皮细胞株、NB细胞系SK-N-SH细胞株(中国医学科学院上海细胞库);BALB/c裸鼠(4~5周龄,SPF级,上海斯莱克实验动物中心,中国);DMEM培养基、谷氨酰胺培养基、血清和抗体,LipofectamineTM2000(Invitrogen公司,美国);细胞培养箱、化学发光显色试剂盒(Thermo Fisher公司,美国);miR-588类似物(mimic)、USP22过表达质粒及相应的阴性对照(negative control,NC)(GenePharma公司,中国);pMIR-REPORT 双荧光素酶试剂盒、1000 Assay System检测系统(Thermo Fisher公司,美国);MiScript试剂盒(GmbH公司,德国);PrimeScript-RT和SYBR Premix Ex Taq试剂盒(TaKaRa公司,日本);anti-USP22和山羊抗兔IgG H&L(HRP)二抗(Abcam公司,美国);PVDF膜(Bio-Rad公司,美国);CCK-8试剂盒(Beyotime研究所,中国);Transwell小室(Becton Dickinson公司,美国);ELISA试剂盒(碧云天公司,中国);光学显微镜(奥林巴斯公司,日本)。
1.2 方法
1.2.1 生物信息学分析双荧光素酶报告验证实验 根据工具网站Starbase预测miR-588与USP22 mRNA 3'-UTR区域的结合位点,根据结合部分的序列分别构建野生型(wt-)和突变型的(mut-)的USP22 mRNA,将USP22 mRNA序列和mimic或NC序列克隆到pMIR-REPORT荧光素酶载体中。使用Lipofectamine 2000将细胞用两种载体转染至细胞中。使用双荧光素酶报告基因1000 Assay System分析系统评估荧光素酶活性。当miR-588与USP22结合后,荧光素酶活性会降低。
1.2.2 细胞分组和转染 将DMEM培养基中处于对数生长期的SK-N-SH细胞分为4组:NC组、miR-588组、miR-588+USP22组和USP22组。miR-588组和USP22组通过Lipofectamine 2000分别转染50 nmol/L miR-588 mimic和USP22质粒来过表达miR-588和USP22。miR-588+USP22组同时转染上述两种质粒。NC组转染等量的NC空载质粒作为对照组,转染条件为37 ℃、5%CO2、48 h。
1.2.3 检测指标和方法
1.2.3.1 RT-qPCR检测miR-588和USP22 mRNA 通过TRIzol获得细胞中总RNA,对于miR-588,通过miScript试剂盒合成互补DNA(7 ℃ 60 min,95 ℃5 min,4 ℃下保存),利用MiScript SYBR-Green PCR试剂盒检测互补DNA(95 ℃ 10 s,55 ℃ 30 s,72 ℃30 s,40个循环),U6用作miR-588内源参照。对于USP22 mRNA,分别通过PrimeScript-RT和SYBR Premix Ex Taq试剂盒进行反转录(37 ℃ 15 min,85 ℃ 5 s)和qPCR(95 ℃ 5 min,95 ℃ 30 s,40个循环,65 ℃ 45 s),GAPDH用作内源参照。通过比较循环阈值评估miR-588和USP22 mRNA相对于U6和GAPDH的表达水平。
1.2.3.2 Western blot检测蛋白 将细胞研磨萃取总蛋白,蛋白浓度通过BCA试剂盒测量。使用10%的聚丙烯酰胺凝胶进行电泳(PAGE)(80~120 V,90 min)分离40 μg的总蛋白。在100 mV恒定电压下与PVDF膜进行湿转移。在5%牛血清白蛋白中室温孵育1 h,将1∶500稀释的anti-USP22、antiβ-catenin添加到PVDF膜中,在4 ℃下孵育8 h。洗涤后在室温下添加二抗孵育2 h,然后加入化学发光试剂进行显影,GAPDH用作内参,用Image J软件分析目标条带的灰度值。
1.2.3.3 CCK-8法检测细胞活力 将1×104个细胞(100 μl)接种到96孔板中。培养48 h后,添加10 μl CCK-8,并在37 ℃下培养2 h,用酶标仪测量450 nm处的吸光度(OD)。
1.2.4 划痕愈合实验检测迁移 将培养接种于6孔板中的1×105个细胞使用无血清培养基培养至90%融合。使用200 μl移液器吸头刮擦细胞。在相同条件下继续培养48 h。通过细胞的图像使用光学显微镜观察并拍照,计算划痕前缘迁移距离百分比。
1.2.5 Transwell检测侵袭 将基质胶和完全培养基分别添加到Transwell的上部和下部腔室中。将1×104个细胞添加到上室并培养48 h。48 h后,将渗透的细胞用20%甲醇固定并用0.1%结晶紫染色。计数进入5个视野中每个视野底部室的细胞数平均值。
1.2.6 ELISA检测肿瘤免疫指标 收集细胞培养基,离心后取出细胞上清液,根据说明书分别加入抗体和显色剂,通过酶标仪检测450 nm处的OD,并根据标准曲线和检测的OD值计算免疫指标TNF-α和可溶性白细胞介素-2受体(soluble interleukin-2 receptor,sIL-2R)浓度。
1.3 统计学处理 统计分析使用SPSS19软件。数据以±s表示,计数资料使用(%)表示。进行单因素方差分析,两两比较通过SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 miR-588在NB中的表达特点 为初步分析miR-588在NB中的表达特点,通过RT-qPCR检测人正常神经细胞视网膜色素上皮细胞株和NB细胞SK-N-SH中miR-588水平,结果显示miR-588在两组细胞中的表达量分别为2.51±0.38和0.85±0.20,SKN-SH中miR-588水平明显降低(P<0.05)。
2.2 miR-588与USP22 mRNA 3'-UTR区域靶向结合 通过网站预测发现了miR-588与USP22 mRNA 3'-UTR区域之间存在多个连续的碱基互补配对位点,见图1。利用SK-N-SH细胞转染miR-588 mimic构建miR-588过表达的细胞结果显示miR-588的水平升高了(7.56±0.72)倍,提示转染成功。然后通过双荧光霉素报告验证了在SK-N-SH细胞中,miR-588与USP22 mRNA 3'-UTR区域靶向结合,见图2。

图1 miR-588与USP22 mRNA的3'-UTR区域的结合位点示意图Fig.1 Schematic diagram of binding site of miR-588 and 3'-UTR region of USP22 mRNA
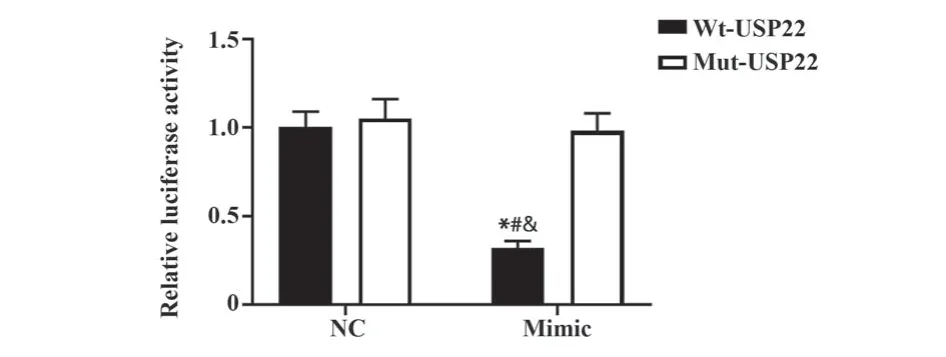
图2 双荧光霉素报告验证miR-588与USP22 mRNA的3'-UTR的靶向关系Fig.2 Dual fluorescein report verifies that miR-588 can target 3'-UTR of USP22 mRNA
2.3 miR-588靶向抑制USP22表达 各组USP22 mRNA和蛋白的水平比较差异有统计学意义(P<0.05),其中miR-588组USP22 mRNA和蛋白水平显著低于NC组但USP22组显著高于NC组(P<0.05),miR-588+USP22组USP22 mRNA和蛋白水平显著高于miR-588组但低于USP22组(P<0.05),见图3、图4。
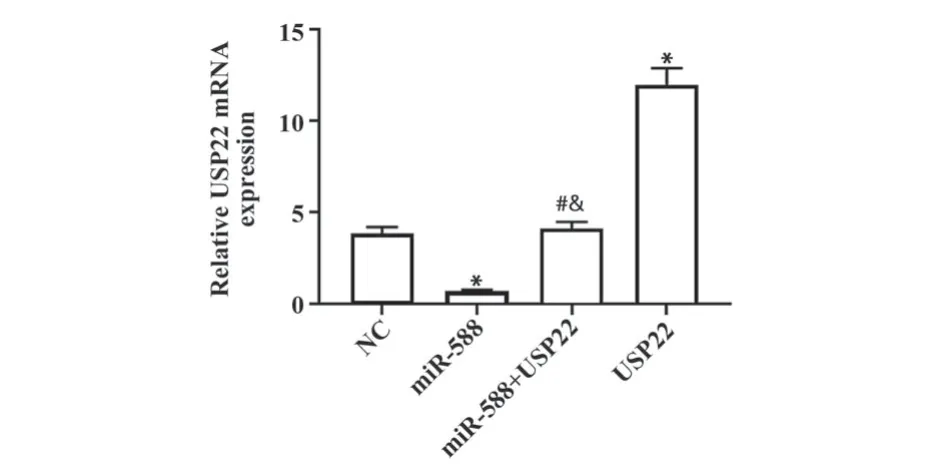
图3 RT-qPCR检测各组USP22 mRNA表达水平比较Fig.3 Comparison of USP22 mRNA expression level in each group detected by RT-qPCR
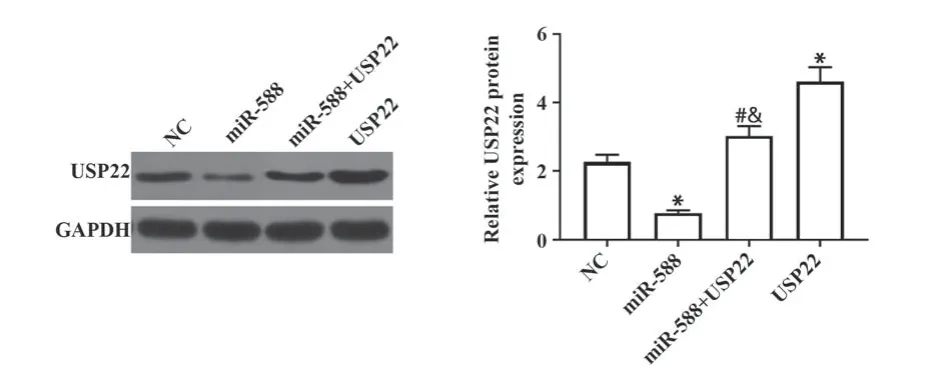
图4 Western blot检测各组细胞中USP22蛋白水平Fig.4 Western blot detection of USP22 protein levels in cells of each group
2.4 miR-588通过靶向USP22对细胞活力的影响在培养48 h后,各组的OD值比较差异有统计学意义(P<0.05),与NC组(0.68±0.07)比较,miR-588组OD值(0.58±0.06)显著降低,USP22组OD值(0.81±0.08)显著升高,miR-588+USP22组的OD值(0.71±0.07)高于miR-588组而低于USP22组。
2.5 miR-588通过靶向USP22对细胞迁移能力的影响 各组的迁移能力比较差异有统计学意义(P<0.05),其中miR-588组的迁移能力(22.07%±2.11%)显著低于NC组(43.42%±2.75%),而USP22组(83.45%±4.09%)显著高于NC组(P<0.05),miR-588+USP22组的迁移能力(51.06%±3.67%)显著高于miR-588组而低于USP22组(P<0.05),见图5。

图5 划痕愈合实验检测miR-588通过靶向USP22对细胞迁移能力的影响Fig.5 Scratch healing experiment to detect effect of miR-588 on cell migration by targeting USP22
2.6 miR-588通过靶向USP22对细胞侵袭能力的影响 各组的侵袭能力比较差异有统计学意义(P<0.05),其中miR-588组的侵袭能力(61.35%±3.06%)显著低于NC组(123.64%±4.33%)而USP22组(238.02±7.71)显著高于NC组(P<0.05),miR-588+USP22组的侵袭能力(131.78%±5.58%)显著高于miR-588组而低于USP22组(P<0.05),图6。
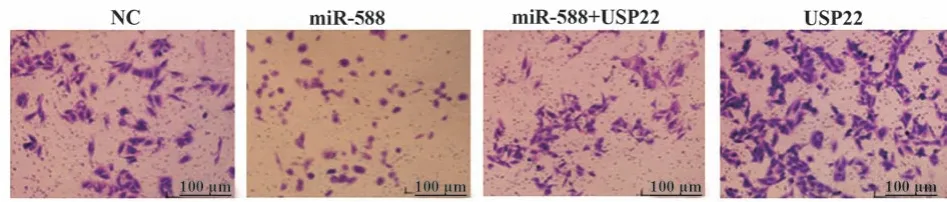
图6 Transwell实验检测miR-588通过靶向USP22对细胞侵袭能力的影响Fig.6 Transwell experiment to detect effect of miR-588 on cell invasion by targeting USP22
2.7 miR-588通过靶向USP22对免疫抑制的影响各组的免疫抑制水平比较差异有统计学意义(P<0.05),其中miR-588组TNF-α和sIL-2R水平显著高于NC组,而USP22组显著低于NC组(P<0.05),miR-588+USP22组的TNF-α和sIL-2R水平显著低于miR-588组而高于USP22组,见图7。

图7 miR-588通过靶向USP22对细胞培养基中TNF-α、sIL-2R水平的影响Fig.7 Effect of miR-588 on levels of TNF-α and sIL-2R in cell culture medium by targeting USP22
3 讨论
由于NB患者年龄较小,治疗方案受到较大的限制。BC占所有肿瘤的6%~10%,高危NB的治愈率低于30%,因此探究NB的发生和发展机制具有重要意义[8]。
USP22是一种去泛素化酶,可通过催化组蛋白H2A和H2B去泛素化改变染色质结构,USP22对于通过细胞周期G1期的进展至关重要[9]。USP22可作为原癌基因,通过诱导细胞的过度增殖诱导膀胱癌发生[10]。在胃癌中,USP22可以通过激活c-Myc/NAMPT/SIRT1通路使胃癌细胞获得转移能力[11]。在本研究中,实验结果显示过表达USP22不但可以诱导NB细胞增殖,还可以显著提高NB细胞迁移和侵袭能力。国内临床研究发现USP22的水平与NB患者的性别、年龄、肿瘤、病理分型和大小无关,但是出现淋巴转移的肿瘤组织中USP22水平显著高于未发生转移的组织[12]。一项最新的研究也显示与USP22阴性肿瘤相比,表达USP22的NB患者预后较差,并且多元Cox回归分析表明USP22蛋白水平是生存的预测因素[13]。本研究结果表明USP22的过表达不但会促进NB细胞增殖,还会提高细胞迁移和侵袭能力,提示高USP22水平与NB转移和预后不良有关。
研究显示miRNA可以通过碱基配对的方式与mRNA的3'-UTR区域结合从而调节基因的表达水平,参与NB的发生和发展[14]。miRNA在NB转移中发挥重要的调控作用,如miR-15a-5p、miR-15b-5p、miR-16-5p等[15]。国内有研究显示miR-588参与调控NB的迁移和侵袭[16]。此外,miR-588下调具有促进乳腺癌细胞进展的作用[17]。本研究检测了人正常神经细胞视网膜色素上皮细胞株和NB细胞SKN-SH中miR-588的水平,结果显示NB细胞中miR-588的水平降低,提示miR-588在NB中也可能发挥抑癌作用。此外,本研究还通过双荧光霉素报告验证了在SK-N-SH细胞中miR-588可以靶向抑制USP22的表达。进一步的研究结果显示过表达miR-588会抑制NB细胞的增殖、迁移和侵袭能力,而在过表达miR-588的基础上过表达USP22可以逆转miR-588的抑癌作用。已有研究发现在鼻咽癌中,USP22的表达也会受到miR-588的靶向调控[18]。这提示miR-588可以通过靶向结合USP22的mRNA的3'-UTR区域使USP22 mRNA降解,从而使USP22蛋白水平降低,进而诱导NB细胞迁移和侵袭能力的降低。此外,最新研究显示USP22也具有免疫抑制能力,研究显示敲除USP22可以通过T细胞依赖的方式缓解胰腺癌肿瘤免疫水平,从而减少肿瘤细胞浸润并抑制胰腺癌细胞的转移[19]。本次研究结果也显示miR-588组TNF-α和sIL-2R水平显著高于NC组而USP22组显著低于NC组,miR-588+USP22组TNF-α和sIL-2R水平显著高于miR-588组而低于USP22组。这提示USP22可以通过减少肿瘤杀伤相关细胞因子表达诱导免疫抑制,而miR-588可以通过靶向抑制USP的水平使TNF-α和sIL-2R水平升高,从而提高肿瘤免疫原性,缓解免疫抑制。
综上所述,本次研究通过细胞实验发现了miR-588可靶向抑制USP22表达诱导TNF-α和sIL-2R分泌,从而缓解免疫抑制,进而抑制NB的增殖和转移。关于miR-588通过USP22调控NB的作用仍需要体内实验验证,并且miR-588在NB免疫抑制中的作用值得进一步研究。