烟草角斑病叶际微生物群落结构与多样性分析
吴小军,汪汉成,孙美丽,蔡刘体,孟建玉,王 丰,彭丽娟
1. 贵州大学烟草学院,贵阳市花溪区花溪大道南段2708 号 550025
2. 贵州省烟草科学研究院,贵阳市观山湖区龙滩坝路29 号 550081
3. 长江大学农学院,湖北省荆州市荆州区荆秘路88 号 434025
烟草角斑病是烟叶生产上危害较大的一种细菌性病害,其病原菌为丁香假单胞杆菌角斑专化型(Pseudomonas syringae pv. angulata)[1-2]。该病原菌不产生毒素,可通过伤口或气孔侵染烟株的叶、花和茎等,借助风雨、昆虫在烟田传播[3-4]。该病害在我国云南、贵州、四川和福建等主产烟区均有发生,且常与赤星病和野火病混合发生,对烟叶生产造成较大经济损失[5-6]。植物叶际菌群结构的稳定程度会直接影响植物健康[7]。近年来,基于扩增子测序的分析技术被广泛用于植物的叶际、根际以及种子内生微生物群落结构的研究中[8-11]。有关烟草叶片真菌性病害的叶际微生物群落结构与多样性已有较多报道。刘畅等[12]研究发现,感烟草赤星病叶际的优势细菌属为假单胞菌属(Pseudomonas)和泛菌属(Pantoea)。向立刚等[13]研究表明,感赤星病的烤后烟叶叶际真菌多样性低于健康烟叶。陈乾丽等[14]研究发现,烤后轻度霉变烟叶真菌群落多样性高于重度霉变烟叶。孙美丽等[15]研究认为,感靶斑病烟叶叶际真菌群落多样性降低,而叶际细菌群落多样性增加。刘天波等[16]研究提出,通过施用拮抗菌剂能够改善感野火病烟叶叶际菌群结构。而目前有关烟草细菌性病害叶际微生物的研究却鲜见报道,尤其是烟草角斑病等主要细菌性病害,其叶际微生物群落结构和多样性特征尚不明确。为此,采用高通量测序技术从微观层面解析感染角斑病烟叶与健康烟叶间叶际细菌和真菌的菌群结构差异,以期为揭示烟草感染角斑病后其叶际微生物群落的变化规律提供依据。
1 材料与方法
1.1 试验材料
供试烟草品种为云烟87,DNA提取试剂盒(Fast DNA®Spin Kit for Soil)购自美国MP Biomedicals 生物医学公司,GeneJET 胶回收试剂盒(k0691)和Ion Plus Fragment Library Kit 建库试剂盒均购自美国Thermo Fisher Scientific公司。
1.2 取样地概况及样品采集
本试验取样时间为2019 年8 月,取样地点为贵州省施秉县(107°52′37″~108°28′47″E,26°46′46″~27°20′16″N),取样烟田烟草角斑病大规模爆发且前期未喷药。在同一烟田内随机选取明显感染角斑病的上部烟叶15 片(病斑数>10),用消毒剪刀剪取烟叶单个病斑部位的病叶组织,5片感病烟叶的病叶组织混合作为1 个处理,每个处理设置3 次重复,分别编号为SX1、SX2和SX3。再按上述方法在同一烟田随机剪取健康烟叶,制备组织样品,分别编号为SXJ1、SXJ2 和SXJ3。整个取样过程严格消毒,将采集的样品装入50 mL无菌离心管中,低温保存运输,带回实验室并置于-80 ℃超低温冰箱中保存备用。
1.3 微生物基因组DNA的提取及扩增子测序
参照Fast DNA®SPIN 试剂盒说明书提取感病与健康烟叶样品叶际微生物基因组DNA。用NanoDrop 2000(A260/A280为1.8~2.0)检测提取的DNA样本纯度和浓度,使用无菌水将其稀释至适宜质量浓度(1 ng/μL)。以稀释后的基因组DNA为模板,分别选取引物515F(5′-CCTAYGGGRBGCASCAG-3′)、806R(5′-GGACTACHVGGGTWTCTAAT-3′)和引物ITS5-1737F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)、ITS2-2043R(5′-GCTGCGTTCTTCATCGATGC-3′),参照Apprill等[17]的扩增体系及方法分别对样品细菌基因组DNA的16S V4区域和真菌基因组DNA的ITS1区域进行PCR扩增。PCR纯化产物回收后,使用Ion Plus Fragment Library Kit 建库试剂盒构建细菌16S 和真菌ITS 文库,并在Ion S5TMXL 平台上完成测序分析。
1.4 微生物群落结构与多样性分析
对原始序列优化处理后,使用Uparse 软件(Uparse v7.0.1001)以97%相似性水平对处理后的Clean reads 进行OTU 聚类[18],用于后续数据分析。使用MUSCLE 软件对各样品的数据进行均一化处理,同时分别统计叶际细菌和真菌在各分类水平的群落组成。使用Qiime软件(Version 1.9.1)计算样品细菌和真菌群落的α 多样性指数。此外,采用Tax4Fun 程序语言分别与Greengene 和FUNGuild 数据库比对,进一步分析感病与健康烟叶叶际细菌和真菌群落功能类群;采用R软件(Version 2.15.3)绘制稀释曲线图、Venn 图、物种组成柱形图、物种功能柱形图和功能聚类热图[19-20]。
1.5 数据处理
使用Excel 2019 和DPS7.5 软件进行数据处理,采用LSD法进行差异显著性检验。
2 结果与分析
2.1 16S与ITS测序深度分析
样品测序数据量是否合理可通过稀释曲线(Rarefaction Curve)来体现[15]。细菌和真菌样品稀释曲线结果见图1。本次测序的6 个细菌样品除SX2样品以外,稀释曲线在测序数据量达2 500条序列时已趋于平缓;6 个真菌样品的稀释曲线在测序数据量达4 000 条序列时已趋于平缓。表明本次测序数据量已足够,测序结果合理,可进行后续分析。
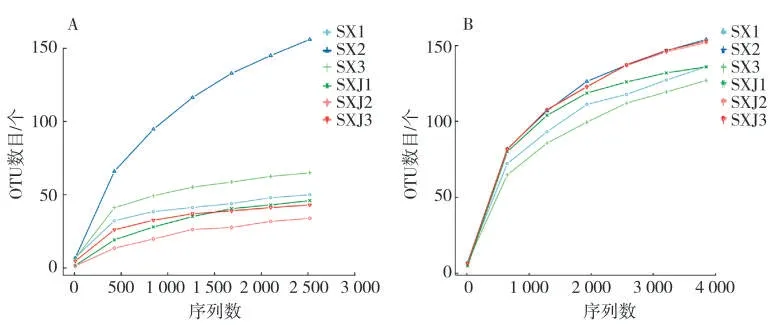
图1 烟叶样品细菌(A)和真菌(B)的稀释曲线(OTU水平)Fig.1 Rarefaction curves of bacteria(A)and fungi(B)in tobacco samples(OTU level)
2.2 数据质控和OTU聚类
测序的6个样品16S序列经过滤和优化后共获得高质量序列480 756 条,197 383 926 个碱基,序列平均长度为410 bp。其中,感病烟叶3个样品共获得高质量序列246 144条,健康烟叶3个样品共获得高质量序列259 319条,质控有效率达95.21%。对获得的高质量16S序列进行OTU聚类,经比对注释到数据库的OTUs数目为306个,占100%。注释到界、门、纲、目、科、属和种7个物种分类水平的比例分别为100%、79.08%、76.14%、65.36%、56.86%、42.16%和11.44%。
测序的6 个样品ITS 序列经过滤和优化后共获得高质量序列378 597 条,106 632 635 个碱基,序列平均长度为283 bp。其中,感病烟叶3个样品获得高质量序列208 255 条,健康烟叶3 个样品获得高质量序列170 342条,质控有效率达99.39%。对获得高质量ITS 序列进行OTU 聚类,经比对注释到数据库的OTUs 数目为268 个,占96.75%。注释到界、门、纲、目、科、属和种的比例分别为96.75%、52.35%、48.38%、47.65%、40.07%、36.82%和25.27%。
感病与健康烟叶叶际细菌和真菌群落差异分析结果见图2。感病与健康烟叶叶际细菌群落间存在较大差异,感病烟叶叶际存在135 个特有的OTUs,远高于两者共有及健康烟叶叶际特有的OUTs 数目(图2A)。感病与健康烟叶叶际真菌群落间差异不明显,感病与健康烟叶叶际中存在161 个共有的OTUs,远高于两者特有的OTUs数目(图2B)。
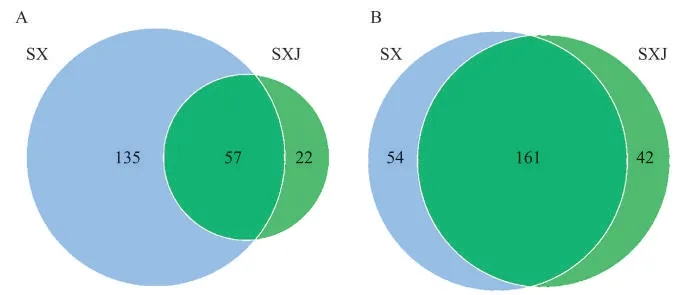
图2 感病与健康烟叶叶际细菌(A)和真菌(B)OTUs分布Venn图Fig.2 Venn diagrams of phyllosphere bacterial(A)and fungal(B)OTUs distribution in diseased and healthy tobacco leaves
2.3 感病与健康烟叶叶际微生物群落α多样性分析
由表1 可知,测序的细菌与真菌样品组间的覆盖度指数(Coverage index)均达到0.989 以上,表明测序结果具备代表性,能够较真实、合理地反映样品叶际细菌和真菌多样性。感病烟叶叶际细菌的多样性指数(Shannon)和丰富度指数(Chaol、ACE)均高于健康烟叶。其中,感病烟叶叶际细菌Shannon 多样性指数显著高于健康烟叶;感病烟叶叶际真菌多样性指数和丰富度指数也均高于健康烟叶,但差异不显著。

表1 感病与健康烟叶叶际细菌和真菌α多样性指数①Tab.1 Alpha diversity indices of phyllosphere bacteria and fungi in diseased and healthy tobacco leaves
2.4 感病与健康烟叶叶际细菌和真菌群落结构分析
在细菌群落门水平上,感病烟叶与健康烟叶叶际优势细菌门种类一致,但相对丰度存在差异。其中,感病(SX)与健康(SXJ)烟叶叶际均存在的优势细菌门为变形菌门(Proteobacteria,相对丰度分别为76.13%和17.32%)、放线菌门(Actinobacteria,2.04%和0.31%)和厚壁菌门(Firmicutes,3.40% 和0.37%)。其中,感病烟叶叶际的变形菌门相对丰度显著高于健康烟叶(图3A)。在真菌群落门水平上,感病烟叶与健康烟叶叶际优势真菌门种类一致,但相对丰度存在差异。其中,感病与健康烟叶叶际均存在的优势真菌门为子囊菌门(Ascomycota,62.64%和23.37%)、被孢菌门(Mortierellomycota,0.39%和1.05%)。其中,感病烟叶叶际子囊菌门的相对丰度显著高于健康烟叶(图3B)。
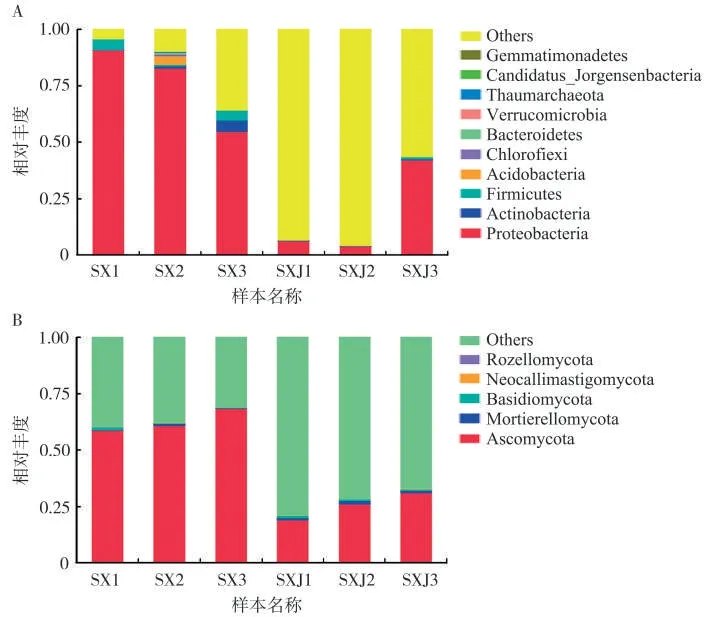
图3 感病与健康烟叶叶际细菌(A)和真菌(B)门水平的相对丰度Fig.3 Relative abundance of phyllosphere bacteria(A)and fungi(B)at the phylum level of diseased and healthy tobacco leaves
在细菌群落属水平上,感病烟叶与健康烟叶叶际优势细菌属种类与相对丰度均存在差异。其中,感病烟叶叶际优势菌属为假单胞菌属(Pseudomonas)、泛菌属(Pantoea)、黄杆菌属(Xanthomonas)、甲基杆菌属(Methylobacterium)、寡养单胞菌属(Stenotrophomonas)、鞘氨醇单胞菌属(Sphingomonas)和属水平未分类的根瘤科(unidentified_Rhizobiaceae),相对丰度分别为35.94%、10.68%、4.94%、4.18%、2.38%、2.99%和7.73%(图4A)。健康烟叶叶际优势菌属为假单胞菌属、鞘氨醇单胞菌属、泛菌属和甲基杆菌属,相对丰度分别为8.88%、2.35%、1.84%和1.33%。在真菌群落属水平上,感病烟叶与健康烟叶叶际优势真菌种类及相对丰度均存在差异。其中,感病烟叶叶际优势菌属为小不整球壳属(Plectosphaerella)、亚格孢壳属(Didymella)、赤霉菌属(Gibberella)和链格孢属(Alternaria),相对丰度分别为10.81%、9.06%、3.23%和2.20%。健康烟叶叶际优势菌属为小不整球壳属、枝孢霉属(Cladosporium)、亚格孢壳属和Boeremia,相对丰度分别为6.56%、1.09%、2.98%和1.09%(图4B)。
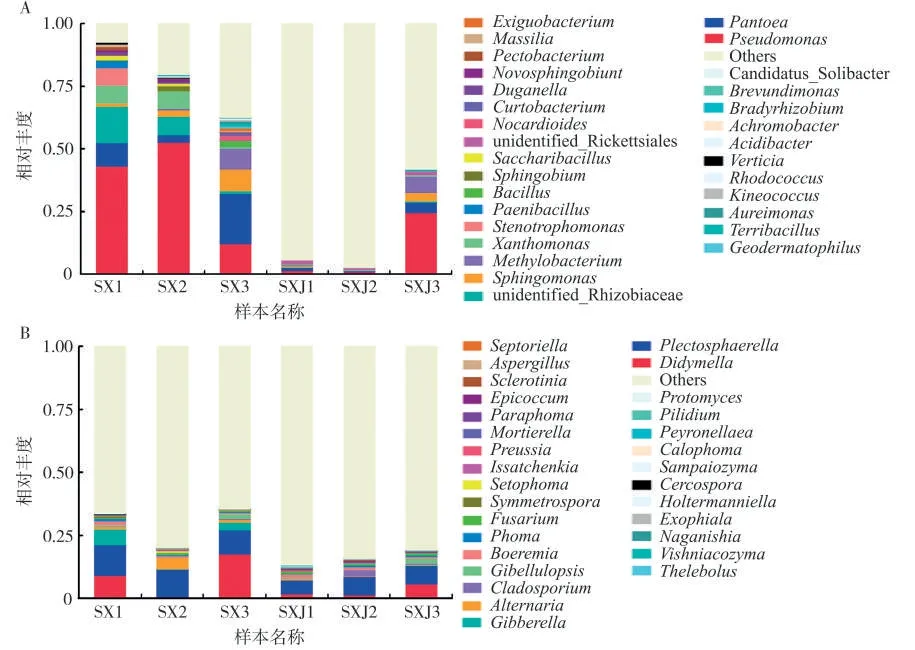
图4 感病与健康烟叶叶际细菌(A)和真菌(B)属水平的相对丰度Fig.4 Relative abundance of phyllosphere bacteria(A)and fungi(B)at the genus level of diseased and healthy tobacco leaves
2.5 感病与健康烟叶叶际细菌和真菌功能预测
烟叶叶际细菌功能预测结果(图5)表明,在一级功能层(L1)上,感病与健康烟叶叶际细菌均分布于6类功能通路。主要为代谢类(相对丰度分别为48.34%和50.41%),其次为遗传信息处理类(16.66%和17.28%)、环境信息处理类(14.83%和13.15%)、细胞转化类(3.46%和2.46%)、人类疾病类(1.34%和1.27%),最低的为有机系统类(0.80%和0.88%)(图5A)。
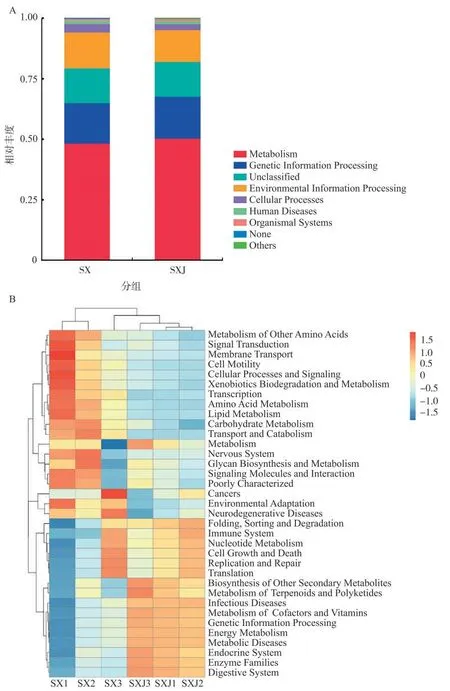
图5 感病与健康烟叶叶际细菌的KEGG功能预测Fig.5 Functional prediction of phyllosphere bacteria in diseased and healthy tobacco leaves
细菌群落功能聚类热图(图5B)表明,感病与健康烟叶叶际细菌在二级功能层(L2)上均主要分布于35 类代谢通路中,感病与健康烟叶叶际细菌功能通路种类基本相同,但相对丰度存在差异。其中,感病与健康烟叶叶际细菌在二级功能层上相对丰度最高的均为环境信息处理类中的膜运输(相对丰度分别为10.8%和12.3%),但感病与健康烟叶叶际细菌主要分布于新陈代谢类,功能从强到弱(>1%)依次为能量代谢(8.0%~10.5%)、氨基酸代谢(8.2%~9.0%)、碳水化合物代谢(8.3%~8.6%)、辅酶和维生素代谢(5.0%~5.9%)、核苷酸代谢(3.2%~3.3%)、脂质代谢(2.6%~3.1%)、未分类代谢(2.6%~2.7%)、外源生物降解和代谢(2.2%~2.7%)、萜类化合物和聚酮化合物代谢(1.9%~2.1%)、聚糖生物合成和代谢(1.9%)、其他氨基酸代谢(1.6%~1.7%)。
烟叶叶际真菌群落功能预测柱形图(图6)表明,感病与健康烟叶叶际真菌生态功能类群相似,均主要分布于22个生态功能类群,其差异主要体现在优势生态功能类群的相对丰度上。感病烟叶叶际真菌主要分布于植物病原菌(14.99%)、植物病原-未定义腐生菌(9.06%)、动物病原体-植物病原体-木材病原体-木腐生菌(2.20%)和内生植物病原菌(1.04%)。健康烟叶叶际真菌主要分布于植物病原菌(7.69%)、植物病原-未定义腐生菌(2.98%)、内生植物病原菌(2.18%)和未定义腐生菌(1.05%)。

图6 感病与健康烟叶叶际真菌的FUNGuild功能预测Fig.6 Functional prediction of phyllosphere fungi in diseased and healthy tobacco leaves
3 讨论
植物叶际微生物以营腐生、内生和自由生活等方式定殖,通过竞争、拮抗及诱导植物系统抗性等作用保护宿主植物抵御病原体侵染[21]。研究表明,叶际微生物群落结构改变是诱导植物发病的一个重要影响因素[22]。本研究中发现感染烟草角斑病烟叶叶际优势细菌属为假单胞菌属、泛菌属、鞘氨醇单胞菌属、甲基杆菌属、黄杆菌属;优势真菌属为小不整球壳属、亚格孢壳属、赤霉菌属和链格孢属,与刘亭亭等[23]报道的感染赤星病烟叶叶际优势细菌、真菌种类部分一致。相比于健康烟叶,感病烟叶叶际细菌和真菌的优势菌属种类均增加。其中,感病烟叶叶际假单胞菌属的相对丰度远高于健康烟叶。该属种类繁多、功能类群多样[24],被报道的病原菌有丁香假单胞烟草致病变种(Pseudomonas syringae pv. tabaci)[6]、丁香假单胞杆菌角斑专化型[4],两者在环境适宜条件下均能大量繁殖,为害烟叶。该属被报道的生防菌有御假单胞菌(P. protegens)、绿针假单胞菌(P.choloeaphtis)、荧光假单胞菌(P. fluorescens)等[25]。此外,该菌属有些物种还具备生物降解的功能,如产碱假单胞菌(P.alcaligenes)、恶臭假单胞菌(P.putida)等均能代谢产生促进生物降解的物质[26]。同时,在环境方面,由于取样期间烟田温度与湿度均较高,高温高湿有利于细菌性病害的发生。因此,推测环境与病菌假单胞菌属共同作用,使烟叶叶际微生物群落结构失调,从而导致烟叶感角斑病后其叶际优势细菌和真菌种类增加,但假单胞菌属与其他优势细菌和真菌间的作用机制还有待进一步研究。
病原菌的侵染通常会导致叶际微生物多样性发生改变,细菌性病害发生后,叶际微生物多样性增加[21],而真菌性病害则相反。例如,烟草在感染青枯病后,其茎秆病害组织的真菌群落丰富度与多样性均显著增加[27],而烟叶在感染赤星病后,其感病组织叶际微生物多样性则会降低[13]。本研究中发现感病烟叶叶际细菌和真菌的丰富度和多样性均高于健康烟叶,尤其是细菌多样性差异显著,说明烟草细菌性病害的发生会使其叶际细菌、真菌丰富度和多样性增加。有研究报道,微生物在植物叶际定殖存在优先效应,即微生物定殖的先后顺序会影响植物叶际菌群结构[22]。其中,假单胞菌属为叶际初级定殖菌,可保护次级定殖菌抵御环境胁迫[28]。因此,推测烟叶在感病后其叶际假单胞菌属丰度增加为其他次级定殖菌提供了有利条件,使叶际真菌和细菌丰富度和多样性增加。
植物叶际微生物在叶际定殖通常发挥其自身特定的生理功能[21]。本研究中发现感染角斑病烟叶与健康烟叶叶际细菌分布于6类功能通路中,其中以代谢类为主,其次是遗传信息处理类。二级功能层以膜运输相对丰度最高,其次是氨基酸、碳水化合物、核苷酸等物质和能量代谢。有研究报道,黄杆菌属能够降解无机磷[29],甲基杆菌属能够利用其他大部分生物不能利用的物质(如甲醇、甲醛等)作为碳源和能源生长[30]。推测烟叶感染角斑病后,假单胞菌属在叶际养分的利用上占据优势而抑制其他部分菌属生长时,黄杆菌属和甲基杆菌属却能够利用自身独特方式获取营养物质进行生长繁殖,演变为感病烟叶叶际优势细菌属。此外,本研究中还发现感病与健康烟叶叶际真菌均主要分布在植物病原菌和植物病原-未定义腐生菌两个功能类群,这与Huang等[31]报道侵染烟叶的亚格孢壳属真菌功能预测的研究结果基本一致,进一步说明了植物病原菌和植物病原-未定义腐生菌为烟草叶际优势真菌类群。
4 结论
感染角斑病烟叶叶际细菌优势菌属为假单胞菌属、泛菌属、属水平未分类的根瘤科、甲基杆菌属、黄杆菌属、寡养单胞菌属和鞘氨醇单胞菌属;健康烟叶叶际细菌优势菌属为甲基杆菌属、泛菌属、鞘氨醇单胞菌属和假单胞菌属。感病烟叶叶际真菌优势菌属为小不整球壳属、亚格孢壳属、赤霉菌属和链格孢属;健康烟叶叶际真菌优势菌属为小不整球壳属、亚格孢壳属、枝孢霉属和Boeremia。感病烟叶叶际细菌和真菌的多样性和丰富度指数均高于健康烟叶。感病与健康烟叶叶际细菌功能通路种类基本一致,而相对丰度存在差异。感病与健康烟叶叶际真菌的功能类群大部分相同,但相对丰度存在差异。

