中药单体基于肠道菌群调节Th17/Treg轴对自身免疫性疾病的干预研究现状Δ
黄金雨,董政委,王永霞 (河南中医药大学第一附属医院心脏中心,郑州 450003)
自身免疫性疾病(autoimmune diseases,ADs)是一类机体对自身抗原发生免疫反应而导致自身组织损害的疾病,其中以溃疡性结肠炎(ulcerative colitis,UC)、类风湿性关节炎(rheumatoid arthritis,RA)、1型糖尿病(type 1 diabetes mellitus,T1DM)的发病率较高。据统计,全球7.6%~9.4%的人群患有各种类型的ADs,ADs已成为仅次于心血管疾病和癌症的第三大慢性病,严重影响患者的生活质量[1]。对症治疗(如抗炎和自身免疫抑制)是ADs的主要治疗策略,但其难以实现完全治愈,且有严重的胃肠道不良反应,还可能增加免疫抑制导致的感染[2]。因此,探索更为有效、安全的治疗策略已迫在眉睫。中药具有多靶向性、低毒安全的特色,在ADs防治中具有明显优势,针对中药单体的研究近年来备受关注。肠道微生物群已被证明与免疫细胞有相互作用,其可通过抑制辅助性T细胞17(helper T cell 17,Th17)分化、维持调节性T细胞(regulatory T cell,Treg)分化及调节免疫耐受从而抑制炎症,在ADs的发病中起重要作用[3]。基于此,本文综述了中药单体基于肠道菌群调节Th17/Treg细胞分化进而干预ADs的研究现状,旨在为ADs的中西医结合防治提供参考。
1 Th17/Treg轴对ADs的影响
Th17和Treg细胞具有同源性,均由初始CD4+T细胞分化而成,细胞因子的种类及细胞因子间的平衡在调控初始CD4+T细胞分化方向中起重要作用。Th17的分化由转化生长因子β(transforming growth factor-β,TGFβ)和白细胞介素6(interleukin-6,IL-6)启动,二者共同诱导信号传导与转录激活因子3(signal transduction and activator of transcription 3,STAT3)的激活,进而促进转录因子维甲酸相关孤核受体γt(retinoic acid-related orphan nuclear receptor γt,RORγt)表达、激活IL-17转录;随后,IL-6刺激IL-21产生,加速Th17细胞增殖分化,并诱导IL-23受体表达,从而在后期维持Th17细胞的稳定分化[4]。叉头框蛋白p3(Forkhead box protein P3,Foxp3)是Treg的标志性转录因子,参与维持Treg的分化和功能,研究表明,Foxp3基因缺陷会导致严重自身免疫病[5]。
Th17/Treg失衡与多种ADs相关:Th17是主要效应因子,可分泌IL-17、IL-21和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等促炎因子,引起炎症和严重自身免疫[6];另一方面,Treg可分泌IL-10和TGF-β等抗炎因子,具有免疫抑制功能。二者相互制约,共同维护机体内环境稳定[7]。Bunte等[8]在早期RA患者血清中检测到IL-17浓度升高,发现IL-17能诱导成纤维样滑膜细胞和上皮细胞产生血管内皮生长因子,进而导致血管翳生成,并能减少RA软骨形成。Kurolap等[9]研究表明,UC病变部位的Th17分化增强,进而促进了结肠慢性炎症和UC的进展。此外,在大量ADs患者和动物模型中也观察到Treg细胞数量减少或功能丧失[10]。可见,调节Th17/Treg平衡对治疗ADs具有重要意义。
2 肠道菌群调控宿主Th17/Treg轴在ADs中的作用
肠道菌群是肠道内复杂而庞大的微生态系统,在机体免疫系统的发育中起到了关键作用。ADs的发生与肠道微生态的变化息息相关,其中肠道菌群对T细胞的调控是关键桥梁。目前,相关学者已在多种ADs患者中发现肠道菌群的多样性减低和菌种分布异常[11]。肠道菌群调节Th17/Treg平衡的相关作用机制包括调节细胞因子产生、调控转录因子表达、影响能量代谢等[12]。例如,Lee等[5]研究表明,肠道内分节丝状菌可通过刺激树突状细胞分泌IL-6、IL-23,进而诱导Th17在小肠分化,使ADs发病率明显增加。短链脂肪酸(short-chain fatty acid,SCFA,包括乙酸、丙酸和丁酸等)是肠道菌群的常见代谢物,可通过多途径促进Treg分化。例如,丁酸盐可改变Foxp3基因启动子中的组蛋白H3乙酰化来促进Treg产生[13]。可见,基于肠道菌群调控Th17/Treg失衡,诱导重建免疫耐受,可能成为治疗ADs的新方法。
3 中药单体通过肠道菌群调节Th17/Treg轴对不同ADs的干预作用
3.1 UC
UC是一种炎症性肠病(inflammatory bowel disease,IBD),肠黏膜屏障受损是其关键病理机制[14]。肠紧密连接(tight junction,TJ)是肠黏膜屏障的主要结构基础,由多种功能各异的蛋白质组成,如跨膜蛋白(闭合蛋白、咬合蛋白)和闭锁小带蛋白(zonula occludens,ZOs)等。病理情况下,肠道微环境紊乱可导致Th17/Treg失衡,引起免疫炎症反应,TJ蛋白受到炎性破坏而致肠壁通透性增加,进而促使UC发生。
Liu等[15]通过16S rRNA基因测序发现,红景天苷可恢复UC小鼠肠道菌群的多样性,提高厚壁菌门等细菌的比例,抑制拟杆菌门等细菌的比例,并可显著增加结肠固有层Treg细胞数,降低IL-6、IL-17A mRNA表达水平,抑制Th17分化,进而使得促炎因子IL-1β生成减少,以缓解肠黏膜炎性损害。该实验进一步构建了伪无菌小鼠模型,结果发现红景天苷对T细胞亚群分化及炎症因子的调节作用丧失,从而佐证了红景天苷治疗UC的作用与肠道菌群相关。
人参皂苷Rg1是人参提取物,Zhang等[16]研究发现,人参皂苷Rg1可调节肠道菌群的多种代谢途径(如抑制乙醛酸循环、柠檬酸循环、L-精氨酸通路),抑制Th17表达,促进Treg分化,下调Toll样受体4/髓样分化因子88信号通路而降低血清中促炎因子IL-1β、TNF-α和IL-17A水平,并上调抗炎因子IL-10水平,从而修复肠壁的炎性破坏。
先天淋巴细胞(innate lymphoid cell,ILC)多为组织驻留淋巴细胞,可分泌相关细胞因子协调T细胞分化[17]。Dong等[18]发现,小檗碱可调节葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的UC小鼠肠道菌群丰度和组成,减少结肠组织ILC1而增加ILC3,发挥抑制RORγt表达和Th17分化作用,能减少促炎因子IL-17、TNF-α的分泌,有效保护肠杯状细胞和TJ蛋白,修复肠黏膜屏障。甘金刚等[19]亦发现,小檗碱能够改善UC患者肠道菌群和肠道免疫状态,抗炎功效显著。
Xiao等[20]发现,姜黄素在门、纲、目、科和属水平上可调控UC合并糖尿病小鼠肠道微生物菌群的多样性和相对丰度,抑制RORγt而激活Foxp3,恢复Th17/Treg平衡,降低促炎因子IL-17A水平,减少炎症细胞浸润,不仅能改善胰岛素抵抗和血糖水平,还可有效逆转结肠黏膜破坏。
Wang等[21]发现,流苏石斛多糖可改善UC小鼠肠道菌群代谢,提高SCFA浓度,抑制细胞因子IL-6、IL-17、IL-21、IL-23而恢复Th17/Treg细胞平衡,还能抑制核因子-κB炎症信号通路和促炎因子IL-1β、IL-17、IL-21的表达,上调UC小鼠咬合蛋白和ZO-1的表达。
Wen等[22]研究发现,豆甾醇可改善IBD小鼠的肠道菌群多样性和菌群结构失调,进而增加肠道微生物来源的SCFA,特别是丁酸盐;并发现丁酸盐可通过介导过氧化物酶增殖物激活受体γ的激活,改善能量代谢,从而促进初始CD4+T细胞分化为Treg,恢复Th17/Treg平衡,显著下调DSS诱导的炎症因子IL-6、IL-1β和TNF-α表达,缓解结肠炎性损害。
Hua等[23]首次发现,胡桃醌可能通过调节肠道菌群显著抑制STAT3和RORγt蛋白表达,上调Foxp3蛋白表达,重建Th17/Treg平衡并降低结肠组织中IL-6、TNF-α和IL-1β蛋白表达水平和UC小鼠疾病活性指数,增加IL-10蛋白表达,且其疗效与剂量呈正相关。
Wu等[24]发现,大黄酸可显著增加DSS诱导的IBD小鼠肠道乳酸菌属的丰度,抑制Th17分化,恢复Th17/Treg平衡,减少炎症因子IL-17的合成而发挥良好的抗炎作用,从而减轻模型小鼠的结肠炎症和组织损伤。
Liu等[25]证实,小白菊内酯可显著增加肠道菌群的生物多样性,提高有益菌的相对丰度和SCFA水平,降低细胞因子IL-6和IL-17A水平,以恢复Th17/Treg免疫平衡,进而降低促炎因子IL-1β、TNF-α水平并提高抗炎因子IL-10水平,从而缓解结肠炎性浸润及渗出。该研究进一步用抗生素鸡尾酒法建立伪无菌小鼠模型,结果发现小白菊内酯的上述抗炎作用消失。
Zhu等[26]发现,黄芩苷可改善肠道菌群的多样性及分布,显著提高产丁酸菌的丰度和丁酸的含量,上调Foxp3 mRNA转录而下调RORγt mRNA转录,恢复Th17/Treg平衡,上调抗炎因子IL-10而下调促炎因子IL-17,并能降低结肠组织活性氧的活性,增加UC大鼠结肠ZO-1和咬合蛋白的表达,恢复结肠黏膜的完整性。
瑞香素别名“祖师麻甲素”,Ji等[27]发现,瑞香素可提高肠道中产SCFA菌的丰度并降低IL-6、IL-21和IL-23的水平,逆转IBD小鼠Th17/Treg失衡,抑制促炎因子IL-1β,从而缓解结肠免疫炎症。胡红锋等[28]在UC患者中发现,瑞香素能通过调节患者肠道菌群的组成和Th17/Treg平衡,促进患者肠黏膜愈合,有效改善患者病情,且安全可靠。
Alrafas等[29]发现,白藜芦醇可显著逆转IBD小鼠肠道菌群失调并提高SCFA水平,促进Treg分化,抑制Th17分化,降低IBD小鼠肠道中的炎症生物标志物髓过氧化物酶的水平,从而显著减轻结肠炎性损伤,且该结论在粪便菌群移植实验中得到了验证。
Jing等[30]发现,党参多糖具有良好的益生元特性,可刺激有益菌的生长并抑制致病菌的生长。该研究通过气相色谱法测定了DSS诱导的IBD小鼠粪便中SCFA的含量,结果发现党参多糖显著提高了小鼠粪便中乙酸、丙酸和丁酸水平,下调了细胞因子IL-6、IL-17的表达,恢复了Th17/Treg免疫平衡,使得促炎因子IL-17、TNF-α相应减少而抗炎因子TGF-β、IL-10生成增多,有效缓解了小鼠肠黏膜炎性浸润和肠黏膜屏障破坏。
杨阳[31]研究发现,马齿苋多糖可恢复UC模型小鼠肠道菌群结构,降低细胞因子IL-6和IL-17含量,恢复Th17/Treg平衡,抑制核因子-κB信号通路激活和促炎因子 IL-17、TNF-α生成,促进抗炎因子IL-10生成,有效减轻DSS诱导的肠道炎症反应。
3.2 RA
RA是一种以血管炎和滑膜炎为特征的最终引起关节软骨及骨破坏的慢性ADs。TNF-α和IL-6等是RA发病中激起炎症反应的初始因素以及RA炎症和关节损伤的重要介质[32]。
Peng等[33]通过建立胶原诱导型关节炎(collageninduced arthritis,CIA)大鼠模型发现,白芍总苷可提高大鼠肠道有益共生菌的相对丰度,下调Th17分化、促进Treg分化,降低肠道细胞因子γ-干扰素水平,减轻踝关节炎性细胞浸润,降低关节滑膜血管内皮生长因子含量,有效抑制血管生成和滑膜细胞增殖。
姜冀等[34]发现,白藜芦醇可提高CIA小鼠肠道中拟杆菌、乳杆菌和双歧杆菌的丰度,降低血清中促炎细胞因子IL-6、TNF-α水平;流式细胞术分析显示小鼠脾脏中Th17细胞数下调而Treg细胞数上调,提示白藜芦醇有效改善了CIA小鼠的系统炎症,缓解了骨破坏及滑膜细胞增生。
陶伟莉[35]研究发现,老鹳草多糖可调节CIA小鼠肠道菌群丰度,增加SCFA(如乙酸、丙酸、正丁酸等)的含量,使Th17/Treg细胞比例趋向平衡,进而恢复抗炎因子与促炎因子的平衡,使得CIA小鼠后足肿胀得以消退,脾脏明显减小。
3.3 T1DM
T1DM是青少年和儿童最常见的代谢性疾病之一,以自身免疫系统逐渐破坏胰腺β细胞从而导致胰岛素缺乏和高血糖为特征。除遗传是T1DM易感性的重要因素外,肠道菌群紊乱以及Th17/Treg免疫失衡也已被证明在T1DM的发病机制中发挥关键作用[36]。
Chen等[37]发现,熊果酸可改善T1DM大鼠肠道菌群多样性及菌群结构,抑制转录因子RORγt表达,促进Foxp3表达,恢复Th17/Treg平衡,下调促炎因子IL-17A、TNF-α水平而上调抗炎因子IL-10水平,发挥延缓胰岛β细胞破坏、降低空腹血糖的作用。
Luo等[38]发现,芍药苷可提高萨特氏菌属丰度,抑制细胞因子IL-6生成和Th17分化而促进Treg分化,抑制促炎因子IL-1β分泌,进而有效缓解胰岛炎症浸润和胰腺β细胞损伤。
3.4 其他
中药单体在治疗自身免疫性脑脊髓炎、自身免疫性葡萄膜炎、银屑病等ADs中亦发挥了显著作用。例如,松香酸可改善咪喹莫特诱导的银屑病模型小鼠肠道菌群,抑制TNF-α、IL-17A、IL-23分泌,恢复Th17/Treg平衡,减轻皮肤损伤[39]。人参皂苷Rd可调控实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠肠道菌群并抑制RORγt、STAT3表达,促进Foxp3表达,降低IL-6和IL-17水平而提高TGF-β、IL-10水平,从而调节Th17/Treg失衡,减轻中枢神经系统脱髓鞘和炎症细胞浸润[40]。Du等[41]在实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis,EAU)小鼠中观察到,小檗碱可增加肠道中具有免疫调节能力的细菌数,抑制Th17分化而促进Treg分化,减轻免疫炎症反应,从而缓解血-视网膜屏障破坏。
上述研究中药单体在干预ADs中调节的肠道菌群见表1。
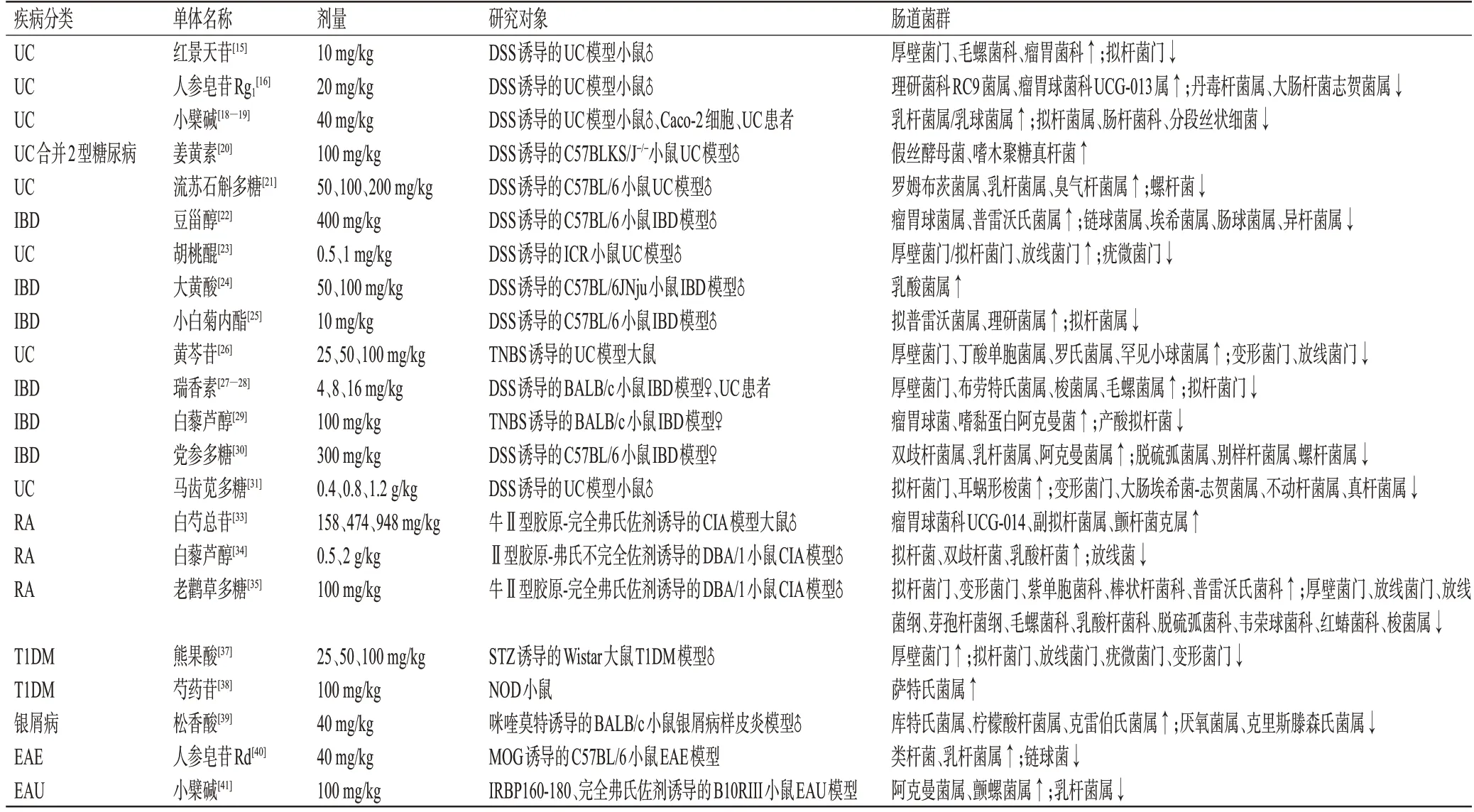
表1 中药单体在干预ADs中调节的肠道菌群
4 结语
随着二代测序技术的快速发展,肠道、皮肤、口腔和泌尿道的微生物群得到了广泛研究。肠道菌群失衡以多种方式影响Th17/Treg分化平衡,参与自身免疫耐受破坏和过度炎症反应,在ADs发病中起到至关重要的作用。中药防治ADs的历史悠久,相较于化学药,其不良反应少且疗效确切。然而,中药及中药复方的成分较为复杂,这使其科学性和安全性饱受诟病。本文系统综述了基于肠道菌群调节Th17/Treg轴干预ADs的中药单体,发现中药单体对ADs的治疗依赖于其对肠道菌群的调节,并通过调节细胞因子产生、调控转录因子表达、影响能量代谢等多途径调节Th17/Treg平衡,改善免疫炎症反应。
然而,由于当前研究多停留在现象观察方面,对于中药单体影响肠道菌群和免疫平衡的具体作用途径仍需进一步探索,且适应性免疫反应在ADs中的作用仍有许多问题尚未解决。为开发新的有效治疗策略,不同T细胞亚群在ADs病变中的具体作用仍需充分阐明。此外,免疫学和遗传学的最新进展阐明了固有免疫在ADs发病中的重要性。研究固有免疫和适应性免疫间的相互作用,特别是它们与肠道微生物群的关系,将有望为ADs的防治提供新的视野。

