ADC类药物治疗乳腺癌疗效与安全性的Meta分析Δ
徐吟雪,张蕾,乔熙雯,沈晓岚,沈倩,张学会 (南京医科大学附属江苏盛泽医院药学部,江苏 苏州 215228)
根据2020年全球癌症统计,乳腺癌在女性恶性肿瘤中占据首位,且死亡率位居女性恶性肿瘤第二位[1]。抗体药物偶联物(antibody-drug conjugate,ADC)是一类由抗体、连接头和细胞毒性药物组成的靶向生物药,此类药物以单抗为载体,可将小分子细胞毒性药物靶向、高效地运输至目标肿瘤细胞内而发挥抗肿瘤的作用,目前主要用于治疗乳腺癌[2],代表药物有恩美曲妥珠单抗(trastuzumab emtansine,T-DM1)、德曲妥珠单抗(trastuzumab deruxtecan,T-Dxd)和戈沙妥珠单抗(sacituzumab govitecan,SG)。《美国国立综合癌症网络乳腺癌临床实践指南 v3.2022》推荐T-DM1和T-Dxd为人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER2)阳性复发转移性乳腺癌患者的二线用药,且T-Dxd为首选方案[3]。《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2023)》中,对于曲妥珠单抗治疗失败的HER2阳性晚期乳腺癌患者,T-DM1为Ⅰ级推荐,T-Dxd为Ⅱ级推荐;对于紫杉类药物治疗失败的三阴性乳腺癌(triple-negative breast cancer,TNBC)晚期患者,SG为Ⅱ级推荐[4]。有研究显示,在曲妥珠单抗治疗失败后,T-Dxd较T-DM1更能显著改善患者的无进展生存期(progression-free survival,PFS),疾病进展或死亡风险比(hazard ratio,HR)降低了72%[5]。ASCENT研究结果显示,在既往多线耐药的难治性TNBC患者中,与单药化疗(如卡培他滨、艾立布林等)相比,SG降低了患者59%的疾病进展风险以及52%的死亡风险[6—7]。虽然已有一些新的关于ADC类药物的临床研究数据公布,但其疗效和安全性尚不明确,因此有必要对ADC类药物治疗乳腺癌的疗效与安全性进行评价。为此,本研究采用Meta分析的方法评价了ADC类药物治疗乳腺癌的疗效和安全性,以期为临床用药提供循证依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型
本研究纳入文献类型为国内外公开发表的随机对照试验(randomized controlled trial,RCT);语种限定为中文或英文。
1.1.2 研究对象
本研究纳入的患者均经组织病理学诊断为乳腺癌。
1.1.3 干预措施
试验组患者给予T-DM1、T-Dxd或SG;对照组患者给予化疗药物(如卡培他滨、吉西他滨、艾立布林等)或其他抗肿瘤药物(如曲妥珠单抗、多西他赛、拉帕替尼、紫杉醇等)。
1.1.4 结局指标
本研究的结局指标包括:(1)PFS;(2)总生存期(overall survival,OS);(3)客观缓解率(objective response rate,ORR);(4)临床获益率(clinical benefit rate,CBR);(5)3/4级不良反应(adverse drug reactions,ADR)发生率。
1.1.5 排除标准
本研究的排除标准包括:(1)评论、个案报道、综述、系统性评价文献;(2)无法获取全文、数据不全的文献;(3)无法提取结局指标的文献。
1.2 文献检索策略
计算机检索PubMed、the Cochrane Llibrary、Embase、Web of Science、中国知网、万方数据库、维普网,英文检索词为“breast neoplasm”“breast cancer”“sacituzumab govitecan”“SG”“trodelvy”“trastuzumab emtansine”“TDM1”“trastuzumab deruxtecan”“T-Dxd”;中文检索词为“乳腺肿瘤”“乳腺癌”“戈沙妥珠单抗”“恩美曲妥珠单抗”“德曲妥珠单抗”。采用主题词和自由词相结合的方式检索,检索时限均为建库起至2023年4月。
1.3 文献筛选与资料提取
由2名研究者独立按纳入与排除标准筛选文献,如遇分歧则通过讨论或由第三方解决。提取数据包括:第一作者及发表年份、样本量、干预措施、结局指标等。
1.4 文献质量评价
采用Cochrane系统评价员手册推荐的5.1.0偏倚风险评估工具进行质量评价,具体包括:随机分配方法、是否实施分配隐藏、对患者和研究者采用盲法、对结果测量者采用盲法、结果数据完整性、选择性报告结果和其他偏倚来源。每个条目分为“高偏倚”“低偏倚”“不清楚”[8]。
1.5 统计学方法
采用RevMan 5.4.1软件进行Meta分析。PFS、OS以HR及其95%置信区间(confidence interval,CI)表示,ORR和CBR及3/4级ADR发生率以比值比(odds ratio,OR)及其95%CI表示。采用χ2检验分析各研究间的异质性,若P>0.1,I2<50%,表明各研究间无统计学异质性,采用固定效应模型分析;反之,则采用随机效应模型分析。若结果存在临床异质性,则进行亚组分析;若结果无临床异质性,则进行敏感性分析。检验水准α=0.05。
2 结果
2.1 文献筛选结果与纳入研究基本信息
初检共检索到6 067篇文献,经阅读题目、摘要及全文后,最终纳入文献8篇[9—16],共计5 577例患者,其中试验组2 988例,对照组2 589例。结果见图1、表1。
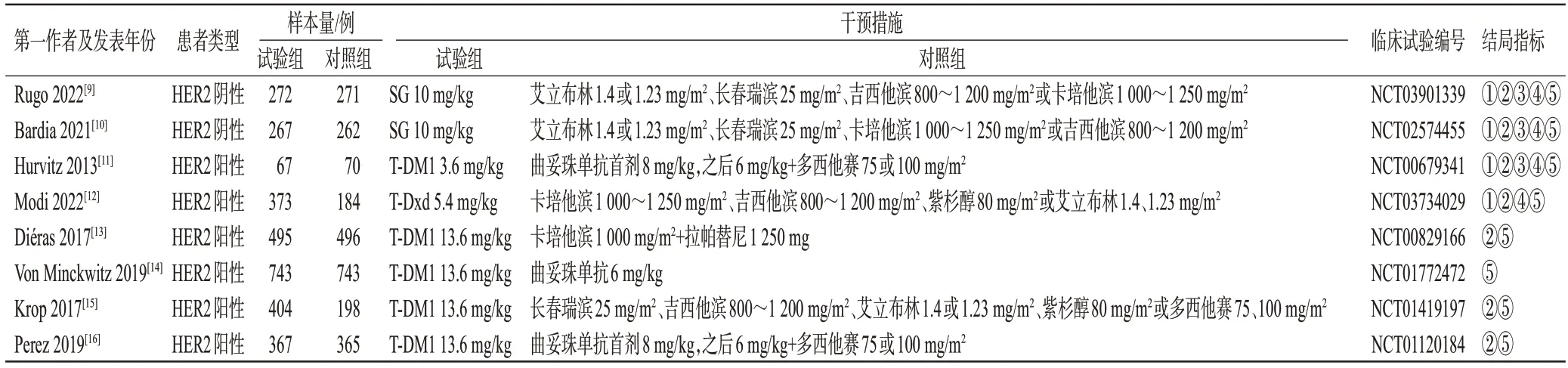
表1 纳入研究的基本信息
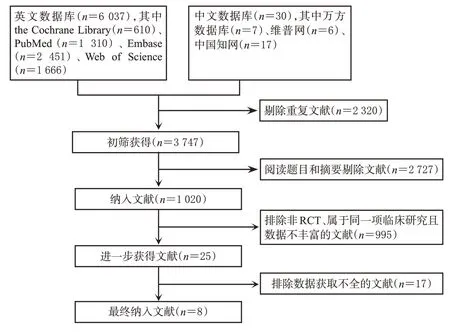
图1 文献筛选流程图
2.2 纳入文献的质量评价结果
8项研究均为RCT[9—16];所有研究均为合理产生分配序列,均不清楚分配隐藏;4项研究对研究者和受试者均采用盲法[9—10,12,15],6项研究在结局评估时使用盲法[9—10,12—13,15—16];所有研究结局数据完整,均未选择性报告结果,均不清楚是否存在其他偏倚来源。结果见图2、图3。
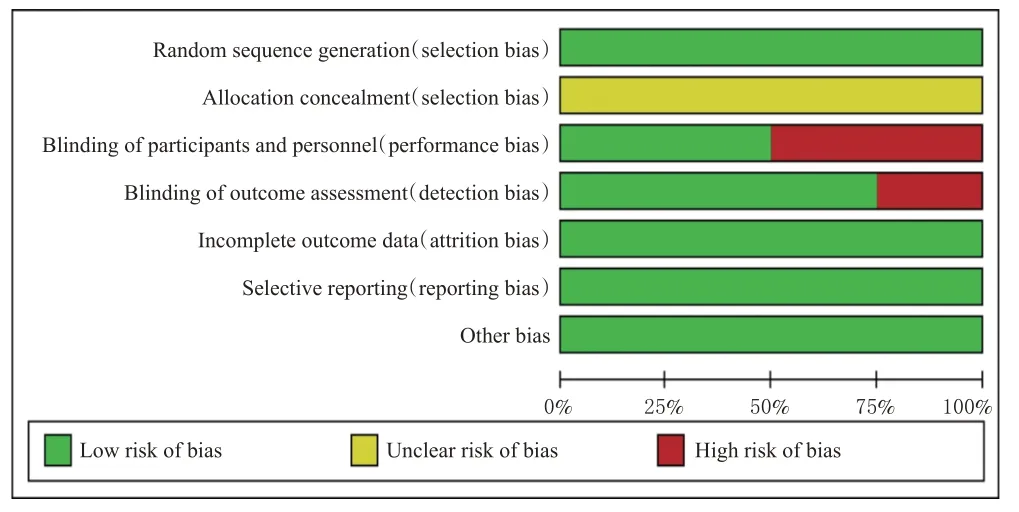
图2 偏倚风险条形图
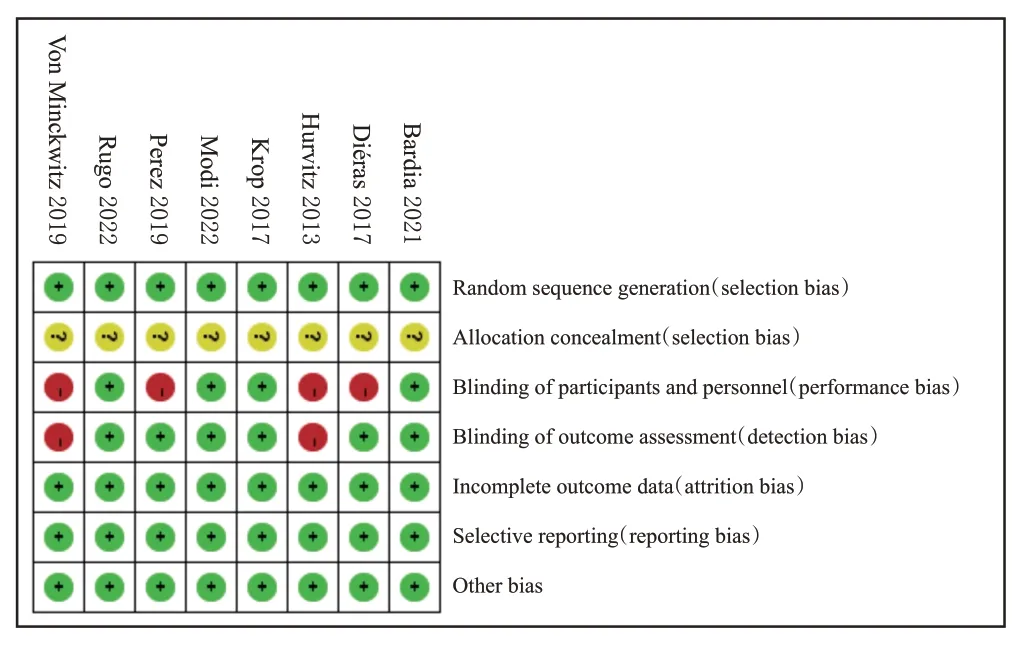
图3 偏倚风险图
2.3 Meta分析结果
2.3.1 PFS
4项研究报道了PFS[9—12],各研究间有统计学异质性(P=0.05,I2=61%),采用随机效应模型。结果显示,试验组患者的PFS显著长于对照组[HR=0.76,95%CI(0.69,0.83),P<0.000 01],详见图4。

图4 PFS的Meta分析森林图
按HER2表达的不同进行亚组分析。结果显示,试验组HER2阳性患者[HR=0.75,95%CI(0.69,0.82),P<0.000 01]、HER2阴性患者的PFS[HR=0.76,95%CI(0.63,0.91),P=0.003]均显著长于对照组,详见表2。
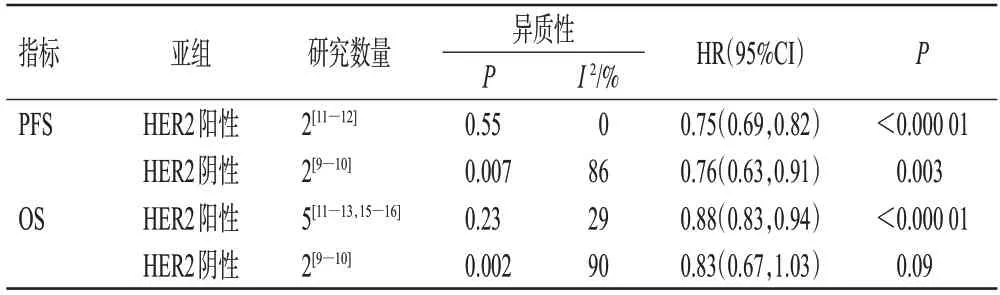
表2 两组患者PFS和OS的亚组分析结果
2.3.2 OS
7项研究报道了OS[9—13,15—16],各研究间有统计学异质性(P=0.005,I2=68%),采用随机效应模型。结果显示,试验组患者的OS显著长于对照组[HR=0.87,95%CI(0.81,0.93),P<0.000 1],详见图5。
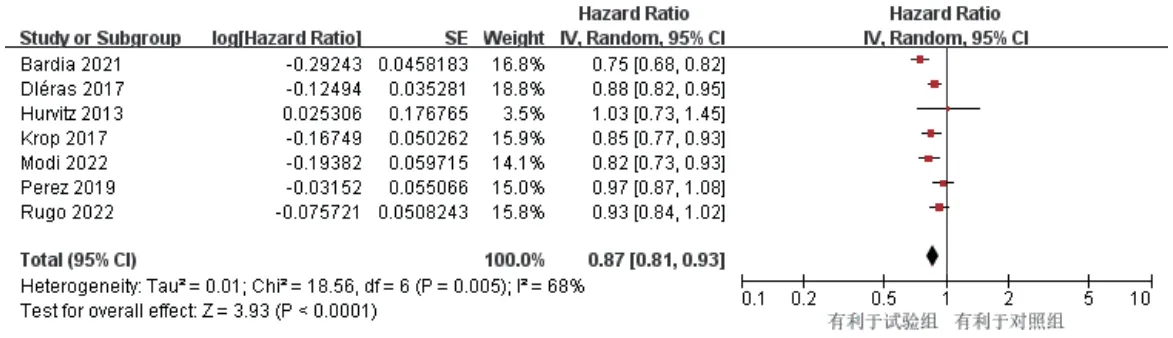
图5 OS的Meta分析森林图
按HER2表达的不同进行亚组分析。结果显示,试验组HER2阳性患者的OS[HR=0.88,95%CI(0.83,0.94),P<0.000 01]显著长于对照组;两组HER2阴性患者的OS[HR=0.83,95%CI(0.67,1.03),P=0.09]比较,差异无统计学意义,详见表2。
2.3.3 ORR
3项研究报道了ORR[9—11],各研究间有统计学异质性(P<0.000 01,I2=94%),采用随机效应模型。结果显示,两组患者的ORR比较,差异无统计学意义[OR=2.34,95%CI(0.59,9.33),P=0.23],详见图6。
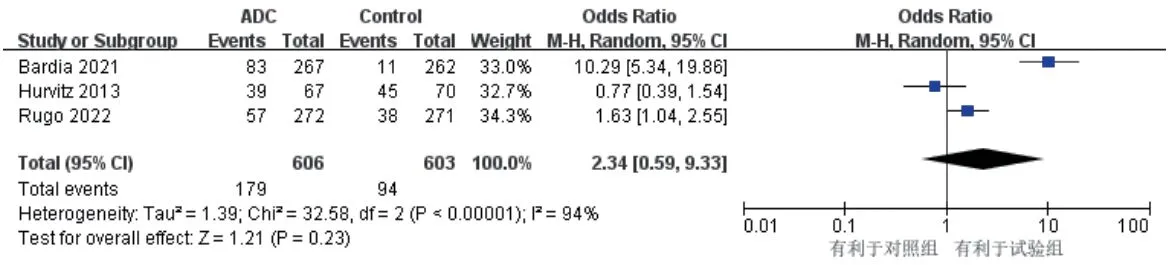
图6 ORR的Meta分析森林图
2.3.4 CBR
4项研究报道了CBR[9—12],各研究间有统计学异质性(P<0.000 01,I2=92%),采用随机效应模型。结果显示,试验组患者的CBR显著高于对照组[OR=2.70,95%CI(1.15,6.33),P=0.02],详见图7。

图7 CBR的Meta分析森林图
2.3.5 3/4级ADR发生率
试验组患者的贫血、天冬氨酸转氨酶升高发生率均显著高于对照组(P<0.05);两组患者的中性粒细胞减少、白细胞减少、腹泻、呕吐发生率比较,差异均无统计学意义(P>0.05)。结果见表3。

表3 两组患者3/4级ADR发生率的Meta分析结果
2.4 敏感性分析
以PFS、OS、ORR为指标,逐一剔除各项研究后,所得结果异质性改变较明显,但结果无统计学意义上的改变,表明上述结果稳健。以CBR为指标,逐一剔除各项研究后,所得结果差异无统计学意义,表明CBR的Meta分析结果易因研究数量变化而改变,缺乏稳健性,结果需谨慎对待。
3 讨论
T-DM1是我国第一个获批的ADC类药物,用于治疗HER2阳性乳腺癌患者。T-Dxd是T-DM1后的新一代ADC类药物,具有毒性低、复发率低、疗效好、安全性可靠等特点[17]。SG是由SN-38(伊立替康的活性代谢产物)通过可水解连接头与滋养层细胞表面抗原2(trophoblast cell surface antigen 2,Trop-2)偶联形成的[18],作为一种抗Trop-2的新型ADC类药物,SG为晚期TNBC患者带来了更多治疗选择。
EMILIA试验结果显示,与拉帕替尼联合卡培他滨相比,T-DM1能显著延长HER2阳性晚期乳腺癌患者的OS和PFS,同时也得到了更好的ORR和中位缓解持续时间(duration of overall response,DOR)[19]。另有研究表明,T-Dxd用于HER2低表达转移性乳腺癌患者的中位DOR和中位PFS分别为10.4、11.1个月[20]。此外,一项Ⅰ/Ⅱ期试验(IMMU-132-01)也证实,SG用于晚期TNBC的疗效显著[21]。本研究结果显示,与对照组比较,试验组患者的PFS、OS显著延长,CBR显著升高,这表明ADC类药物在治疗乳腺癌方面效果显著,能显著延长患者生存时间和改善预后,提示当乳腺癌患者使用其他化疗药物疗效欠佳时,可以根据情况选择ADC类药物。
本研究中,两组患者的ORR比较,差异无统计学意义,表明ADC类药物在减小肿瘤体积方面无显著优势,提示ADC类药物可能更适用于辅助治疗原发肿瘤体积较小的患者[22]。有文献报道,HER2阳性患者可在TDM1和T-Dxd治疗中获益[12—13],而HER2阴性患者使用SG获益更多[10]。本研究的亚组分析结果显示,试验组HER2阳性患者的PFS、OS均显著长于对照组;试验组HER2阴性患者的PFS显著长于对照组,但两组HER2阴性患者的OS比较,差异无统计学意义。由于纳入HER2阴性亚组的研究仅2篇,且这2篇文献都是SG的相关研究,因此,造成两组HER2阴性患者在OS指标上无显著性差异的原因可能是本研究纳入的SG相关研究和患者数量较少。
本研究结果还显示,试验组患者贫血发生率显著高于对照组。贫血的发生可能与ADC类药物所载药物相关,表现出与细胞毒化疗药物相似的骨髓抑制,从而造成血液系统不良反应[23]。T-DM1、T-Dxd和SG属于不同化学结构的ADC类药物,其载药量也不尽相同,因此其诱导产生的血液系统不良反应也有所区别,临床使用时应针对不同ADC类药物引起的血液系统不良反应选择不同的干预措施。此外,试验组患者天冬氨酸转氨酶升高发生率显著高于对照组,这与Zhang等[24]的研究结果一致。ADC类药物与严重的肝毒性密切相关,以TDM1为例,当其被肝脏分解代谢后,其中的微管蛋白抑制剂被释放到肝细胞中,从而破坏肝脏的微管网络,导致细胞有丝分裂和凋亡停止[25]。因此,使用ADC类药物时应注意潜在的肝毒性,密切监测患者的肝功能,如果患者肝功能出现异常,应尽快干预。敏感性分析结果显示,以PFS、OS、ORR为指标时,所得结果较稳健;以CBR为指标时,所得结果缺乏稳健性。
综上所述,ADC类药物用于乳腺癌的疗效显著,但会增加贫血和天冬氨酸转氨酶升高的发生风险。本研究的局限性为:(1)纳入的文献较少,无法进行发表偏倚分析;(2)纳入的部分研究缺少患者临床病理分期的相关信息;(3)纳入文献的异质性较大,可能与样本量较小、不同组间使用的对照药物不同有关。故本研究所得结论尚需大样本、高质量的RCT进一步验证。

