化脓性脊柱炎分型和诊疗的研究进展
胡宇坤,高书涛,盛伟斌,2,3,甫拉提·买买提,2,3*
1.新疆医科大学第一附属医院脊柱外科,乌鲁木齐 830054
2.新疆地区高发疾病研究教育部重点实验室(新疆医科大学 ),乌鲁木齐 830054
3.新疆骨科疾病临床医学研究中心,乌鲁木齐 830054
化脓性脊柱炎(PS)是包括椎间盘炎、椎体骨髓炎、硬膜外脓肿、化脓性小关节炎在内的一组疾病,如处理不及时易发生菌血症、神经功能损伤等严重后果。近年来,随着对PS 认识的不断加深,学界对PS 严重程度的分型逐渐完善,这对其规范化治疗有着重要意义,一些新的诊疗技术也为PS 的诊断和治疗提供了更多的选择。本文就PS 的分型和诊疗进展作如下综述,以期为临床医师选择最佳的治疗方案提供参考。
1 PS 的流行病学和病原学
PS 是一种脊柱非特异性感染,好发年龄为50 ~70 岁,男性较女性多见,男女比例为1.5 ~ 2∶1[1]。近年来,随着易感人群的增加及诊断手段的提高,其发生率也随之升高,约为6.5/100 000[2]。PS 的感染途径包括血源性播散、局部蔓延和脊柱手术中的直接播散[2-3]。在血源性播散引起的PS 中,腰椎占48% ~ 60%,胸椎占23% ~ 30%,颈椎占10% ~ 18%,原发病灶可以来自泌尿生殖系统、皮肤软组织、血管异物等[3]。PS的易感因素包括糖尿病、免疫抑制、人类免疫缺陷病毒(HIV)感染、需血液透析的肾功能衰竭及长期服用类固醇激素类药物等[1-2]。引起PS的常见病原菌中,金黄色葡萄球菌占55% ~ 80%[4];其次是革兰氏阴性菌占7% ~ 33%,如大肠杆菌、变形杆菌、克雷伯杆菌等,主要与消化系统或泌尿系统感染、糖尿病、免疫抑制及高龄有关[5];凝固酶阴性葡萄球菌占5% ~ 16%。脊柱术后PS近50%是由金黄色葡萄球菌和凝固酶阴性葡萄球菌引起[4];慢性PS患者多由低毒力细菌引起,如凝固酶阴性菌[3]。
2 PS的分型
2.1 Akbar 分型
Akbar 等[6]根据椎体和椎间盘受累程度、神经功能状态、椎体稳定性及有无硬膜外脓肿将PS 分为Ⅰ、Ⅱ、Ⅲ、Ⅳ共4 种类型,根据神经功能状态又将Ⅰ、Ⅲ型分为A、B 2 种亚型(表1)。
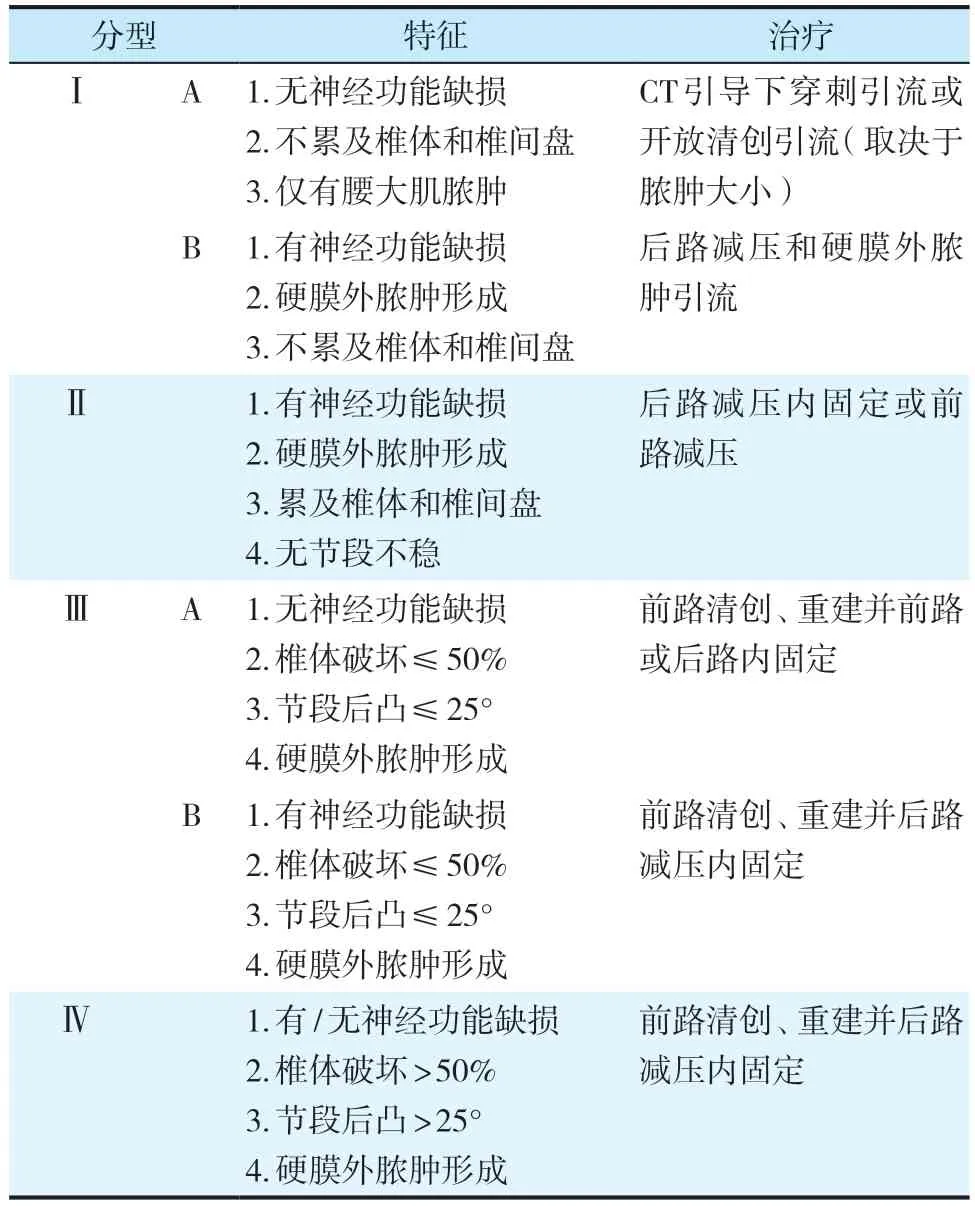
表1 Akbar 分型[6]
2.2 Pola 分型
Pola等[7]根据PS最重要的预测因素,神经功能状态、节段稳定性和硬膜外脓肿,将PS 分为3 种类型,再根据各个预测因素的受累程度细分为11个亚型(表2)。
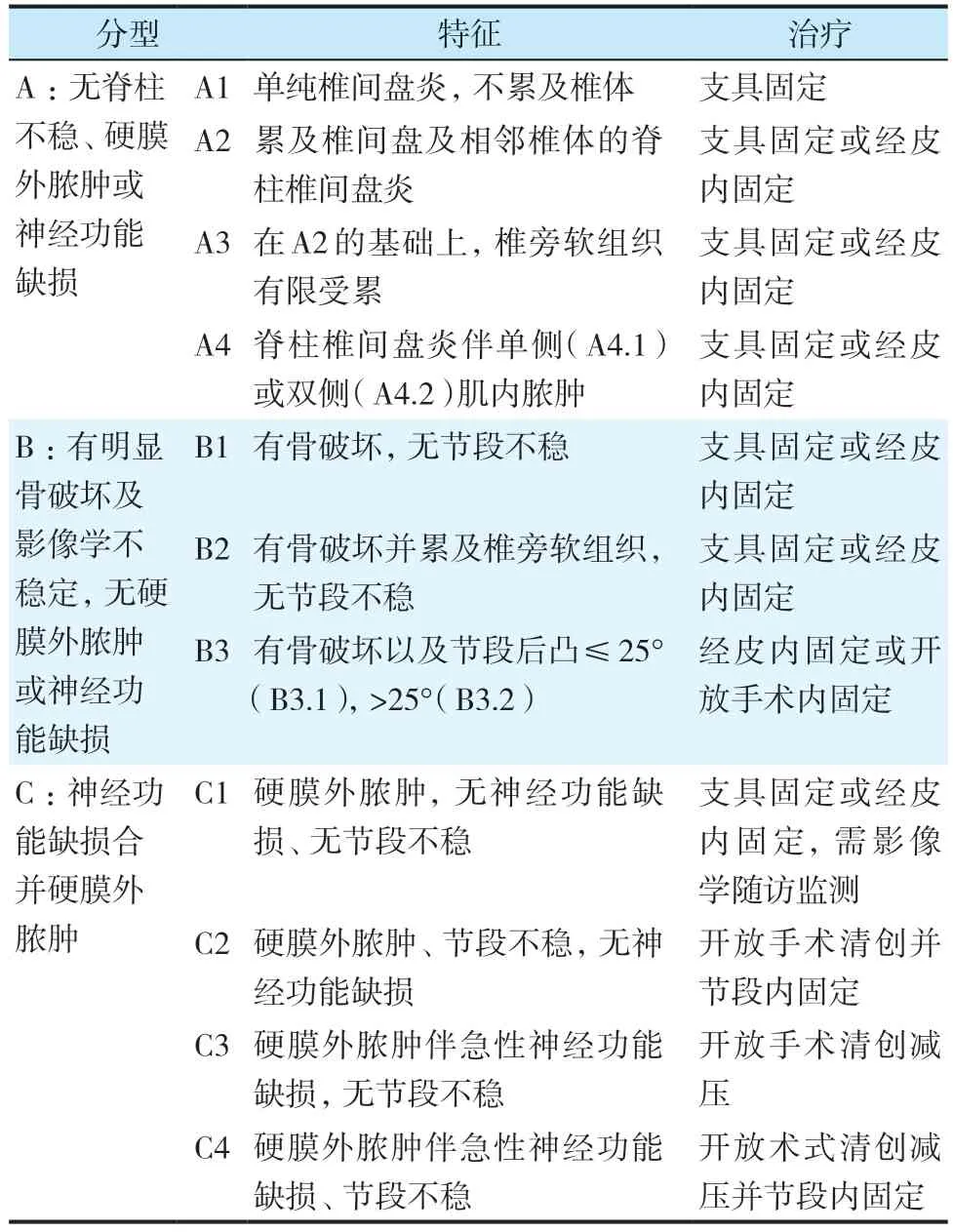
表2 Pola分型[7]
2.3 Homagk 分型
Homagk 等[8]根据神经功能状态、有无椎体破坏及椎体稳定性将胸腰椎PS 患者分为3 种类型,每种类型又根据是否累及椎旁组织分为A(不累及)、B(累及)2 个亚型(表3)。
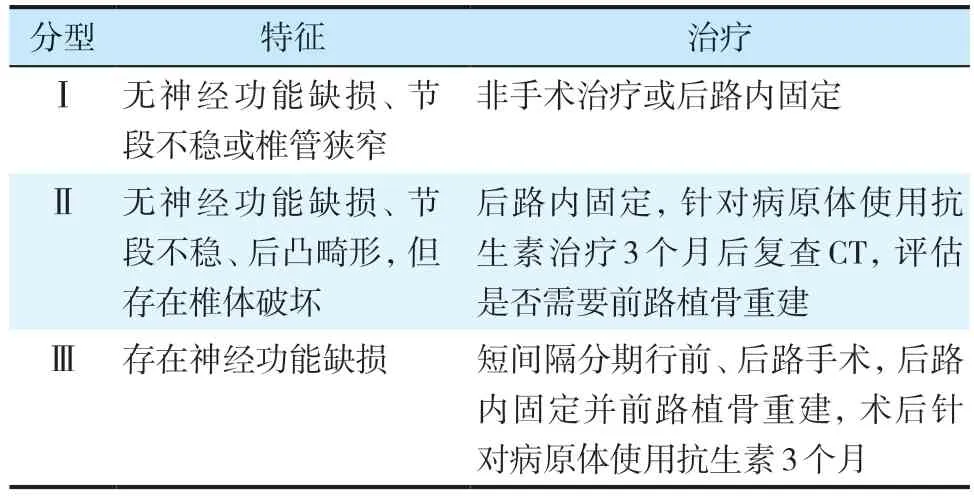
表3 Homagk分型[8]
之后,Homagk 等[9]对此分型进行了调整,将C反应蛋白(CRP)、疼痛数字评价量表(NRS)评分、MRI 形态学改变纳入分型,建立了脊柱炎诊断和治疗的SponDT评分系统(表4),根据该评分系统判定脊柱炎严重程度(SSC):< 3 分为轻度,≥3 分且<5 分为中度,≥5 分为重度。该评分系统可纳入临床路径进行动态评估,指导及调整治疗方案。
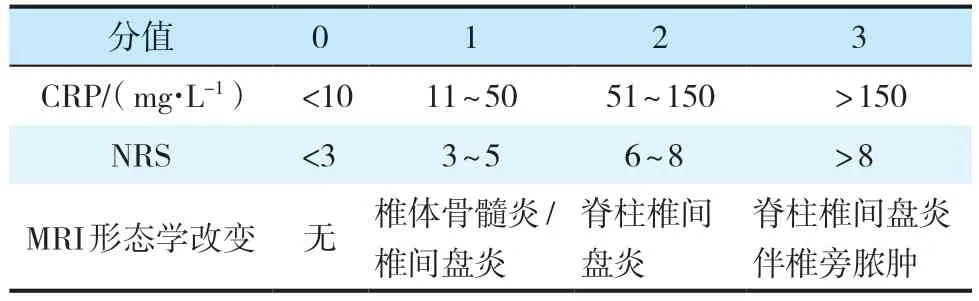
表4 SponDT 评分系统[9]
以上几种分型各有其优缺点。Akbar 和Pola 分型都是以MRI表现作为脊柱不稳的主要评估手段,但脊柱不稳通过立位X线片评估更为理想,且这2种分型都将后凸达到25°作为脊柱不稳的标准,但有研究[10]认为,后凸达到15°即为脊柱不稳。此外,3种分型均未将椎体前后移位作为脊柱不稳的判断标准[10-11]。Almansour 等[10]认为,应基于统计学证据来定义节段不稳的阈值,还要考虑病变节段的解剖位置,分别定义不稳的标准。Schömig 等[12]开发了一项脊柱炎节段不稳定评分系统,纳入了病变部位、椎体塌陷程度、骨破坏类型、椎旁受累程度及脊柱序列等因素,综合评估病变节段的稳定性。而Homagk 分型没有纳入脊柱不稳的标准,这也是其重要缺陷。但Homagk 提出的SponDT 评分系统既可用于脊柱炎的初步诊断,也可用于监测疾病的治疗进展,这是Akbar 和Pola 分型所不具备的优势[10,13]。Rigomonti 等[14]认为,发生于颈椎的硬膜外脓肿神经功能预后较差,而以上分型未将硬膜外脓肿的发生部位进行区分。疾病的预后还与免疫抑制、糖尿病、高龄等危险因素相关,但3 种分型均未将患者的合并症考虑在内[10]。Pola 分型的亚型较多,如A2、A3、A4、B1 和B2 亚型的治疗建议都是相同的,也许简化分型更容易理解和使用[11]。Camino-Willhuber 等[11]进行的一项多中心前瞻性研究显示,Pola 分型在评估者间和评估者内的一致性较高,可能成为PS 分型的重要工具。PS 分型为PS的量化治疗指明了方向,减少了不必要的手术,规范化治疗也缩短了抗生素的使用周期。综上,笔者认为PS 的分型在未来仍需进一步完善、简化,以提升其适用性和可重复性。
3 PS 的诊断与鉴别诊断
PS 的症状往往比较隐匿,病变部位疼痛是早期最常见的症状[3],夜间疼痛加剧应高度警惕PS;发热也是PS 的重要症状,约占48%;神经功能受损是另一主要症状,主要包括肢体麻木无力、感觉障碍、二便失禁、瘫痪,约占32%[15-16];其他的感染中毒症状包括疲劳、恶心、呕吐、食欲不振、体质量减轻、嗜睡、神志障碍等[17],严重者还可发展为脓毒症,出现脓毒症后死亡率升高17%[18]。Davis等[19]报道仅有13%的患者会出现疼痛、发热、神经功能缺陷经典三联征。由于PS的临床表现不具有特异性,早期症状不典型,一般从症状出现到确诊往往需要30 ~ 90 d,部分患者甚至需要诊断性治疗才可确诊[20]。
红细胞沉降率(ESR)是感染的敏感指标,95%以上的PS病例都会升高,平均值为85 mm/h,但缺乏特异度;ESR达到峰值大约需要2 ~ 4周,21 ~ 90 d可降至正常[21-23]。CRP 是评估PS 的另一敏感指标,灵敏度达100%,且特异度高于ESR。Jean等[24]指出,当患者出现脊柱疼痛合并CRP > 63 mg/L时应高度怀疑为PS。CRP在术后2 ~ 3 d达峰值,术后14 ~ 21 d降至正常,每周数值下降50%说明治疗有效,如在14 ~ 21 d时CRP 再次升高,则提示术后感染的可能性较大,因此,部分学者[3,21-23]建议将CRP 作为监测治疗效果的首选炎性指标。白细胞计数(WBC)在炎性指标中的价值最小,仅有不足50%的患者出现WBC升高[21]。有研究[25]表明,降钙素原(PCT)也是灵敏度较高的指标,在细菌感染后会从所有组织中释放出来。Radcliff等[26]认为,PCT作为术后切口感染的早期预测指标优于CRP。有专家共识[27]指出,健康成人PCT水平< 0.05 μg/L,当PCT≥0.25 μg/L时高度提示细菌感染可能,当PCT ≥0.5 μg/L 时有助于脓毒症的诊断;此外,PCT 水平还与感染严重程度相关,PCT 初始水平有助于评估预后,治疗期间PCT的下降速度对判断预后的价值更大。血培养是PS诊断的金标准,PS 的血培养阳性率为40% ~ 60%,发热患者的阳性率更高,尽可能在使用抗生素前进行血培养,对疑似PS 的患者至少做2 次血培养检测[28-29]。当血培养阴性时还可以考虑行聚合酶链反应(PCR)检测,尤其是种属特异性引物PCR 检测的阳性率更高[30],但PCR 检测不能反映病原菌对药物的敏感性。最近的研究[31]显示,组织病理学同样可以用于诊断,但是不能确定细菌种类及药敏结果。近年来,随着宏基因二代测序(mNGS)技术应用于脊柱感染领域,明显提高了病原体的检出率,尤其是对传统细菌培养技术无法培养或难以培养的病原体,以及罕见和不典型病原体的检出,表现出良好的诊断性能,且灵敏度及特异度较高,分别为91.43%和90.91%,但在耐药性方面mNGS可提供的信息不及传统的微生物培养[32]。
影像学方面,X 线片对PS 的灵敏度和特异度均较低,前2 周的急性感染期内X 线片通常无异常改变,随着疾病的发展,2 ~ 8 周可出现椎间隙变窄、终板破坏及软组织肿胀等征象。CT 可显示椎体破坏和增生程度,在辨别PS 和布鲁杆菌脊柱炎方面具有独特优势:PS 椎体破坏相对严重,骨硬化和骨增生较为少见;布鲁杆菌脊柱炎椎体破坏相对较轻,椎体呈扇形硬化,椎体前缘增生形成典型的“鹦鹉喙”征象[4,33]。另一方面,CT对引导经皮穿刺活检、脓肿引流及术前确定清创坏死组织范围也非常重要[4,33]。MRI 是诊断PS的金标准[3],其灵敏度和特异度均较高,PS 在MRI 上早期表现为椎体内骨髓水肿,T1 序列呈低信号,T2 和STIR 序列呈高信号,在增强MRI上T2 序列呈高信号,T1 序列呈中等或不均匀的组织强化;感染的椎间盘在T2 序列呈典型高信号,核内裂隙的低信号消失,椎间盘高度下降,终板破坏在T1 和T2 序列表现为皮质骨的低信号线变薄或缺失[34-35];如有脓肿,在T1序列表现为信号不均伴环形壁层增厚,T2序列呈高信号、边缘强化、脓肿聚集[4,35]。此外,MRI对鉴别PS和脊柱结核也有重要意义,结核病灶通常累及椎体后方,椎间盘往往不受累或迟发受累,软组织受累更严重,会出现不连续脊柱节段受累和跳跃性损伤[35]。部分PS在MRI上表现也不典型,18氟-脱氧葡萄糖正电子发射计算机体层摄影(18F-FDG PET-CT)能够辅助诊断,同时还可以鉴别感染和肿瘤,其缺点是费用较昂贵[36]。
开放手术活检是组织取样的金标准,阳性率高于穿刺活检,然而开放手术活检具有操作时间长、侵入性高、成本高、住院时间长等缺点。因此,美国感染病协会(IDSA)推荐CT引导下穿刺活检[37],Rehm等[38]对214例脊柱疑似感染和肿瘤性病变的患者进行CT引导下穿刺活检,结果显示,组织病理学在确定良性、炎性或恶性肿瘤方面的准确率超过94%。Zimmerli等[2]报道的穿刺活检阳性率为40% ~ 80%,而Sertic等[39]的报道显示,CT穿刺活检的阳性率约为33%,出现较大差异可能与使用抗生素及穿刺样本量不足有关。Kim等[40]回顾性分析了136例行穿刺活检的PS患者,椎体穿刺阳性率为39.7%,而椎旁软组织穿刺阳性率为63.5%,其中椎旁脓肿、较高的CRP和ESR水平等因素与高阳性率相关。值得注意的是,如果怀疑脊柱结核或布鲁杆菌脊柱炎时,因该类病原体易从骨组织获得,需行椎体穿刺。
PS、脊柱结核和布鲁杆菌脊柱炎是脊柱感染的3种常见疾病,且临床表现相似,疾病之间的鉴别对指导治疗极为关键。PS好发于腰椎,其次为胸椎和颈椎,患者以高热和局部剧痛为主要临床表现,在发病前往往会有前驱感染史,如感染性心内膜炎及皮肤、泌尿系统感染等。而脊柱结核好发于胸椎,其次为腰椎和颈椎,且多发于青壮年,40岁及以下患者明显多于40岁以上患者[1,41]。发热在结核患者中少见或仅表现为低热,发热时往往伴有盗汗,其疼痛程度明显轻于PS,一般合并陈旧性肺结核、肺外结核或活动性肺结核[42]。因结核分枝杆菌缺乏蛋白水解酶,椎间盘往往不受累或迟发受累,这与PS早期即有椎间盘破坏不同[35],此外,脊柱结核患者结核T细胞斑点试验(T-Spot)多为阳性,PS一般为阴性。布鲁杆菌脊柱炎好发部位与PS相同,两者的好发年龄、临床表现也较为相似[43],但该病70%的患者有牛羊接触史,热型多为波浪热,布鲁杆菌平板凝集试验(PAT)及虎红平板凝集试验(RBPT)亦可帮助鉴别[42]。
4 PS的治疗
多数PS 患者可通过非手术治疗治愈,包括抗感染、支具固定、制动及营养支持。抗感染治疗是非手术治疗的关键,对于无神经功能损伤及血流动力学稳定的患者,在取得血培养标本后即可开始抗生素治疗。对于存在神经功能缺陷、脓毒症及血流动力学不稳定的患者,应立即经验性使用广谱抗生素治疗[28,44-45]。抗生素的使用时长、给药途径目前尚无共识,Bernard 等[46]对比了抗感染治疗6 周与12 周的患者,其感染复发风险无明显差异。IDSA 指南[37]认为,大多数PS患者只需6周抗生素治疗,口服生物利用度高的抗生素可以替代静脉给药。Lang等[3]认为,早期静脉使用抗生素比口服抗生素在感染控制和血药浓度方面更有优势,疗程应至少14 d。Grados 等[47]的研究表明,接受12 周抗生素治疗的患者复发风险较低,应根据患者情况静脉应用抗生素2 ~ 4 周,直至CRP 恢复正常,然后改为口服生物利用度较高的抗生素,总疗程达12周。如致病菌为耐甲氧西林金黄色葡萄球菌(MRSA)、脓毒症或广泛感染的患者,应进行12周或更久的抗生素治疗[48]。抗感染治疗的同时行支具固定可保持脊柱的稳定性,通常需要固定3 ~ 4 个月[49]。笔者认为,全身情况差、合并症较多的患者可选择非手术治疗,推荐静脉给药2 ~ 4 周,然后改为口服生物利用度较高的抗生素,总疗程达12 周,可根据炎性指标及临床症状的缓解情况适当调整抗生素使用时长。
有研究[37,50]表明,进行规范的抗感染治疗后仍有40% ~ 50%的患者须接受手术治疗。手术治疗的目的是在规范抗感染的基础上彻底清除病灶、缓解疼痛、恢复脊柱节段稳定性及椎管容积、解除神经压迫。手术治疗的适应证:顽固性疼痛、非手术治疗无效、硬膜外脓肿或巨大椎旁脓肿、神经功能缺陷、严重骨质破坏及脊柱失稳,其中脊柱失稳指节段后凸> 15°、椎体塌陷> 50%及移位> 5 mm[51-53]。对于基础疾病多、手术风险高或经非手术治疗后临床症状和炎性指标均有所好转,4 ~ 6周后复查影像学显示骨破坏加重的患者,不建议手术治疗[37,54]。手术时机的选择也尚存争议,Segreto等[50]对34 500例患者进行回顾性研究,结果显示,入院后24 h 内接受手术治疗的患者,其预后优于延迟手术的患者,早期手术干预能够减少并发症、缓解疼痛、减少脊柱畸形和功能障碍。Canouï 等[55]对比研究了PS 急性期行手术和非手术治疗的2 组患者,其神经功能改善程度及感染复发率无明显差异,但手术组疼痛缓解更明显。手术入路包括前路、后路和前后联合入路,目前尚无随机对照试验证实哪种术式更为优越[37]。前路手术可直视病灶,进行彻底清创和植骨重建,如病灶相邻椎体骨破坏不严重,可进行前路原位固定,但稳定性不如后路手术。后路手术不仅可以矫正畸形、实现坚固内固定,同时也可以清创、引流、重建脊柱稳定性,但通常无法直达病灶,植骨重建也较为困难[56]。当骨破坏严重、感染累及后方结构及椎旁肌肉时,建议行前后联合入路手术[57]。因此,笔者认为应该根据病变部位和术者习惯及经验选择合适的手术入路。近年来,微创手术迅速发展,在PS 的治疗中也取得了良好效果。Xu 等[58]回顾性分析23 例多节段PS 患者,行CT 引导下清创冲洗引流术,除1 例疗效为良,其余患者疗效均为优,术后症状均得到缓解,内固定得以保留,感染得到控制。但该术式不适用于神经功能受损和脊柱畸形的患者。Turel 等[59]的研究纳入7 例采用微创手术治疗的患者,术后疼痛和神经功能明显改善,微创与传统开放手术相比可减少出血量和并发症,缩短住院时间和恢复时间,同时达到彻底清创的目的。Yang 等[60]的研究纳入32 例采用经皮内窥镜下清创引流术(PEDI)治疗的患者,其中26 例术后疼痛和神经功能改善效果满意,作者认为PEDI 可作为单节段感染或合并硬膜外脓肿及椎旁脓肿患者的治疗选择,但该术式对椎体破坏严重和多节段感染的患者效果有限。笔者认为,微创手术可作为开放手术的替代方案,尤其是对合并症较多、全身情况较差的患者,是一种较好的选择。清创后常规行植骨重建,恢复脊柱序列稳定性。植骨材料一般选择自体骨(带三面皮质的髂骨、腓骨或肋骨)、异体骨、钛网或聚醚醚酮融合器。自体骨可避免传染病、排异等风险,同时具有更高的融合率,被认为是植骨的金标准。以往对异体骨作为融合材料争议较大,有研究[61-62]发现,异体骨与自体骨、钛网具有相似的感染复发率和临床结局,但钛网的后凸畸形矫正效果优于异体骨。Schomacher 等[63]对比了聚醚醚酮融合器与钛网用于PS 手术,两者表现出相似的临床疗效。Shiban 等[64]对52 例使用聚醚醚酮融合器进行重建的PS 患者术后随访12 个月,疼痛和神经功能障碍均缓解,达到骨性融合,无感染复发,作者认为使用聚醚醚酮融合器进行椎间融合是可行和安全的。
综上所述,随着人口老龄化,PS的发生率也呈日益增长的趋势。现今治疗水平的不断提高,使PS的治愈率得以提升。但目前早期诊断仍然是一个棘手的问题,这也是影响疾病预后的重要因素。CT引导下穿刺活检、细菌培养是明确诊断的有效方法,mNGS技术的应用大大提高了诊断效率。目前,PS的分型及治疗建议尚未达成共识,临床医师须综合现有的分型系统对患者进行评估,制订最佳的治疗方案。手术适应证包括神经功能缺陷、严重骨质破坏、脊柱失稳、后凸畸形及非手术治疗无效的患者,应根据患者病情、病变部位、感染范围选择合理的手术方式,进行彻底清创、植骨重建,结合规范的抗感染治疗是PS治疗成功的关键,也是目前已达成的共识。

