盐碱胁迫下燕麦叶片代谢组差异分析
李俊伟,刘景辉,赵宝平,米俊珍,王俊英,郭来春,王春龙,任长忠
(1.全国农业科研杰出人才及其创新团队 / 内蒙古高校燕麦工程研究中心 / 内蒙古农业大学杂粮产业协同创新中心, 内蒙古 呼和浩特010019;2.吉林省白城市农业科学院, 吉林 白城 137000;3.中国农业科学院生物技术研究所, 北京 100081)
盐胁迫和碱胁迫是两类不同的非生物胁迫形式,两类逆境对植物生理代谢机制的影响也明显不同[1-2],目前,有关植物的耐盐机制研究较多,而耐碱机制的研究相对较少。植物在盐胁迫下受到离子胁迫和渗透胁迫,导致其生理代谢紊乱,引起光合作用受到抑制、呼吸作用改变、蛋白合成受到抑制以及有毒代谢物明显积累等[3-4],同时植物也能通过自身的代谢调节适应环境。在叶片中的糖类、脂类、氨基酸类代谢响应盐胁迫而显著变化,各类代谢参与盐胁迫下细胞的离子运输、代谢调节、渗透调节、活性氧清除等生理代谢活动,以此缓解盐胁迫对细胞的生理伤害[5-6]。虽然一些盐胁迫的作用机制及植物对盐的响应机制相对明确,但这些结果能够为碱胁迫研究提供的参考比较有限。近年来,有关植物适应碱逆境的研究逐渐受到人们的重视,但碱胁迫的研究进展依然缓慢。石德成等[7]研究表明,缓冲量和盐度是碱胁迫影响向日葵(Helianthus annuus)生理指标的决定性因素;杨春武等[8]研究表明,小冰麦(Triticum aestivum-Agropyron intermedium)在碱胁迫下通过增加有机酸维持植株阴阳离子平衡。麻莹等[9]通过比较盐胁迫与碱胁迫的生理指标差异发现,植物在碱胁迫下特异性积累柠檬酸。然而,有机酸对碱胁迫的响应机制目前尚不清楚。
有机酸类代谢是生物体中广泛参与细胞的多个重要生理代谢过程的代谢物。已有报道表明,有机酸参与了植物适应干旱[10]、铝胁迫[11]、缺铁[12]、缺磷[13]等逆境过程,积累有机酸也被认为是植物在逆境中的一种被动调节方式。在碱胁迫条件下,不同植物积累的有机酸成分存在差异,例如碱地肤(Kochia scoparia)主要积累草酸[14],虎尾草(Chloris virgata)和星星草(Puccinellia tenuiflora)主要有机酸是柠檬酸[15]、甜菜(Beta vulgaris)则主要积累富马酸[16]。此外,高粱(Sorghum bicolor)在不同浓度碱胁迫下其有机酸含量变化不明显,高浓度的盐胁迫也能引起有机酸积累[17-18]。因此,有机酸参与植物生理调节的机制与植物种类、胁迫类型和胁迫强度等因素有关,不同环境条件下的植物有机酸响应模式并不一致。
燕麦(Avena sativa)是中国北方地区农牧交错带的特色粮农作物和优质牧草[19],具有较强的耐盐碱特性[20],被列为生物改良盐碱地的优势作物之一[21]。燕麦的耐逆性研究主要集中于盐胁迫和干旱胁迫方面[22],这些研究为研究燕麦响应逆境提供了参考。由于碱胁迫的影响机制相对复杂,目前仅对碱胁迫下的燕麦种质资源[23]、栽培生理[24-25]、外源物质调控逆境[26]、蛋白调控[10]等开展了少量研究,燕麦适应碱胁迫的机制还有待挖掘。本研究比较了盐胁迫和碱胁迫下燕麦叶片差异代谢以及主要代谢网络通路,并剖析了盐胁迫和碱胁迫条件下燕麦叶片有机酸在三羧酸循环(tricarboxylic acid cycle, TCA)中的代谢途径,旨在明确盐、碱条件对燕麦叶片代谢组分的影响,为分析燕麦耐盐和耐碱机制的差异提供参考。
1 材料与方法
1.1 试验材料
供试燕麦品种为‘白燕2 号’(BY2),材料由吉林省白城市农业科学院燕麦所提供。
1.2 盐碱胁迫处理
试验分别设置盐胁迫组(SS)、碱胁迫组(SA)和对照组(CK)。参照刘杰[27]方法配制盐、碱溶液,将两种中性盐NaCl、Na2SO4及两种碱性盐Na2CO3、NaHCO3均按摩尔比5 ꞉ 1 混合,以1/2 Hogland 营养液为溶剂,分别配制盐、碱溶液,溶液浓度均设为150 mmol·L-1,CK 组的处理溶液为1/2 Hoagland 营养液。SS 组、SA 组和CK 组的溶液pH 分别为7.17、9.26 和7.35。
试验于2021 年在吉林省白城市农业科学院温室进行。燕麦播种于直径为22 cm、高为18 cm 的塑料盆中,采用沙培法种植,每盆播30 粒,出苗后每盆定苗20 株,试验设置3 次重复。生长初期每2 d上午09:00 至10:00 浇1/2 Hoagland 营养液300 mL。植株生长至三叶一心期开始胁迫处理,每次施加300 mL 处理液,处理方法参考BAI 等[28]的方法,每隔2 d 施加一次,胁迫浓度按终浓度的1/4 梯度逐渐增加,达到目标浓度后按照目标浓度继续处理,胁迫结束2 d 后取样,胁迫处理共持续21 d,每盆中随机取5 株燕麦测定叶片含水率和电导率。
1.3 生物量和生理指标测定方法
生物量测定:随机取5 株鲜样,用分析天平称重,重量记为M。
含水率测定:取鲜叶片测定含水率,鲜叶片重记为m1,105 ℃杀青30 min,之后80 ℃烘干,称重,记为m2。计算含水率:含水率 = (m1-m2)/m1× 100%。
电导率测定方法参照《植物生理学试验指导》[29]。
1.4 代谢物检测
取各处理的燕麦叶片,用液氮快速冷冻保存。参照邹琦[29]的试验方法,采用质谱联机方法(GCMS)检测燕麦叶片代谢组,该工作委托杭州联川生物科技公司完成,试验设置6 次生物学重复。
取1 g 各处理的新鲜样品,参照郭家鑫等[30]方法,采用质谱方法定量检测草酰乙酸、柠檬酸、琥珀酸、延胡索酸、苹果酸、乌头酸等含量,该工作委托迪信泰科技有限公司完成,设置3 次生物学重复。
1.5 数据分析
用 Excel 2017 整理数据,采用SPSS 23 绘制图表,采用独立样本T检验法分析不同处理之间数据的差异显著性;差异代谢的富集分析利用在线分析平台完成(https://www.metaboanalyst.ca/MetaboAnalyst/ho me.xhtml),使用数据库为HMDB 和KEGG 数据库。
2 结果分析
2.1 盐、碱胁迫对地上部鲜重及生理指标的影响
不同处理对燕麦地上部鲜重及生理指标的影响如图1 所示,盐、碱胁迫均显著降低燕麦地上部鲜重(P< 0.05),分别较CK 降低33.24%和47.51%(图1)。盐、碱胁迫下的燕麦叶片含水量较CK 分别显著降低了14.92%和34.61%,电导率较CK 分别显著增加了31.46%和74.17%,说明盐、碱胁迫显著影响燕麦叶片含水率和叶片电导率,且碱胁迫对燕麦叶片的影响明显大于盐胁迫。
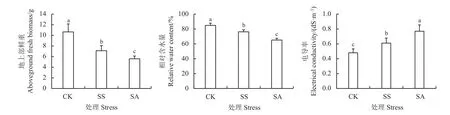
图1 盐、碱胁迫对燕麦地上部鲜重及叶片生理指标的影响Figure 1 Effect of salt and alkali stress on oat aboveground fresh biomass and leaf physiological indexes
2.2 PCA 分析
如图2 所示,代谢组学数据主成分分析的前2 个主成分在正离子模式和负离子模式下分别反映了76.34%和76.85%的差异(图2),全部样本均分布在 95%置信区间,说明此次样品可靠,而且不同处理的样品分别聚为不同簇,这说明CK 组、SS 组、SA 组之间的代谢物有明显差异。
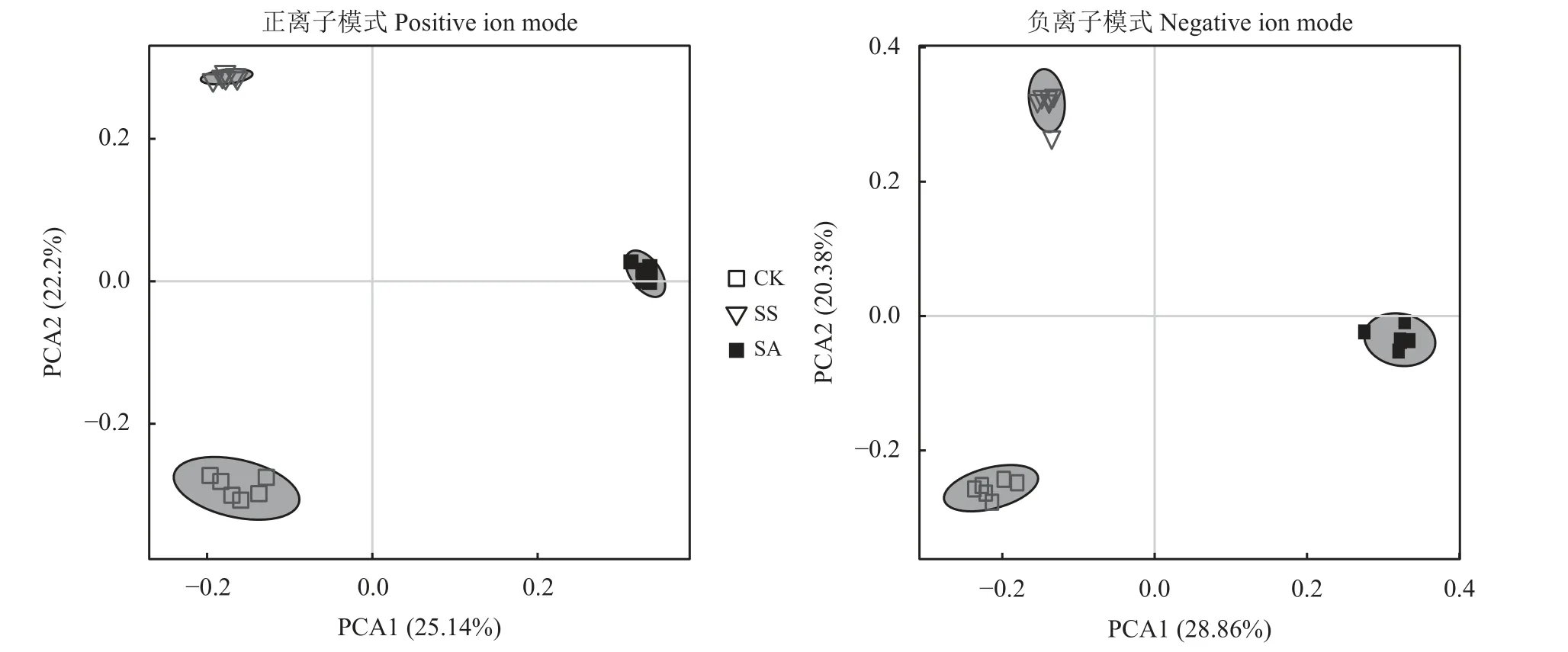
图2 盐碱胁迫下主成分分析Figure 2 Principal component analysis (PCA) under salt and alkali stress
2.3 盐碱胁迫下差异代谢物筛选
由图3 可知,盐胁迫下共检测到5 161 种代谢物,其中4 417 种代谢物无变化,290 种代谢物显著上调,454 种代谢物显著下调(图3a);碱胁迫下检测到6 169 种代谢物,5 492 种代谢物无变化,265 种代谢物上调,412 种代谢物下调(图3b)。
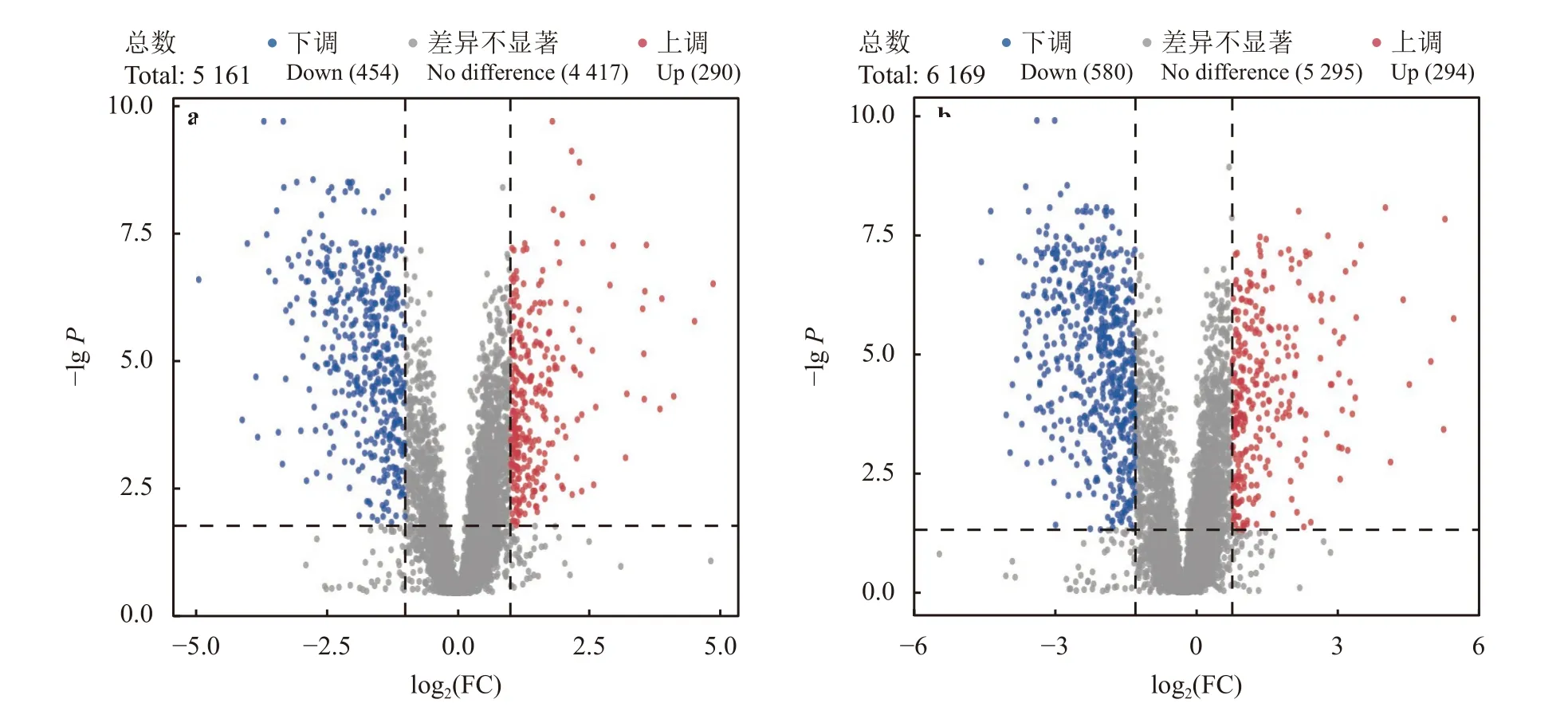
图3 盐碱胁迫下的差异代谢物火山图Figure 3 Volcano plot for SS vs CK group and SA vs CK group
2.4 盐、碱胁迫下差异代谢物分析
从代谢数据库中比对所有显著差异代谢物(DAMs),检索代谢物名称,后续研究均在此基础上分析。盐胁迫差异代谢物变化如图4 所示,盐胁迫下共匹配到57 种差异代谢物,其中45 种代谢物下调表达,12 种代谢物上调表达;碱胁迫差异代谢物变化如图5 所示,碱胁迫下共匹配到103 种差异代谢物,其中有45 种代谢物下调表达,58 种代谢物上调表达。碱胁迫条件下的差异代谢物多于盐胁迫。

图4 盐胁迫下燕麦叶片的差异代谢物热聚类分析Figure 4 Thermal cluster analysis of differentially accumulated metabolites in oat leaves under salt stress
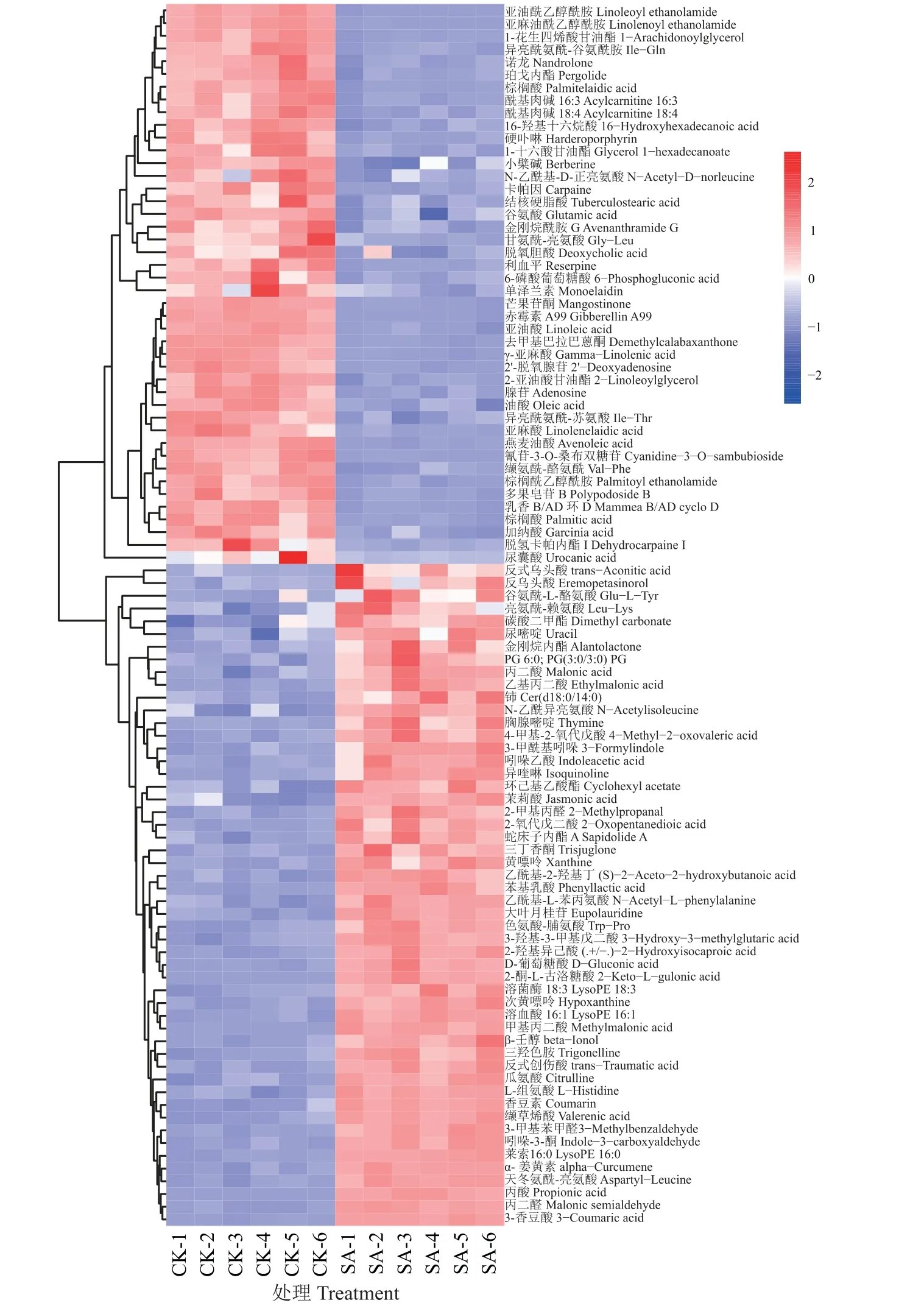
图5 碱胁迫下燕麦叶片的差异代谢物热聚类分析Figure 5 Thermal cluster analysis of differentially accumulated metabolites in oat leaves under alkali stress
对DAMs 进行分类,如图6 所示。盐胁迫条件下(SS vs CK),燕麦叶片中的DAMs 主要是脂类代谢物(12),此外,还包括苯丙烷类和聚酮类物质(6)、有机杂环化合物(4)、有机酸类(2)、有机氧化合物(2)等的代谢物,这些DAMs 均以下调为主;碱胁迫(SA vs CK)下的DAMs 以脂质类物质(35)、有机酸类物质(27)、有机杂环化合物(18)为主,其中有机酸、甘油磷脂、苯甲酸类物质、丙烯醇脂质、有机氧化合物和鞘脂类物质以上调为主,其他DAMs 均以下调为主;盐胁迫与碱胁迫之间(SS vs SA)是其中的主要差异代谢物。碱胁迫下,有18 种有机酸含量增加,9 种有机酸含量降低;相较于盐胁迫(SS vs CK),燕麦叶片在碱胁迫下有25 种有机酸含量增加,19 种有机酸含量降低。
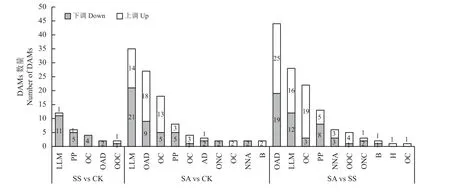
图6 盐、碱胁迫条件下的差异代谢物分析Figure 6 Analysis of differentially accumulated metabolites under salt or alkali treatment
对盐、碱胁迫下的DAMs 进行代谢富集分析。盐胁迫条件下的DAMs 主要富集在脂肪酸代谢、环状醇代谢、苯丙烷类和聚酮烷类代谢、羰基化合物代谢、芳香族杂多环化合物代谢、有机二羧酸代谢等途径中(图7a)。碱胁迫条件下的DAMs 主要富集在氨基酸和多肽、脂肪酸、有机二元羧酸、嘌呤、核苷酸、单糖、异喹啉、TCA 循环、生物碱、肉桂酸、芳香化合物等代谢途径中(图7b)。碱、盐胁迫之间(SA vs SS)的差异代谢物主要富集在氨基酸和多肽、脂肪酸和共轭物、有机二元羧酸、核苷酸、单糖、异喹啉、TCA 循环、羰基化合物、咪唑类、酮酸、生物碱、醛、肉桂酸、芳香化合物、吲哚和羧酸等代谢途径中(图7c)。在有机酸相关的代谢通路中,TCA 循环、有机二元羧酸和肉桂酸代谢途径是SA vs CK 和SA vs SS 条件下的共同差异代谢路径。
2.5 盐、碱胁迫条件下的有机酸类代谢比较
TCA 循环中的有机酸在碱胁迫下显著积累。因此,对盐、碱胁迫下燕麦叶片的柠檬酸、乌头酸、异柠檬酸、α-酮戊二酸、琥珀酸、延胡索酸、苹果酸和草酰乙酸等TCA 循环有机酸进行定量检测,各组分含量如图8 所示,盐胁迫下,燕麦叶片中的各有机酸含量变化不显著。碱胁迫条件下,燕麦叶片中的柠檬酸、乌头酸、琥珀酸和草酰乙酸含量显著升高,其中,乌头酸含量最高(148.11 μg·g-1),分别高于CK 和盐胁迫26.14 和37.15 μg·g-1;柠檬酸、琥珀酸和草酰乙酸在碱胁迫下显著高于对照和盐胁迫。
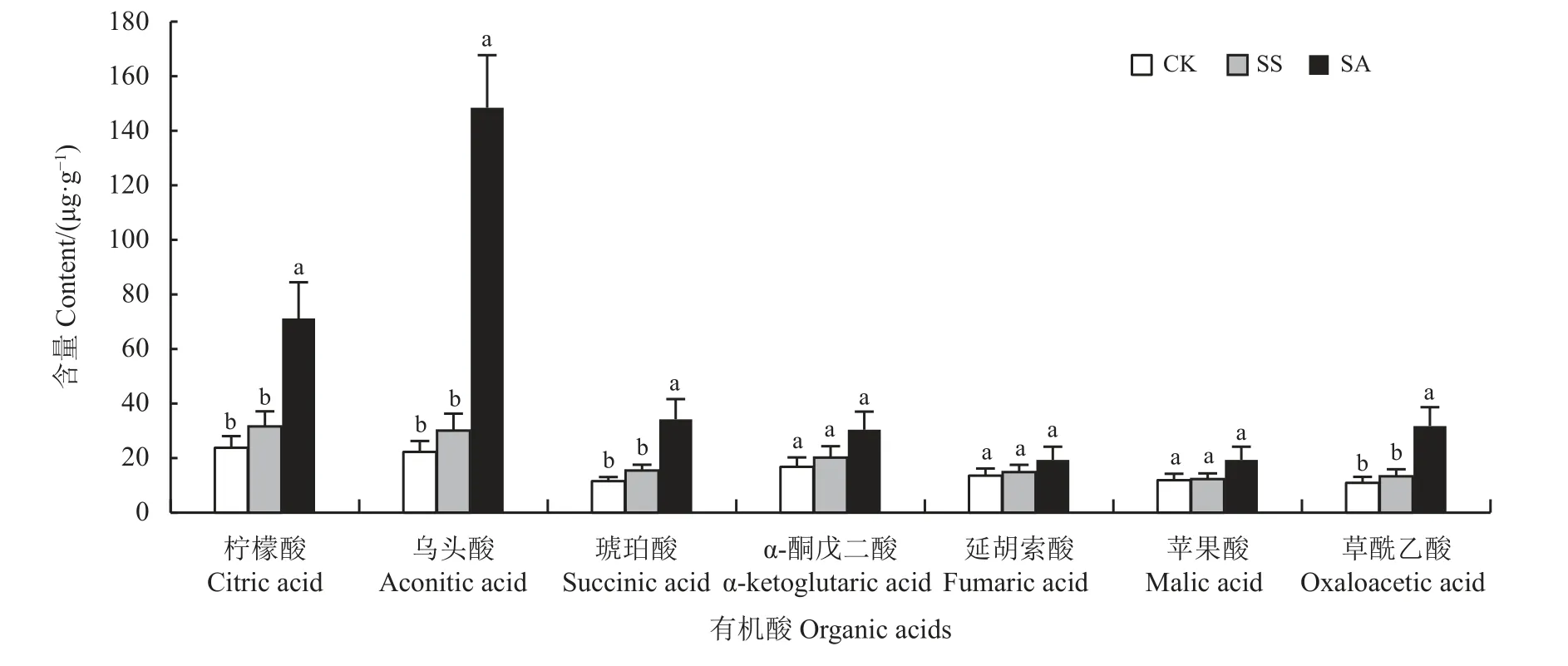
图8 盐、碱胁迫对TCA 循环相关有机酸含量的影响Figure 8 Effect of salt and alkali stress on the organic acid content related to the TCA cycle
3 讨论
植物生长表型受抑制是盐、碱对植物影响的直观体现[31],本研究发现盐碱胁迫均显著抑制燕麦叶片生长,其中碱胁迫对叶片生长的影响显著大于盐胁迫,原因可能是碱胁迫在盐胁迫的基础上增加了高pH 胁迫,导致碱胁迫对燕麦生长的影响更严重[32]。叶片是植物进行光合作用与能量代谢的重要器官,在盐、碱胁迫处理过程中,发现盐胁迫下燕麦叶片生长缓慢,但叶片能够维持绿色,碱胁迫则引起燕麦叶片快速变黄甚至枯萎。
盐胁迫对植物的脂肪酸代谢产生明显影响。脂质不仅是代谢物质中的能源物质,也是细胞结构组分,在细胞中具有维持膜完整性、提供能量、维持氧化还原平衡、储存能量等功能[33-34]。盐胁迫会导致植物细胞膜脂的双层结构、通透性和稳定性发生变化,影响细胞生理功能[35];栗露露等[36]发现水稻(Oryza sativa)通过调控油菜素合成、甾醇转化、三萜类合成等脂类代谢途径适应盐胁迫。此外,为了维持膜的完整性和细胞代谢正常运作,植物通过抗氧化脂质代谢调节方式以及脂类物质转化调节作用响应盐胁迫[37],例如,王佳敏[38]发现植物可通过调节膜脂酰基组成和脂肪酸的酸价等响应盐胁迫,并通过调节不饱和脂肪酸含量、调节脂肪酸链长和酸度,以及产生大量磷脂物质等保护膜结构;此外,拟南芥(Arabidopsis thaliana)通过脂类物质磷脂酰肌醇调节能量代谢和Na+/H+逆向转运蛋白活性,维持离子稳态[39]。本研究发现脂类代谢物是燕麦叶片响应盐胁迫的主要差异代谢物,代谢物变化以降低为主,因此脂类代谢物下降可能是燕麦叶片适应盐胁迫的一种调控方式,脂类代谢物在盐胁迫下含量减少这一现象与已有研究结果一致[40]。
盐胁迫对燕麦叶片的脂类代谢影响明显,而碱胁迫对有机酸代谢影响明显。有机酸能够维持细胞内酸碱平衡,并通过诸如根部分泌等机制,减轻碱胁迫的影响[41-42],此外,植物也可以通过调节鞘氨醇代谢、产生组胺来增强其对碱胁迫的耐受力[43];碱胁迫下,从燕麦叶片中检测到乌头酸、柠檬酸和琥珀酸等有机酸明显积累,这些有机酸被定位到TCA循环。TCA 循环是细胞能量代谢的主要途径之一,TCA 循环相关的代谢物均属于多元有机酸,在碱胁迫下,该途径代谢产物明显富集,说明有机酸或者能量代谢调节参与了植物的碱胁迫响应。且有推测认为,碱胁迫下,有机酸参与调节植物细胞的阴阳离子平衡、调节pH 和调节渗透势[18,44]等过程。
盐胁迫与碱胁迫之间存在多方面差异。在成分构成方面,中性盐环境的盐分以NaCl 和Na2SO3为主,碱性盐环境的盐分以NaHCO3和Na2CO3为主。在中性盐环境中,植物受到渗透胁迫、离子毒害以及营养胁迫;在碱胁迫下植物不仅受到盐胁迫的影响,也受到高pH 胁迫以及盐分与pH 互作的影响,这导致碱胁迫对植物生长的影响明显大于盐胁迫[45],比较盐胁迫和碱胁迫对植物体生长影响发现,适度盐胁迫不仅不抑制植物生长,反而刺激其生长,但是碱胁迫条件下并没有观测到该现象[46]。比较盐胁迫与碱胁迫的离子调控机制发现,虽然燕麦在两类胁迫下均选择性吸收金属阳离子,但在碱胁迫下植物体通过积累有机阴离子来调节细胞内的阴阳离子平衡,盐胁迫条件下则不积累有机酸,主要通过积累的Cl-发挥作用[24,47];本研究发现,燕麦叶片在盐胁迫、碱胁迫条件下的主要差异代谢均是脂类代谢物,然而,盐胁迫与碱胁迫之间(SA vs SS)的差异代谢物主要是有机酸类代谢物,这与已有的生理检测结果一致[30,32],这意味着有机酸代谢是盐胁迫和碱胁迫之间的主要差异代谢,且相较于盐胁迫,有机酸特异性响应碱胁迫。碱胁迫抑制小麦(Triticum aestivum)叶片的多数代谢途径,但诱导有机酸积累[6]。有分析认为,有机酸在碱胁迫下具有渗透调节、离子平衡及pH 调节的作用[18,48]。
在植物响应碱胁迫的代谢组分中,乌头酸这一组分应该被重视。以往有关碱胁迫下的有机酸生理机制研究中,检测的有机酸包括柠檬酸、草酸、苹果酸、琥珀酸、甲酸、乙酸、酒石酸、富马酸、乳酸[20-21,48]等,由于有机酸种类众多,检测部分有限几种有机酸可能出现主要有机酸漏检的问题。因此,有必要从整体代谢组的大量物质中概括关键变化物质。广靶代谢组具备检测大量已知的代谢物的能力,能够避免关键代谢物遗漏问题,本研究基于广靶代谢组结合靶向代谢组的方法,对差异代谢物进行代谢分类以及富集分析,从代谢组角度证实了有机酸特异性响应碱胁迫这一推论,并发现碱胁迫下燕麦叶片有机酸富集在TCA 路径上,且检测发现乌头酸是该代谢路径响应碱胁迫的主要成分,高玉刚[49]在对燕麦的碱胁迫研究中也发现了乌头酸大量积累的现象。乌头酸是由柠檬酸脱水形成,在已有的报道中,柠檬酸被认为是星星草[15]、虎尾草[50]、羊草(Leymus chinensis)[51]、冰草(Agropyron cristatum)[52]等在碱胁迫下主要积累的有机酸,然而这些研究中未检测乌头酸含量;另有报道指出,有机酸在干旱条件与碱胁迫条件下的含量变化完全相反[53],这可能与两类逆境条件下植物体的调节机制不同有关,推测认为,碱胁迫下,渗透胁迫引起乌头酸积累。
因此,本次研究证实了燕麦植株通过有机酸响应碱胁迫,锚定了与之相关的TCA 循环途径,发现了燕麦叶片的主要有机酸,并分析了乌头酸作为主要有机酸的代谢调节机制。
4 结论
综上所述,盐胁迫与碱胁迫均影响燕麦生长,对燕麦叶片的代谢影响明显不同。广靶代谢组学分析显示,有机酸代谢是燕麦叶片响应盐、碱胁迫的主要差异代谢,TCA 循环是有机酸代谢的关键代谢途径;经靶向代谢检测,发现乌头酸是TCA 通路中有机酸的主要成分。
