基于MRI DWI 的影像组学模型对骨肉瘤新辅助化疗疗效的评估价值
于荭 张胜男 段丽莎 孔蒙娟 崔建岭
1 河北医科大学第三医院CT/MR 室,河北省骨科生物力学重点实验室,石家庄 050011;2 天津市天津医院放射科,天津 300299
骨肉瘤是青少年最常见的原发性恶性骨肿瘤,其致死和致残率高[1]。目前新辅助化疗、手术加术后化疗使骨肉瘤患者的5 年生存率提高到了70%~80%[2]。新辅助化疗后骨肉瘤的肿瘤组织坏死率被认为是评价预后的“金标准”,而预后的好坏是确定是否可以行局部切除保肢治疗的依据。然而,这个“金标准”只能在术后获得,无法用于判断保肢手术进行与否。目前,用于术前评价新辅助化疗疗效的方法主要有临床评价和传统影像学评价,前者依据肿瘤大小变化、疼痛评分等化疗前后的症状或体征进行评价;后者主要包括对肿瘤边界、大小等形态学变化进行评价。这些方法虽然有一定的参考价值,但缺乏量化、标准化的指标,不能准确反映化疗疗效[3]。影像学评价方法具有很大的价值,其包括形态学评估及功能学评估,例如动态对比增强(DCE)-MRI、18F-FDG PET/CT 等[4-6],但这些检查目前缺乏特异性高的标准化参数。MRI 弥散加权成像(diffusion weighted imaging, DWI)功能显像方法简单、方便、无创,近年来的很多研究结果显示,表观扩散系数(apparent diffusion coefficient,ADC)在反映骨肉瘤等恶性肿瘤新辅助化疗疗效中具有重要价值[7-10]。但是由于肿瘤的异质性很大,其结果并不稳定,无法满足精准医学的要求。影像组学是将影像数据定量分析与机器学习相结合,筛选出具有诊断价值的影像组学特征,建立诊断模型,为临床诊疗提供更准确的信息[11]。本研究探讨基于MRI DWI 的影像组学模型对骨肉瘤新辅助化疗疗效评估的价值。
1 资料与方法
1.1 一般资料
回顾性分析2015 年6 月至2017 年11 月在河北医科大学第三医院接受治疗的41 例骨肉瘤患者的病历及影像资料,其中男性26 例、女性15 例,年龄(22.0±11.0)岁,范围11~49 岁。纳入标准:(1)经穿刺或手术活检的组织病理学检查结果证实为原发性骨肉瘤;(2)手术前接受新辅助化疗,且化疗前行常规MRI 及DWI 检查。排除标准:(1)未做手术,无法获得肿瘤组织坏死率;(2)MRI 图像伪影重,影响诊断。手术切除肿瘤后,根据Huvos分级系统[12]对所有标本进行组织学分析,将肿瘤组织坏死率≥90%者纳入疗效好组,<90%者纳入疗效差组。本研究已申请并通过了河北医科大学第三医院医学伦理委员会批准(批准号:2022-059-1),且所有患者及其家属在进行MRI 检查前均签署了安全调查表及知情同意书。
1.2 新辅助化疗方案
所有患者采用相同的新辅助化疗方案。每组化疗药物包含:(1)顺铂20 mg/m2×5 d+吡柔比星20~30 mg/m2×3 d;(2)异环磷酰胺2 g/m2×5 d;(3)甲氨蝶呤8~12 g/m2×1 d。每组化疗药用药结束为一个化疗周期,每个化疗周期结束后间隔2~3 周开始用下一组药,第3 组化疗药用药结束后2~3 周进行手术。分别于新辅助化疗前、化疗一期结束后5 d 内和完成整个化疗后测量所有患者的ADC,分别记为ADC0、ADC1、ADC2。
1.3 图像获取
应用德国Siemens 公司Verio 3.0T 超导型MRI仪进行扫描。根据肿瘤位置的不同,患者可采取仰卧位头先进或仰卧位足先进。根据扫描部位选取不同的表面线圈,如八通道膝关节线圈或八通道体部柔软线圈。常规行T1 加权轴位显像(重复时间700 ms,回波时间 12 ms);质子加权成像脂肪抑制序列(PDWI-FS)横断面、矢状面、冠状面显像(重复时间4 000 ms,回波时间 83 ms);DWI 采用单次激发自旋回波平面回波序列(SE-EPI),扫描参数:重复时间5 800 ms,回波时间100 ms,视野10 mm×210 mm,矩阵192×192,层厚3 mm,层间距0.75 mm,层数20,体素1.1 mm×1.1 mm×3.0 mm,b 值为0、500、1 000 s/mm2。
1.4 肿瘤勾画与分割
将入组患者各期的原始图像调入德国Siemens公司Verio Workstation 3.0 后处理工作站,由具有3年和5 年临床工作经验的2 名放射科医师在未知临床和组织学信息的情况下,在b=1 000 s/mm2的DWI 图像和ADC 图像上,沿肿瘤边缘勾画病灶ROI(图1),并在ADC 图像上测量病灶ADC,测量时避开肿瘤内出血、钙化及液化坏死区域。
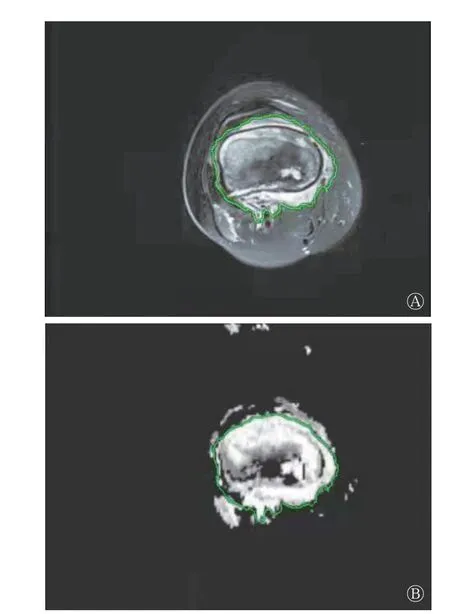
图1 骨肉瘤患者弥散加权成像(A,b=1 000 s/mm2)和表观扩散系数图像(B)上勾画的病灶感兴趣区Figure 1 Regions of interest delineated on diffusion weighted imaging (A, b=1 000 s/mm2) and apparent diffusion coefficient(B) images of osteosarcoma patient
1.5 影像组学特征提取
在Python 3.8.5(http://www.rodiomics.io/pyradiomics.html)中使用PyRadiomics 3.0.1 工具软件,对化疗一期结束后DWI 和ADC 图像上勾画的病灶ROI 进行影像组学特征的提取,提取的影像组学特征分为以下4 组:(1)一阶统计量特征,由126 个描述符组成,用来描述MRI 图像中voxel 强化度的分布,包括最大值、最小值、中值、均值等;(2)空间几何特征,包含14 个反映区域形状和大小的三维特征,包括体积、表面积、球形度、最大直径等;(3)纹理特征,从灰色水平运行长度和灰色水平共发生纹理矩阵计算,有525 个可以量化区域异质性差异的纹理特征,包括灰度共生矩阵、灰度梯度矩阵、领域灰度差分矩阵等;(4)变换特征,包括对数变换、指数变换、小波变换、平方根变换等。将提取的影像组学特征用随机分组法按6∶4的比例分为训练集和测试集,采用SMOTE 算法对训练集上的数据进行扩充。
1.6 影像组学模型的建立
首先,将上述获取的所有特征分别进行组内相关系数(intraclass correlation coefficient,ICC)分析,选择ICC>0.75 的特征;然后,采用方差分析(ANOVA)进行特征的初步筛选,选择P<0.05 的特征后,采用方差阈值、SelectKBest、最小绝对收缩和选择算子(LASSO)法进行降维,采用LASSO法得到偏差和方差的最佳平衡点,剔除冗杂、错误和无相关性的特征值,筛选出最有价值的特征,采用逻辑回归分类器构建影像组学模型。
1.7 统计学分析
应用SPSS 22.0 软件进行统计学分析。采用Shapiro-Wilk 检验法对计量资料进行正态性检验,符合正态分布的计量资料以x¯±s表示,呈偏态分布的计量资料以M(Q1,Q3)表示。符合正态分布且方差齐的数据采用独立样本t检验进行2 组间比较;不符合正态分布或方差不齐的数据采用两独立样本Wilcoxon 秩和检验法。绘制传统影像学(ADC)预测骨肉瘤患者新辅助化疗疗效的ROC 曲线,评估其诊断效能。绘制影像组学模型的ROC 曲线,计算AUC、灵敏度、特异度,评估影像组学模型对骨肉瘤新辅助化疗疗效的预测效能。采用ICC评价2 名医师提取的病灶ROI 的影像组学特征的一致性:ICC<0.40 表示一致性较差;ICC 为0.40~0.59 表示一致性一般;ICC 为0.60~0.74 表示一致性较好;ICC>0.75 表示一致性良好。P<0.05 为差异有统计学意义。
2 结果
41 例骨肉瘤患者中,疗效好组10 例、疗效差组31 例。由表1 可知,2 组患者的ADC0 的差异无统计学意义(t=1.14,P>0.05);疗效好组的ADC1、ADC2 高于疗效差组,且差异均有统计学意义(t=-2.92,P<0.05;Z=-2.61,P<0.01)。ROC 曲线分析结果显示,当ADC1≥1.34×10-3mm2/s 时,其对骨肉瘤新辅助化疗疗效评估的灵敏度为80%,特异度为81%,AUC 为0.797(95%CI:0.629~0.965);当ADC2≥1.51×10-3mm2/s 时,其对骨肉瘤新辅助化疗疗效评估的灵敏度为90%,特异度为71%,AUC 为0.777(95%CI:0.588~0.967)(图2)。
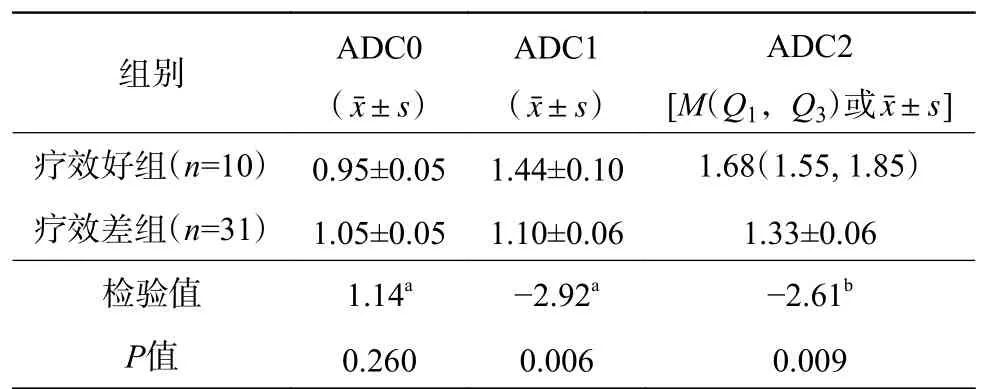
表1 新辅助化疗后不同疗效的2 组骨肉瘤患者的ADC 比较(×10-3 mm2/s)Table 1 Comparison of apparent diffusion coefficient values between two groups of osteosarcoma patients with different therapeutic effects after neoadjuvant chemotherapy (×10-3 mm2/s)
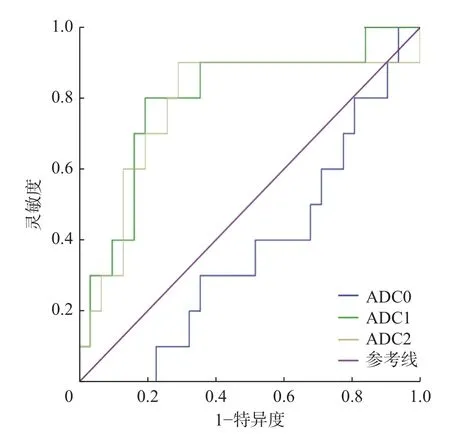
图2 ADC 预测骨肉瘤患者新辅助化疗疗效的受试者工作特征曲线 ADC0 为新辅助化疗前的ADC;ADC1 为化疗一期结束后5 d 内的ADC;ADC2 为完成整个化疗后的ADC;ADC为表观扩散系数Figure 2 Receiver operating characteristic curves of apparent diffusion coefficient values in prediction of the efficacy of neoadjuvant chemotherapy for osteosarcoma
从化疗一期结束后的DWI 和ADC 图像中共提取出1 409 个影像组学特征,按6∶4 的比例随机分为训练集和测试集[24(疗效好:6,疗效坏:18)∶17(疗效好:4,疗效坏:13)],将训练集数据扩充为70(疗效好:20,疗效坏:50),经筛选降维后获得5 个最优影像组学特征,分别为Interquartile Range、Skewness、Uniformity、Median、Maximum,均为纹理特征,如图3 所示,确定了LASSO 法的最优α 参数为-log(α)=2.32。以最优α 参数对应的5 个特征及其系数分别为:original_firstorder_Interquartile Range(系数为-0.289 894)、original_firstorder_Skewness(系 数 为-0.409 912)、original_firstorder_Uniformity(系 数 为0.015 519)、original_firstorder_Median( 系 数 为-0.373 091 )、original_firstorder_Maximum(系数为0.811 615)。
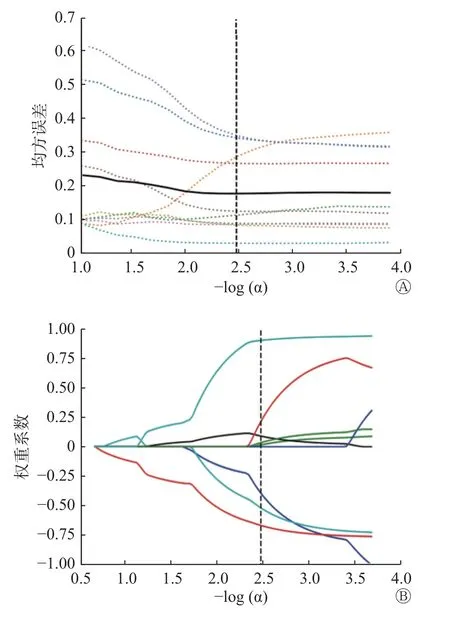
图3 影像组学特征的均方误差随α 参数变化趋势图(A)及影像组学降维图(B) A 图显示,LASSO 法中,当最优α 参数为黑色虚线所示时对应的最小均方误差,每一种颜色代表一个自变量的均方误差;B 图为在最优α 参数值处(虚线),选定的影像组学特征在预测骨肉瘤新辅助化疗疗效中对应的权重系数分布,每一种颜色代表一个自变量的权重系数Figure 3 Mean square error of radiomics features change trend according to α parameters (A) and dimension reduction diagram of radiomics features (B)
使用此影像组学模型预测骨肉瘤患者新辅助化疗疗效,结果显示,训练集中,影像组学模型预测骨肉瘤患者新辅助化疗疗效的ROC 曲线的AUC 为0.881(95%CI:0.811~0.942) ,灵敏度为90%,特异度为74%,测试集中AUC 为0.769(95%CI:0.515~0.933),灵敏度为75%,特异度为69%(图4)。
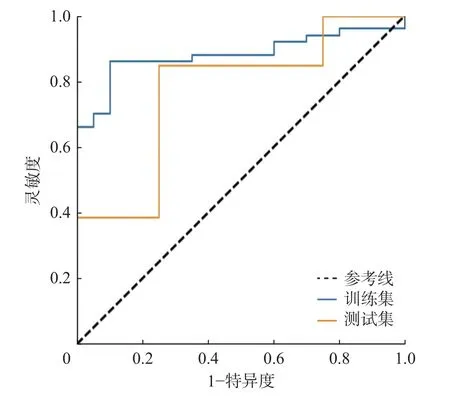
图4 影像组学模型预测骨肉瘤患者新辅助化疗疗效的受试者工作特征曲线Figure 4 Receiver operating characteristic curves of radiomics features in evaluation of the treatment response in osteosarcoma after neoadjuvant chemotherapy
3 讨论
骨肉瘤的恶性程度高,预后差,虽然近年来新辅助化疗和手术切除的综合治疗方法显著提高了骨肉瘤患者的5 年生存率[2],但仍有30%~40%的患者出现局部复发或远处转移,导致5 年生存率显著降低,仅为 23%~29%[13],这可能与部分骨肉瘤患者对化疗不敏感有关,另一个重要原因是术前化疗效果不理想。术前对骨肉瘤化疗疗效的准确评估至关重要,不仅对化疗方案的及时调整具有指导意义,还能在一定程度上预测患者预后[8]。目前,采用 Huvos 分级系统进行化疗疗效评估,可在一定程度上预测复发风险,但该分级系统是基于术后切除标本的肿瘤组织坏死率来进行评估的[12],具有滞后性,无法为是否可以进行保肢治疗提供有力依据,也无法很好地指导术后化疗。传统影像检查如X 射线、CT 和MRI 等可根据肿瘤体积变化、肿瘤内部液化坏死及钙化情况、周围骨质破坏等形态学变化对化疗效果进行评估[14],但无法反映肿瘤细胞的存活情况,与肿瘤组织坏死率的相关性较差,在骨肉瘤的分级、疗效及预后评估中具有明显的局限性[15],且相关研究结果显示肿瘤体积变化与化疗疗效间并无明显相关性[16]。动态对比增强(DCE)-MRI、DWI等能够反映恶性肿瘤血管新生情况及肿瘤细胞活性等信息[5,17-19],具有非常好的应用价值和发展前景,但由于肿瘤的异质性,目前仍缺乏特异性较高的定量指标。因此,为了能够早期判断肿瘤的化疗敏感性、及时调整化疗及手术方案、预测术前化疗疗效及预后,临床迫切需要一种简便、准确、可重复的新辅助化疗疗效评估方法。
Kumar 等[20]完善了影像组学的概念,高通量地从MRI、PET 及CT 等常规医学影像中提取出大量高维的定量影像特征,并进行进一步分析,从而能够定量地描述影像中的时间和空间异质性,揭示出肉眼无法识别的图像特征。影像组学研究的主要流程包括图像获取、ROI 分割、影像组学特征的提取、特征值选择和降维、预测模型的性能评估5 个步骤[21]。通过提取整合常规医学影像中肉眼无法识别的海量数字化信息,并经过机器学习算法、建立模型,有效避免了观察者的主观差异性,具有量化分析肿瘤异质性的功能[22],对疾病的精准诊疗具有重大的价值。并且已有研究基于MRI DWI 构建影像组学模型,对骨肉瘤化疗反应及预后进行预测,如Lee 等[23]的研究选择DWI 和ADC 图像特征构建模型,结果显示构建的模型可提高对骨肉瘤患者接受新辅助化疗后反应不良的诊断准确性。影像组学的最终目的是使建立的模型不仅对现有的数据有很好的预测能力,而且对未知的数据也有很好的预测能力。作为一种新兴的技术,影像组学在临床中的应用价值已在越来越多的研究中得到证实。
本研究利用影像组学的方法,初步探索了基于MRI DWI 的影像组学模型对骨肉瘤新辅助化疗疗效的评估效能。对所有提取到的影像组学特征进行统计分析、降维后,最终得到5 个具有预测价值的特征,构建影像组学模型。训练集中,AUC 为0.881(95%CI:0.811~0.942) ,灵敏度为90%,特异度为74%,测试集中AUC 为0.769(95%CI:0.515~0.933),灵敏度为75%,特异度为69%,这表明本研究所获得的影像组学模型对于骨肉瘤新辅助化疗疗效具有较好的预测效能。
本研究存在一定的局限性:(1)收集的骨肉瘤数据样本量较小且是单中心研究,缺乏对该模型在不同条件下的稳定性验证、前瞻性验证,为提高模型的诊断效能,今后尚需进行前瞻性研究、多中心合作,扩大样本量;(2)本研究采用人为方法勾画ROI,不仅工作量大、耗时久,不适用于大样本量的数据处理,而且由于肿瘤病灶形态欠规则,对病灶边界的确定存在个体差异性,这可能会对纹理特征筛选的准确性、模型的可重复性和稳定性造成影响,今后仍需进一步研究进行ROI 自动分割的方法;(3) 本研究仅单一地分析了影像组学特征在预测骨肉瘤新辅助化疗疗效中的效能,未与其他常规影像学特征、组织病理学特征以及临床特征相结合,有待下一步研究和验证。
综上所述,本研究结果表明,基于MRI DWI的影像组学模型对于骨肉瘤新辅助化疗疗效具有良好的预测效能,能够为骨肉瘤临床诊疗决策的制定提供有价值的指导信息,从而实现骨肉瘤的个体化精准诊疗。
利益冲突 所有作者声明无利益冲突
作者贡献声明 于荭负责研究命题和方案的建立、论文的撰写和审阅;张胜男负责数据的收集和分析、论文的撰写、文献的查阅;段丽莎、孔蒙娟负责数据的采集和处理、论文的修订;崔建岭负责研究的设计和支持、论文的审阅

