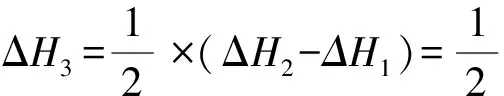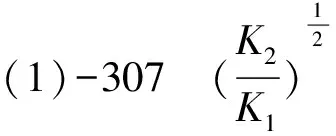聚焦目标反应 展开多面考查
——赏析2023年全国卷中原理大题
廖旭杲
(宁波市鄞州中学,浙江 宁波 315104)
2023年全国高考,国家考试中心命制的化学全国卷共三套(新课标卷、甲卷和乙卷),赏析其中的三道原理大题,发现命题手法如出一辙,均是针对某一具体反应,从文献中搜寻相关的研究予以改编加工而成.试题围绕某一具体反应,展开全方位的设问,从动力学维度的速率大小比较、归因分析(活化能)、反应历程解读等到热力学维度的能量变化、平衡状态判断、平衡常数计算、平衡移动方向等,引导学生多方面认识反应特征.品味之余,感叹于命题人的技术日臻老道,以某一反应作为标的,多方考查,不枝不蔓,一以贯之,背景情境不变,问题层出不穷,看似入口小,实则乾坤大.三道试题为中学师生树立了很好的典范,值得效仿,现将个人赏析呈现如下,以供大家继续讨论.
1 又见合成氨反应,研深研透
例1(2023年6月·全国新课标卷·10·14分)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位.回答下列问题:
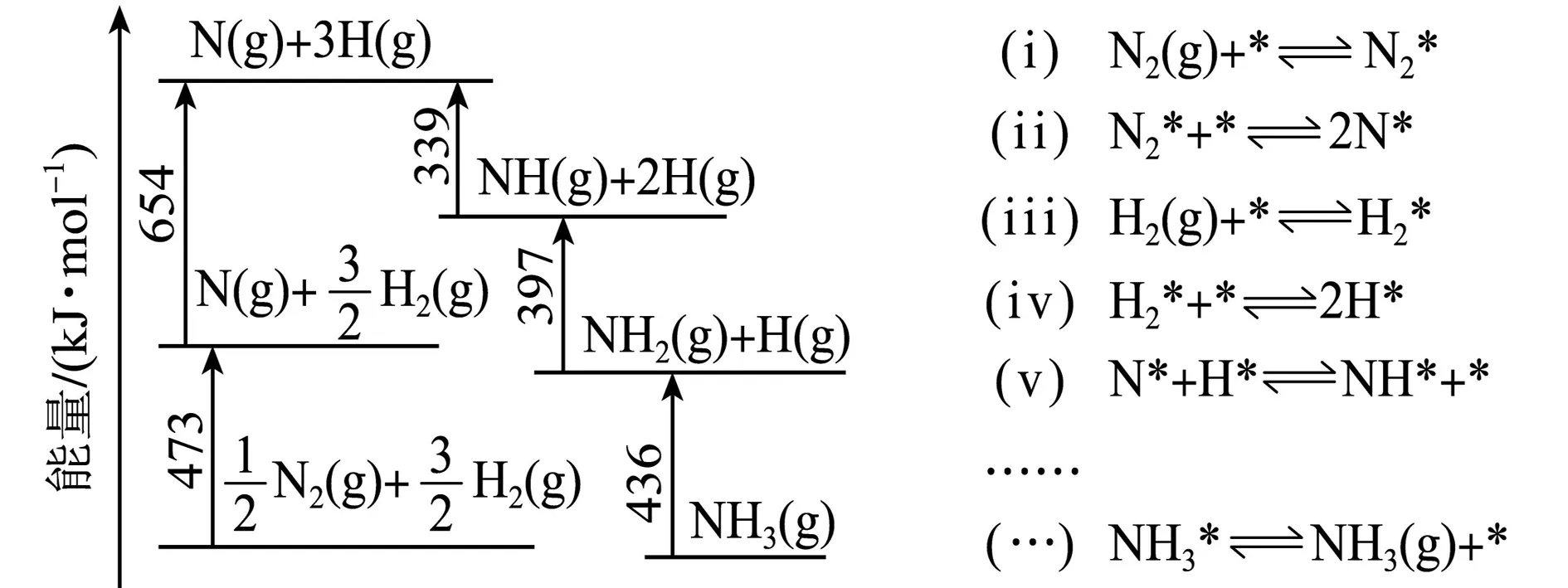
图1 反应数据 图2 反应机理
(2)研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,N2*表示被吸附于催化剂表面的N2).判断上述反应机理中,速率控制步骤(即速率最慢步骤)为____(填步骤前的标号),理由是____.
(3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4.已知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3,则α-Fe晶胞中含有Fe的原子数为____(列出计算式,阿伏加德罗常数的值为NA).

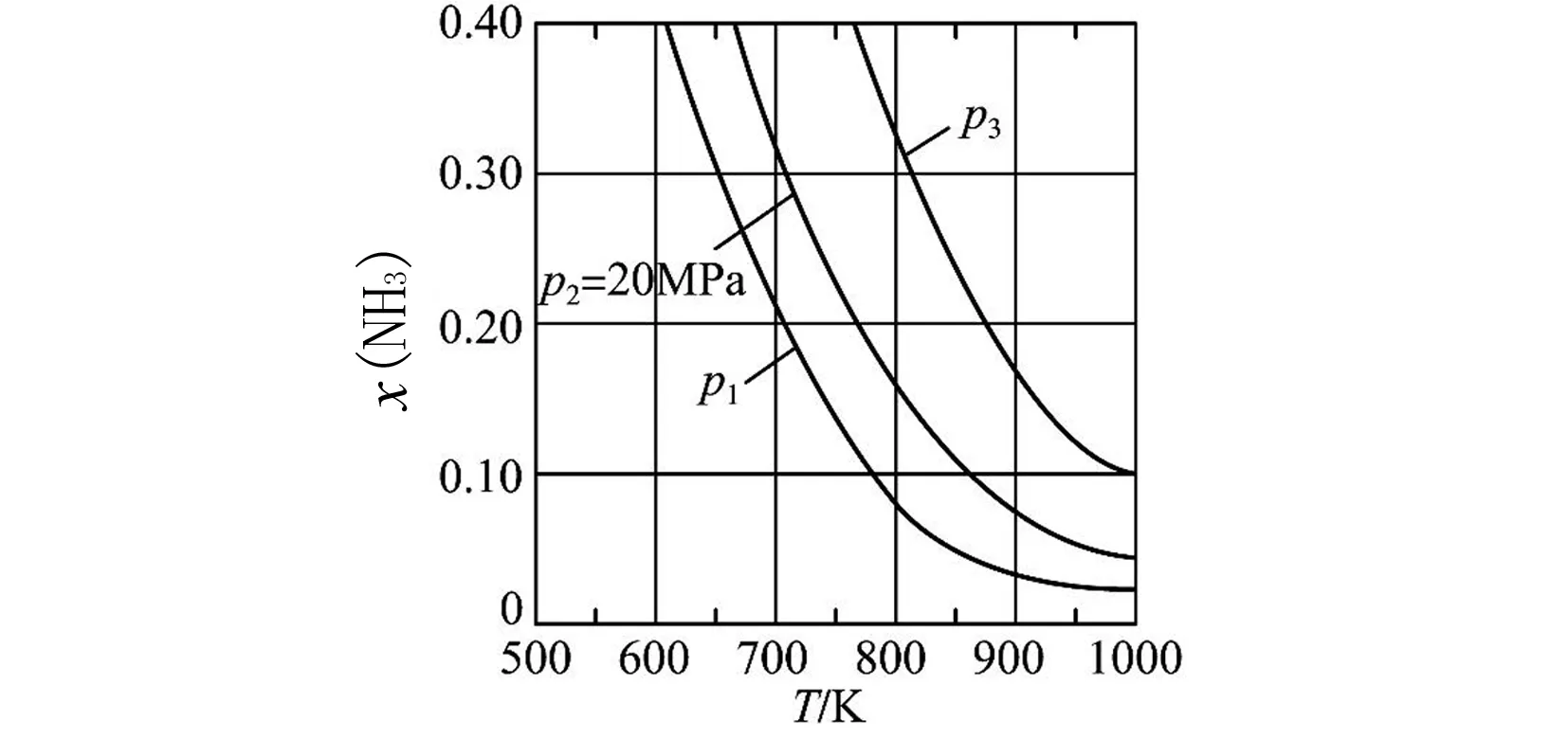
图3 平衡时氨的摩尔分数与温度关系图

图4 平衡时氨的摩尔分数与温度关系图
①图3中压强由小到大的顺序为____,判断的依据是____.
②进料组成中含有惰性气体Ar的图是____.
③图3中,当p2=20 MPa、x(NH3)=0.20时,氮气的转化率α=____.该温度时,反应
的平衡常数Kp=____(MPa)-1(化为最简式).
解析(1)在化学反应中,断开原来化学键形成气态活性原子要吸收能量,从气态原子逐步形成化学键要释放能量.由图1数据可知,断开旧键耗能:(473+654)kJ·mol-1=1127 kJ·mol-1,形成新键放能:(436+397+339)kJ·mol-1=1172 kJ·mol-1,(1172-1127)kJ·mol-1=45 kJ·mol-1,故反应放热为45 kJ·mol-1,记为ΔH=-45 kJ·mol-1.
也可直接列综合算式,因为反应热可通过反应物键能之和减去产物键能之和来估算:
故反应
的ΔH=(473+654-436-397-339)kJ·mol-1=-45 kJ·mol-1.
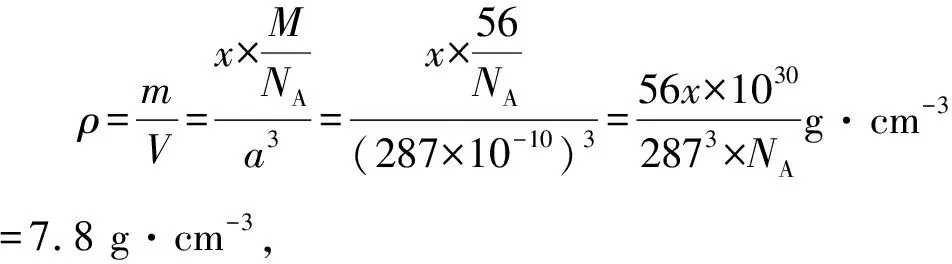
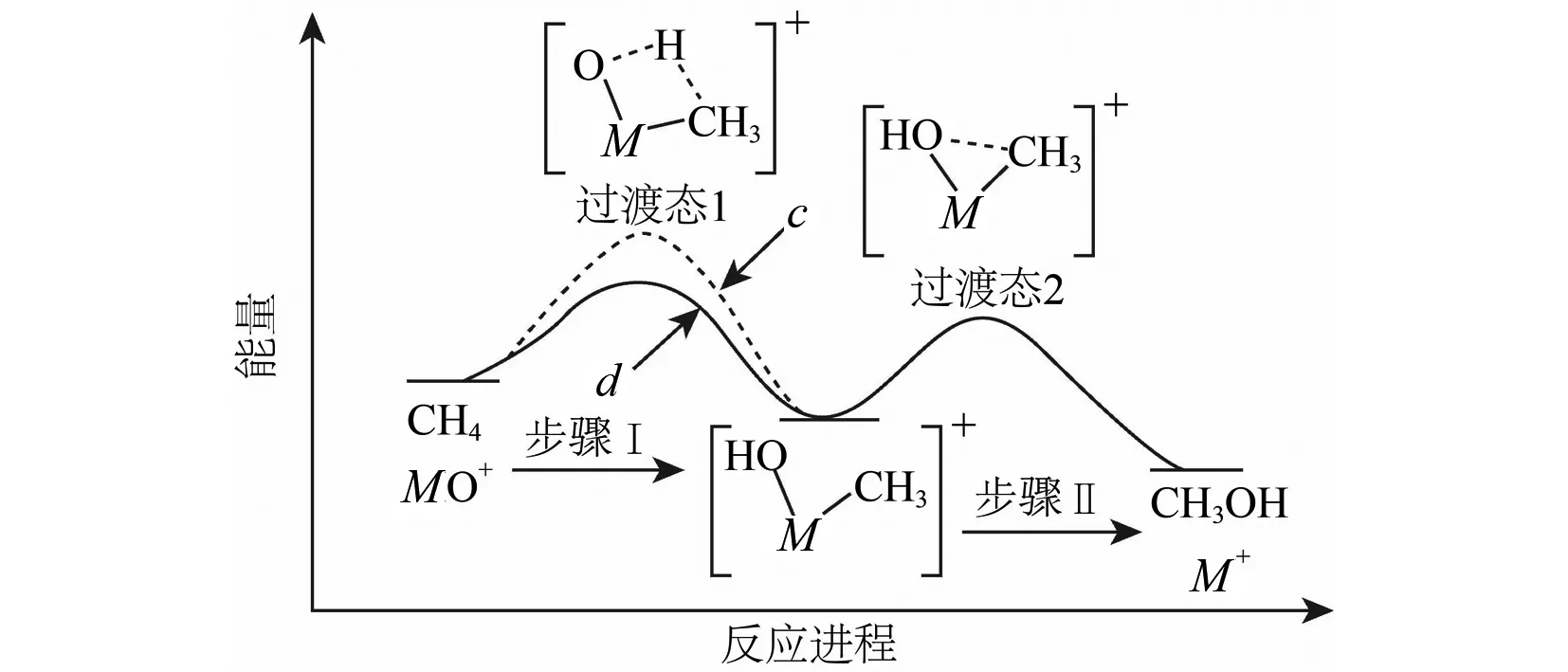
(4)①合成氨的反应中,压强越大越有利于氨的合成,因此压强越大平衡时氨的摩尔分数越大.由图中信息可知,在相同温度下,反应达平衡时氨的摩尔分数p1 ②对比图3和图4中的信息可知,在相同温度和相同压强下,图4中平衡时氨的摩尔分数较小.在恒压下充入惰性气体Ar,反应混合物中各组分的物质的量分数减小,各组分的分压也减小,化学平衡要朝气体分子数增大的方向移动,因此,充入惰性气体Ar不利于合成氨,进料组成中含有惰性气体Ar的图是图4. ③图3中,进料组成为x(H2)=0.75、x(N2)=0.25两者物质的量之比为3∶1.假设进料中氢气和氮气的物质的量分别为3 mol和1 mol,达到平衡时氮气的变化量为y,则有: 起始/mol 1 3 0 变化/moly3y2y 平衡/mol 1-y3-3y2y n总=4-2y 则该温度时,反应 的平衡常数 参考答案:(1)-45 (2)(ⅱ) 在化学反应中,断开化学键的步骤都属于能垒,最大的能垒为速率控制步骤,由于N≡N的键能比H-H键的大很多,因此,在上述反应机理中,速率控制步骤为(ⅱ) 点评此题与2018年11月浙江化学选考第26题有异曲同工之妙,也是针对合成氨反应,展开全方位的设问,包括:从能量图中计算反应热,从反应历程中寻找决速步骤,解析铁系催化剂的结构特征,不同进料比下的结果分析,紧紧围绕目标反应,不枝不蔓,研深研透,引导学生多方面把握习以为常的合成氨反应,温故知新. 例2(2023年6月·全国乙卷·28·14分)硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等.回答下列问题: (1)在N2气氛中,FeSO4·7H2O的脱水热分解过程如图5所示: 图5 绿矾热分解失重比与温度关系图 根据上述实验结果,可知x=____,y=____. (2)已知下列热化学方程式: ΔH1=akJ·mol-1 ΔH2=bkJ·mol-1 ΔH3=ckJ·mol-1 (3)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应: 平衡时p(SO3)-T的关系如图6所示.660 K时,该反应的平衡总压p总=____kPa、平衡常数Kp(I)=____(kPa)2.Kp(I)随反应温度升高而____(填 “增大”、“减小”或“不变”). 图6 平衡时SO3分压与温度关系图 解析(1)试题要求学生解秘N2气氛中绿矾晶体受热脱水的热重(TG)分析曲线. FeSO4·7H2O的摩尔质量为278 g·mol-1,首次失重19.4%,278 g×19.4%≈54 g,恰为3 mol H2O的质量,故x=7-3=4,因为第二次也为19.4%:38.8%-19.4%=19.4%,故y=4-3=1. 当然,也可巧解: 方法1完全失水,失重比为45.3%,故每失1 mol H2O失重比约为45.3%/7≈6.5%,现首次失重19.4%,应失去3 mol H2O,第二次再失重19.4%,同样失去3 mol H2O,故x=7-3=4,y=4-3=1. 方法2 由图像中可知:从FeSO4·7H2O出发,经历了三次减重,前两次的失重百分比相等且大于第三次减重.即(7-x)=(x-y) ,得y=2x-7>0,又x+y<7,且x、y必须为正整数,故x=4,y=1. 以上两种速算方法简化了计算量,可为考生争取了时间. (2)承接第(1)问,x=4,y=1,按照“主体”物质的指引,遵从“消元”思想,运用盖斯定律可知:第1式与第3式迭加,减去第2式的2倍,即得目标热化学方程式,故ΔH=(a+c-2b)kJ·mol-1 (3)由题图可知660 K时恰为a点,此时p(SO2)=p(SO3)=1.5 kPa,故平衡总压p总=3.0kPa,Kp(I)=p2(SO2)×p2(SO3)=1.5 kPa ×1.5 kPa=2.25 (kPa)2,从图中增函数曲线可知Kp(I)随反应温度升高而增大. (4)不妨设提高温度后,反应(Ⅰ)达平衡时,p(SO2)=p(SO)3=xkPa,则 xx SO3部分分解了反应(Ⅱ),导致其分压减少2ykPa. xx0 2y2yy x-2yx+2yy 反应(Ⅱ)正向进行,所以有: x-2y=p(SO3) x+2y=p(SO2) 由题意得p总=(x-2y)+(x+2y)+y=2x+y=84.6 kPa p(SO3)=x-2y=35.7 kPa 解得:x=40.98 kPa,y=2.64 kPa p(SO2)=x+2y=46.26 kPa≈46.3 kPa(都保留计算结果在0.1 kPa以内) p(O2)=2.64 kPa 此小问也可采用如下思路分析,更简洁[1]: 若仅只考虑题中的反应(Ⅰ),那么平衡时SO2和SO3的分压相等,但由于温度升高引起反应(Ⅱ)的发生:SO3进一步分解为SO2和O2,故SO2分压增大而SO3分压减小,新增的O2的分压的2倍恰好是SO2分压增大量以及SO3分压减小量.因此可得最终平衡时:p(SO3)+2p(O2)=p(SO2)-2p(O2)即4p(O2)=p(SO2)-p(SO3),因此p(O2)=[p(SO2)-p(SO3)]/4; 平衡时系统中只有SO3、SO2和O2三种气体,故p总=p(SO3)+p(SO2)+p(O2),结合p(O2)=[p(SO2)-p(SO3)]/4就可知道p(SO2)=[4p总-3p(SO3)]/5,代入题中数据,即得:p(SO2)=46.3 kPa,p(O2)=2.7 kPa,反应Ⅱ的平衡常数Kp=(2.7×46.32)/35.72 参考答案:(1)x=4,y=1 (2)ΔH=(a+c-2b)kJ·mol-1 (3)p总=3.0 kPa,Kp(I)=2.25 (kPa)2,增大 p(SO2)=46.3 kPa 点评本题命题的背景取材于绿矾的热分解,围绕这一真实的素材展开多方考察,有热重分析、热效应分析、压力分析、平衡分析,就热力学内容逐步深入考查,同一情境,一以贯之,不失为命题的典范,值得效仿.美中不足的是动力学维度的考查缺失. 例3(2023年6月·全国甲卷·10·14分)甲烷选择性氧化制备甲醇是一种原子利用率高的方法.回答下列问题: (1)已知下列反应的热化学方程式: ΔH1=285 kJ·mol-1 ΔH2=-329 kJ·mol-1 (2)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+.MO+与CH4反应能高选择性地生成甲醇.分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4=M++CH3OH,结果如图7所示.图中300 K的曲线是____(填“a”或“b”. 300 K、60 s时MO+的转化率为____(列出算式). 图随时间变化图 (3)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如图8所示(两者历程相似,图中以CH4示例). 图8 体系的能量随反应进程的变化图 (ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是____(填“Ⅰ”或“Ⅱ”). (ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线____(填“c”或“d”). (ⅲ)MO+与CH2D2反应,氘代甲醇的产量CH2DOD____CHD2OH (填“>”“<”或“=”).若MO+与CHD3反应,生成的氘代甲醇有____种. (2)首先明悉纵坐标的涵义: 即纵坐标可表示MO+被CH4还原为M+的多少.再结合横坐标为时间,可知曲线的斜率可代表速率(反应的快慢),而本小题只有一个温度变量,故斜率较大的曲线a反应快,对应的温度高(310 K),斜率较小的曲线b反应慢一些,对应的温度低一些(300 K),即300 K条件下的曲线是b. (3)(ⅰ)观察题图可知步骤Ⅰ涉及的是碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,所以符合题意的是步骤Ⅰ; (ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则此时正反应活化能会增大,根据图示可知,MO+与CD4反应的能量变化应为图中曲线c; (ⅲ)MO+与CH2D2反应时,因“直接”参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则单位时间内产量会下降,则氘代甲醇的产量CH2DOD 点评本题紧紧围绕CH4选择性氧化为CH3OH这一背景设问,既有动力学方面的速率比较和机理研究,又有热力学方面的能量计算和平衡常数推演,主线明晰,全方位考查CH4选择性氧化反应,形散神聚,多角度设问考问学生基础和证据获取及推理、模型认知及应用能力.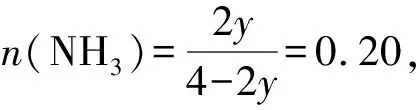

2 古老的绿矾分解,常考常新












3 甲烷选择性氧化,活学活用