云南猪源A型多杀性巴氏杆菌PMJC-1株的分离鉴定
李雪,朱沛,陈其云,舒相华,高林,袁红,王位,姚俊*
(1.云南农业大学动物医学院,云南 昆明 650201;2.云南省畜牧兽医科学院云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224;3.玉溪农业职业技术学院,云南 玉溪 653106; 4.西南林业大学,云南 昆明 650224)
多杀性巴氏杆菌是一种通过接触口鼻分泌物进行传播,以呼吸道感染为临床症状的一种病原,能感染包括禽、猪、牛、兔等在内的多种动物[1]。其中,猪肺疫是由猪多杀性巴氏杆菌引发的疾病[2]。目前,该病已遍布养猪业发达的国家,据报道,世界猪群约有25%~50%受感染[3]。该病已在我国不同省(市、区)发生和流行,其危害日趋严重。
2022年2月,云南省玉溪市江川区某规模猪场的保育猪出现口鼻流涕、呼吸困难、张口呼吸及呈犬坐式张口呼吸等临床表现,少数猪只急性死亡。病死猪只剖检发现肺脏肿大、有明显出血,气管和支气管分泌物增多,胸腔及肺门淋巴结肿大、出血,喉头水肿等临床症状,疑似多杀性巴氏杆菌感染。在排除了猪重要病毒性传染病后,为确诊该病猪是否是多杀性巴氏杆菌感染,无菌采集病死猪只的内脏器官及组织进行病原菌的分离培养和鉴定。对分离菌株进行生化及药敏鉴定、16S rRNA序列分析,随后采用PCR方法对细菌的荚膜进行分型,并对分离菌株的致病力进行了实验动物昆明小鼠致病性试验,最终确诊该病是由A型多杀性巴氏杆菌感染发病,此次分离菌株命名为A型多杀性巴氏杆菌PMJC-1株。
1 材料与方法
1.1 试验材料
病死猪只内脏器官及组织病料无菌采集自玉溪市江川区某规模猪场。营养琼脂培养基、细菌革兰氏染色剂、氧化酶试剂及OF试剂均购自广东环凯微生物科技有限公司;新生犊牛血清购自上海爱必信生物科技有限公司;分子生物学试剂购自美基生物有限公司;细菌生化鉴定试剂条API 20ETM及药敏试剂条ATB VET购自法国梅里埃诊断产品(上海)有限公司。本次实验动物昆明小鼠购自昆明医科大学实验动物中心。
1.2 试验方法
1.2.1猪常见病原学检测
对送检样品组织提取病毒核酸,利用云南省热带亚热带动物病毒病重点实验室已建立的检测方法进行猪圆环病毒、猪瘟病毒、蓝耳病毒、猪细小病毒、猪伪狂犬病毒等猪常见病原学检测,非洲猪瘟病原检测送至第三方检测。
1.2.2细菌分离与纯化
无菌采集到发病猪只淋巴结,涂抹接种于含3%犊牛血清的LB培养板,并在37℃恒温培养箱中培养24~48h,通过观察分离培养的菌落形态,选取单个菌落进行革兰氏染色镜检鉴定[4]。挑取单菌落接种进行纯化培养,直至菌落结构形态以及菌落的色泽均一即可进行下一步。
1.2.3生化试验
按API 20ETM的生化鉴定条说明书将纯化好的部分菌落挑取到0.85%生理盐水中稀释至1MCF(麦氏浊度单位),将稀释的菌液加入到生化试剂条,37℃培养箱中孵育24h,若结果中阳性大于3个,则可以读板,否则继续孵育12h后再读板。同时对该菌进行氧化酶(OX)实验和葡萄糖发酵实验(OF)。按照氧化酶试剂说明书将氧化酶试剂滴在试纸上,待试纸湿润后用接种环挑取菌落至试纸上后30s内读取结果。按照OF试剂说明书将纯化好的菌落接种到生理盐水中稀释至1MCF(麦氏浊度单位),将稀释的菌液加入OF试剂安瓿瓶,37℃培养箱中孵育24h后观察颜色变化。
1.2.4细菌基因组DNA提取
用高温灭菌后的接种针刮取纯化后的菌落,加入含PBS溶液的无菌离心管中混匀制得悬浊液,按美基生物有限公司的细菌DNA提取试剂盒说明书中革兰氏阴性菌DNA的提取方法提取DNA,提取完成后放置在-20℃冰箱中保存,用于后续的PCR扩增试验[5]。
1.2.5设计引物
在NCBI获取该菌的全基因序列,并设计出相对应的特异性引物。Pm-plpE-R:5′-TAATTGTGCTTGGTGACTT-3′,Pm-plpE-F:5′-ATGAAA-CAAATCGTTTTAAA-3′,引物大小为1011bp,按95℃ 5min;95℃ 40s,50℃ 1min,72℃ 1min,35个循环;72℃ 10min。根据文献[6-8]合成16S通用引物,荚膜血清型(引物信息及退火温度见表1)及文献[9,10]毒力基因合成特异引物(引物信息及退火温度见表2)。送擎科生物试剂公司合成引物。

表1 荚膜分型鉴定引物信息
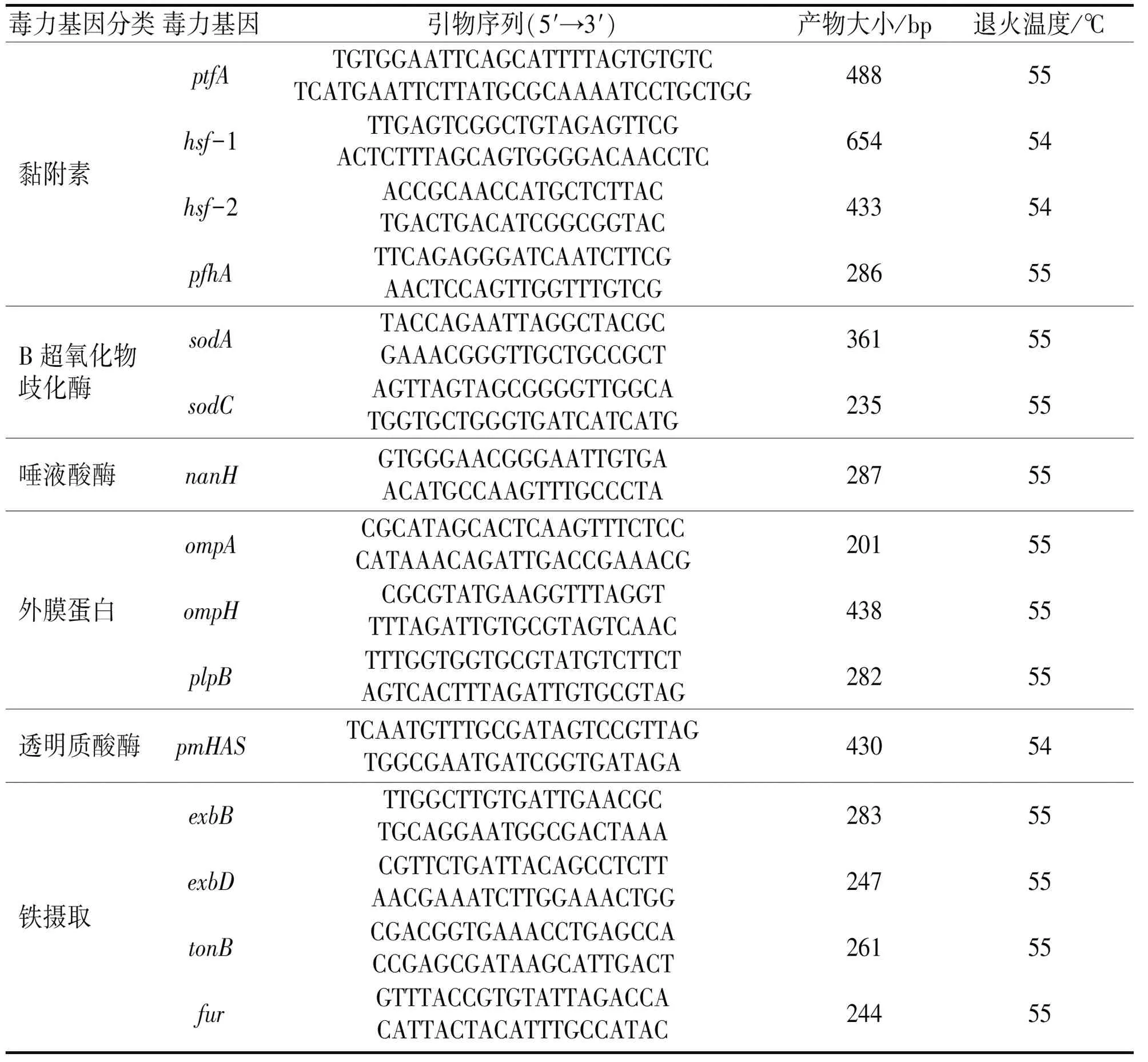
表2 毒力基因鉴定引物信息
1.2.616SrRNA的PCR检测与测序
将细菌核酸进行16S rRNA PCR扩增,预扩增片段长1492bp。将PCR产物送擎科生物有限公司测序,并将测序结果进行BLAST比对。
1.2.7细菌荚膜血清型测定及毒力基因测定
利用PCR对分离得到的细菌进行种属荚膜血清分型鉴定,提取该细菌基因组DNA作为模板,在40μL反应体系中进行扩增,反应体系为2×Taq PCR Master Mix 22μL,细菌核酸4 μL,上、下游引物各2μL,无菌水12μL。反应条件为94℃预变性5min后在94℃ 1min,56℃ 1min,72℃ 80s条件下扩增35个循环;然后72℃延伸10min[11]。其产物利用琼脂糖凝胶电泳检测,并扫描成像。
1.2.8细菌的药敏实验
按法国梅里埃诊断产品(上海)有限公司药敏试验说明书将分离纯化培养的细菌接种于药敏试剂条ATB VET上,37 ℃培养24 h后读取结果[12]。
1.2.9动物接种实验
将12只实验小鼠分为两组,其中8只为实验组,4只为对照组。试验组腹腔注射0.1mL(浓度为5MCF)菌液,对照组腹腔注射相同剂量的灭菌生理盐水。隔离饲养72h,观察该细菌对小鼠的致病力。
2 结果与分析
2.1 猪常见病原检测结果
猪圆环病毒、猪瘟病毒、蓝耳病毒、猪细小病毒、猪伪狂犬病毒、非洲猪瘟病毒检测结果均为阴性。
2.2 细菌的分离培养与革兰氏染色镜检
分离得到的菌株在培养基上的菌落形态呈现为表面光滑湿润、微凸半透明状。将分离纯化的细菌进行革兰氏染色镜检为革兰氏阴性细菌,细菌呈短杆状。
2.3 生化试验
生化试验结果显示该细菌能发酵果糖、甘露醇,不发酵乳糖、鼠李糖、葡萄糖和麦芽糖;吲哚试验和硝酸盐还原试验均为阳性,MR与V-P试验为阴性。鉴定结果根据数值编码数据库(v4.1)获得编码为0040524,鉴定为多杀性巴氏杆菌。结果见表3。生化补充试验结果表明该菌的氧化酶实验(OX试验)为阳性,OF实验表明该菌为发酵型细菌,符合巴氏杆菌的生物化学特征。

表3 生化试验鉴定结果
2.4 PCR扩增
PCR扩增结果发现,左侧细菌16S通用引物扩增的目的片段大小为1492bp,右侧多杀性巴氏杆菌特异引物扩增的DNA片段大小为1011bp,进行下一步的试验分析。见图1。

注:从左至右为2000bp DNAmaker、阴性对照、16S阳性对照、样品核酸、2000bp DNAmaker、阴性对照、巴氏杆菌阳性对照、样品核酸、2000bp DNAmaker。
2.5 16S rRNA测序及同源性分析
将PCR产物送去测序,测序结果与GenBank上公布的猪多杀性巴氏杆菌序列进行同源性比较分析,发现本研究中分离得到的致病病原DNA序列与GenBank中猪多杀性巴氏杆菌的基因序列的同源性高达99%,说明此次试验中所获取的致病菌为多杀性巴氏杆菌,命名为PMJC-1。
2.6 荚膜血清型及毒力基因检测
检测结果显示,预扩增片段大小与荚膜A型相符,证明试验中分离的多杀性巴氏杆菌为荚膜A型多杀性巴氏杆菌,结果见图2。毒力基因鉴定结果表明,多杀性巴氏杆菌具有黏附素(ptfA、hsf-1、hsf-2、pfhA)、超氧化物歧化酶(sodA、sodC)、唾液酸酶(nanH)、外膜蛋白(ompA、ompH、plpB)、透明质酸酶 (pmHAS)和铁摄取(exbB、exbD、tonB、fur)的相关毒力因子,结果见图3。
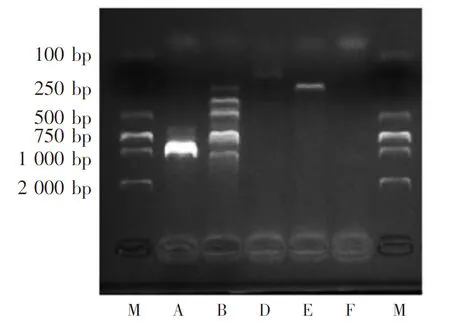
注:从左至右依次为2000bp Maker、血清A型、 血清B型、血清D型、血清E型、血清F型、2000bp Maker。
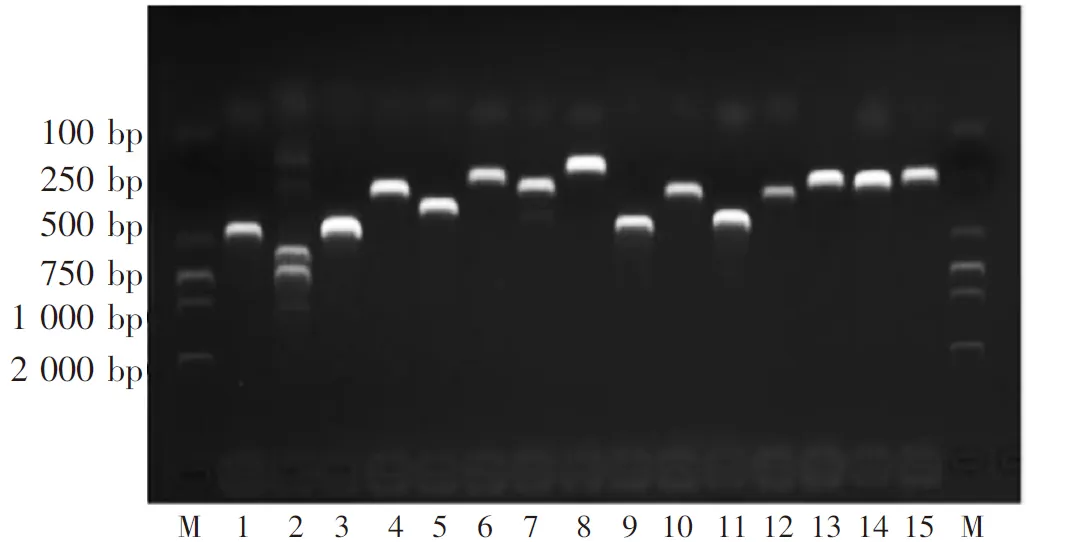
注:从左至右依次为2000bp Maker,1-15分别为ptfA、hsf-1、hsf-2、pfhA、exbB、exbD、tonB、sodA、sodC、pmHAS、fur、ompA、ompH、plpB、nanH,2000bp Maker。
2.7 药敏试验
药敏试验显示该菌对阿莫西林、头孢噻吩、头孢哌酮、大观霉素、呋喃妥因、利福平等6种药物敏感,在临床治疗中,可用这几种药物对该猪场进行有效治疗,结果见表4。

表4 药敏试验结果
2.8 动物致病结果
8只实验组昆明小鼠在48h内死亡5只,对死亡小鼠剖检后可见肝脏肿大、出血,肠鼓气,其余3只腹泻、精神萎靡,4只对照组昆明小鼠均临床表现正常。用接种针无菌穿刺死亡小鼠肝、肾脏组织后划线培养进行细菌回收,经细菌培养、形态学观察、细菌生化实验及特异引物扩增均成功验证回收到目的菌株。
3 讨论
多杀性巴氏杆菌荚膜血清型分为五种,各血清型之间的交叉保护率差异较大。荚膜是分泌至菌体外的一类以多糖或多肽为主的物质[13],在细菌—宿主致病过程中能够促进巴氏杆菌的细胞黏附能力的作用。而且,荚膜是躲避中性粒细胞与单核吞噬细胞吞噬作用的重要免疫逃避因子[14]。不同荚膜血清型中荚膜的主要成分不同,其作用也不同,比如A型荚膜的主要成分为透明质酸,而D型荚膜的主要成分则为肝素;根据文献报道[15],它们都有增强细菌的耐干燥能力,抵抗外界环境的脱水作用。此前,有大量研究报道,目前猪群中主要流行的为A型,引起患病猪只出现呼吸困难、打喷嚏、咳嗽、流鼻涕,病死猪肺脏有出血点、气管中有大量泡沫。例如,胡璇等[16]从贵州毕节某育肥猪场分离到的巴氏杆菌为A型,张瑞华等[11]也从青岛某香猪场病死猪上分离到了三株荚膜A型巴氏杆菌。本实验分离到的多杀性巴氏杆菌为A型,与文献报道相一致。
巴氏杆菌在宿主体内存活、繁殖、致病的关键所在是毒力因子,其作用主要体现在该菌的致病性、在宿主体内的存活和繁殖能力上,该菌毒力因子众多,目前已被证实与多杀性巴氏杆菌致病性密切相关的毒力因子包括荚膜、脂多糖、铁代谢相关蛋白等[17]。诸多细菌的毒性作用已经被证实与Pm的结合、转运、黏附、定殖、入侵等过程有关,多种细菌毒力因子被认为是疫苗开发中的潜在靶抗原,因其具有良好的免疫保护作用,因此可作为预防和治疗多杀性巴氏杆菌病的新型疫苗候选靶标,而有些细菌毒力因子的具体作用机制有待进一步的深入研究开发[18]。基于这些毒力因子的研究报道,有助于业内人士完善多杀性巴氏杆菌的致病机理并促进相关疫苗的研制。本实验的毒力基因结果表明,分离到的多杀性巴氏杆菌含有黏附素、超氧化物歧化酶、唾液酸酶、铁摄取等毒力因子,这与尹媛媛的报道一致[19]。
根据毒力基因的结果,本实验进一步对分离到的多杀性巴氏杆菌对小鼠的致病性进行了探索。结果表明,腹腔注射5个麦氏浓度(MCF)的多杀性巴氏杆菌悬液1mL可以引起小鼠肝脏出血,小肠肠道充气,呈透明胶冻样,证明该菌株具有一定的致病力。姜轩等[20]分离到的多杀性巴氏杆菌感染小鼠也出现了类似的现象。
对此次江川区猪场发病原因进行筛查,排除猪重要病毒性传染病的病因,确诊引发猪场猪只死亡是原发性A型多杀性巴氏杆菌导致,可见A型多杀性巴氏杆菌的致病性不可小觑。近年来,越来越多的细菌对常用抗生素表现出耐药,这给养殖场细菌病的防治带来了挑战。本研究对分离到的多杀性巴氏杆菌的耐药性进行了研究,发现该菌株仅对阿莫西林、头孢噻吩、头孢哌酮、大观霉素、呋喃妥因、利福平6种药物敏感,对磺胺甲恶唑等18种药物耐药。
4 结论
本次江川区猪场发病,猪只大部分急性死亡的原因经试验证明为A型多杀性巴氏杆菌导致的。本实验用该猪场病死猪只的淋巴结进行细菌的分离和培养,采用细菌生化方法对细菌进行鉴定,初步证明该菌为猪多杀性巴氏杆菌。采用PCR方法对细菌的荚膜进行分型,采用细菌药敏试验方法对所分离细菌的耐药性和耐药基因进行了研究,并对该菌株的致病力进行研究,旨在为该猪场巴氏杆菌病的治疗和防控提供建议。

