新型冠状病毒肺炎患者免疫应答规律分析
童晓峰 杨明昆 胡伟航
2019 年12 月武汉出现不明原因病毒性肺炎患者[1],后证实该肺炎与一种新型冠状病毒(SARSCoV-2)有关[2],该疾病被世界卫生组织命名为新型冠状病毒肺炎(COVID-19)[3]。研究表明COVID-19 重病率达25.5%,病死率超过3%[4]。在疫情早期和医疗资源相对不足的地区,病死率更高[5]。当前应对病毒感染主要依赖机体固有免疫和适应性免疫应答。COVID-19患者尸检发现脾脏和淋巴结淋巴细胞数量较少,肺脏巨噬细胞含病毒颗粒,患者存在免疫受损[6]。因此,分析COVID-19 患者免疫应答规律是关键,有利于尽早判断重症化趋势,对患者的预后转归极为重要。
1 资料与方法
1.1 临床资料 收集2022 年12 月至2023 年1 月本院183 例COVID-19 患者的临床资料。诊断标准:依据第9 版COVID-19 诊疗方案[7]:①流行病学史:与SARSCoV-2 感染者有接触史。②临床表现:发热和(或)呼吸道症状;发病早期白细胞总数正常或降低,或淋巴细胞计数(LY)计数减少。③胸部影像学:早期呈现多发小斑片影及间质改变,以肺外带明显。进而发展为双肺多发磨玻璃影、浸润影,严重者可出现肺实变,胸腔积液少见。④病原学检查:呼吸道标本或血液标本实时荧光RT-PCR 检测SARS-CoV-2 核酸检测阳性;呼吸道标本或血液标本病毒基因测序,与已知的SARS-CoV-2高度同源。有流行病学史中的任何一条,符合临床表现中的2 条,具有肺炎影像学特征,具备病原学证据之一者为确诊病例。排除标准:具备病原学证据,但无明显肺炎影像学特征患者;甲强龙使用量≥2 mg/kg 或疗程>5 d;既往有恶性肿瘤、乙肝肝硬化、尿毒症患者。
1.2 方法 (1)收集资料:包括性别、年龄、接触史、既往病史、症状、住院期间呼吸频率、体温、血压及脉搏、血常规、C 反应蛋白(CRP)、降钙素原(PCT)、生化指标、心肌酶、凝血功能、肺部CT 及X-ray 等。(2)临床分型:①普通型组,具有发热、呼吸道等症状,影像学有肺炎表现;②重型组,符合下列任何一条:a.呼吸≥30 次/分,b.未吸氧,指氧饱和度≤93%,c.动脉血氧分压(PaO2)/ 吸氧浓度(FiO2)≤300 mmHg;③危重型组,符合下列任何一条:a.呼吸衰竭需要机械通气,b.休克,c.合并其他器官功能衰竭需ICU 监护治疗;④死亡组。(3)临床分期:根据患者临床症状与影像学演变过程,按病程分为3 期[8]:①早期(急性期):发热、肌肉酸痛、呼吸困难等症状明显,肺部CT 表现为斑片状/点状毛玻璃样混浊;②中期(亚急性期):症状未缓解,部分重症患者呼吸困难加重,需要经鼻高流量湿化氧疗或无创呼吸机辅助,肺部CT 影像的毛玻璃密度斑块和固结的范围增加;③后期:a.大部分患者进入恢复期:咳嗽、呼吸困难好转,肺部CT 感染灶基本吸收,治愈出院;b.少部分患者病情加重,呼吸衰竭持续恶化,伴其他重要脏器功能不全,肺部CT出现弥漫性病变,两肺密度大幅度增加,直至死亡。
1.3 统计学方法 采用SPSS 17.0 统计软件。计量资料以(±s)表示,两组比较采用t检验,多组比较采用方差分析;计数资料以n(%)表示,用卡方检验。P<0.05 为差异有统计学意义。
2 结果
2.1 患者基本情况 183 例患者,男85 例,女98 例;年龄(55.64±14.67)岁。其中普通型组129 例(70.5%)、重型组29 例(15.8%)、危重型组15 例(8.2%)、死亡组10 例(5.5%),四组年龄和住院时间较差异均有统计学意义(P<0.05)。见表1。
表1 患者基本情况(±s)
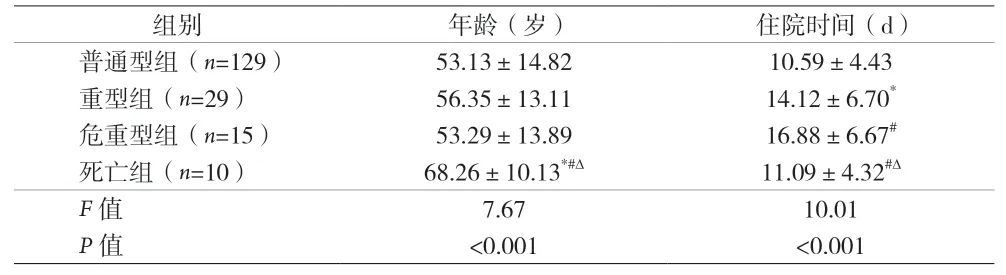
表1 患者基本情况(±s)
注:与普通型组,*P<0.05;与重型组比较,#P<0.05;与危重型组比较,ΔP<0.05
?
2.2 四组分型在疾病不同阶段的比较 见表2。
表2 四组分型在疾病不同阶段的比较(±s)
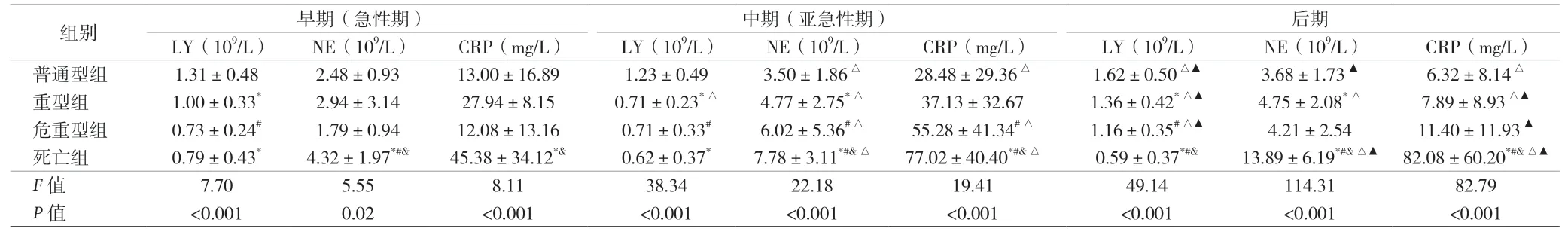
表2 四组分型在疾病不同阶段的比较(±s)
注:与普通型组比较,*P<0.05;与重型组比较,#P<0.05;与危重型组比较,&P<0.05;与早期比较,*P<0.05;与中期比较,ΔP<0.05
?
3 讨论
本资料结果显示,COVID-19 患者的免疫应答随病情加重和病程演变有明显变化。在不同临床分型间比较,随着疾病病情加重,各分型中的LY 计数呈下降趋势,其中死亡组LY 呈现显著下降,而NE 和CRP 呈上升趋势;在不同临床分期间进行比较,随着疾病病程演变,普通型、重型、危重型患者LY 计数水平均较早期升高,而死亡组患者LY 水平虽低,但随病程发展并无明显变化;重型组和危重症组与死亡组相比,NE 和CRP 水平在中期到达峰值。死亡组LY 在整个病程期间均低于普通型组,低于正常参考范围。尸检发现脾脏明显缩小,LY 数量明显减少。淋巴结LY 数量较少,免疫组化染色显示脾脏和淋巴结内CD4+T 和CD8+T 细胞均减少,证实存在淋巴细胞耗竭[7]。
明显减少的LY 导致死亡患者的免疫应答与普通型患者和流感病毒的免疫反应有明显差异[9]。在固有免疫应答阶段,LY、巨噬细胞等分泌产生I 型干扰素,I 型干扰素诱导抗病毒蛋白来阻断病毒是机体第一道免疫防线的重要组成部分[10]。在急性期,死亡组的LY 开始显著降低,SARS-CoV-2 容易逃脱第一道防御,在宿主细胞内大量复制和组装,释放感染更多的宿主细胞。随着病程进展,机体启动适应性免疫应答。在CD4+T 细胞的帮助下,B 细胞产生病毒中和抗体,阻断病毒感染宿主细胞;细胞毒T 细胞(CTL),绝大多数是CD8+T细胞,是彻底清除病毒感染的保障[11]。在亚急性期,COVID-19 死亡患者低下的LY 无法进行有效的体液免疫和细胞免疫来清除病毒。尸检报告中电镜下支气管黏膜上皮和II 型肺泡上皮细胞胞质内可见冠状病毒颗粒;免疫组化染色显示部分肺泡上皮和巨噬细胞呈SARSCoV-2 抗原阳性,RT-PCR 检测SARS-CoV-2 核酸阳性。但重型和危重型患者LY 在疾病后期逐步回升,适应性免疫反应进行有效阻断和清除病毒,最终患者康复出院。因此,淋巴细胞下降是COVID-19 病情加重及不良转归的关键因素。
在疾病早期COVID-19 重型、危重型和死亡患者LY 下降同时表现有NE 和CRP 上升。CHEN 等[12]通过小鼠SARS 肺炎模型研究发现,耗竭CD4+和CD8+T 细胞亚群,在感染第12 天,NE 能够代偿从肺部清除病毒。COVID-19 尸检肺泡腔内渗出细胞主要为单核和巨噬细胞。II 型肺泡上皮细胞和巨噬细胞内可见包涵体。故病毒感染LY 缺乏时,巨噬细胞和NE 能发挥保护作用。病毒活化巨噬细胞分泌IL-1、IL-6、IL-8、IFN-γ和IL-12 等细胞因子和趋化因子,驱使NE 黏附血管内皮和浸润感染局部;IL-1、IL-6 等刺激肝脏和上皮细胞合成CRP,CRP 激活补体和加强吞噬细胞的吞噬作用,进而清除入侵机体病毒和损伤、坏死、凋亡的组织细胞[13]。进入后期,重型、危重型LY 开始回升,适应性免疫应答彻底清除病毒,NE 和CRP 回落至正常。但死亡患者后期LY 耗竭,病毒大量繁殖,巨噬细胞和NE 持续代偿性升高。
综上所述,COVID-19 患者持续淋巴细胞下降,是疾病进展的表现;NE 和CRP 持续上升,参与病毒清除同时,也有可能存在免疫紊乱和过度炎症反应,亚急性期使用免疫调节药物,如激素、PD1 抗体药物等,需慎重。重型和危重型患者的免疫应答反应临床需要加强动态监测和引起高度关注。

