超高效液相色谱-串联质谱筛查确证尿液中磺胺、喹诺酮与四环素抗生素
张 楠,唐增煦,王莉莉,孙开奇,赵 榕*,范 赛*
(1.北京市疾病预防控制中心,北京市预防医学研究中心,北京 100013;2.中国疾病预防控制中心营养与健康所,北京 100050)
四环素类、磺胺类和喹诺酮类广谱抗生素是常见的既可治疗人类疾病,又可作为生长促进剂促进动物生长的化学物质[1],因此在医药卫生及动物养殖行业得到了广泛使用。然而,过度使用抗生素不仅会诱使病原体产生抗药性,还会对人体多方面产生有害影响[2-3]。我国是世界主要的抗生素生产和使用国家之一,已在境内不同的环境基质中检出多种抗生素残留[4],这些抗生素导致的环境污染、细菌耐药以及生态毒理效应等环境问题,已成为目前我国亟需解决的环境问题之一[5]。四环素类、磺胺类和喹诺酮类抗生素的半衰期虽然较短,但由于其应用广泛并已进入各类环境基质和动物性食品中,导致了环境中抗生素的“假持续”现象[6],成为威胁公众安全及生态系统的一大隐患。近年来,对抗生素的研究多集中于其在环境与动物性食品中的残留以及使用现状[7-9],对人体的抗生素暴露剂量及抗生素对人群健康影响的研究则十分匮乏,这可能是由于人体生物基质中抗生素的检测方法开发存在困难。因此,为监测人体内抗生素的暴露水平以及评估其对人群可能产生的健康影响,亟需建立人体生物样本中抗生素的检测技术。
进入人体体内的抗生素仅有部分会被消化吸收,约30%~90%的抗生素在进入人体后8~24 h内通过尿液和粪便排出[10],同时,尿液的采集具有无创性和易得性,因此尿液是代替血液对体内抗生素水平进行监测的良好生物基质。前期研究显示,学龄儿童抗生素水平的高暴露与儿童肥胖直接相关[11-12],为了开展学龄儿童的抗生素暴露谱研究,开发尿液中抗生素的检测方法非常必要。然而,现有研究大多数仅针对单个抗生素,或单一类别的抗生素,很少涉及多类别抗生素[13-15]研究。因此,本文采用超高效液相色谱-串联质谱法(UPLC-MS/MS)对人尿液中的16种磺胺类、20种喹诺酮类和9种四环素类共45种抗生素进行了同时检测,并应用建立的方法对北京市280例6~17岁学龄儿童尿液样本中的抗生素进行了筛查。
1 实验部分
1.1 仪器与试剂
ThermoScientificTMSQAltisTM三重四极杆质谱仪(美国Themo Scientific 公司);Milli-Q 超纯水制备系统(美国Millipore 公司);Anavo HLB 固相萃取柱(200 mg/6 mL,北京纳鸥科技有限公司)。甲醇、乙腈(色谱级,北京纳鸥科技有限公司),EDTA-2Na(优级纯,北京分析试剂厂)。除特殊说明外,所有实验试剂均为分析纯。
标准品:16 种磺胺类药物(磺胺乙酰胺、磺胺嘧啶、磺胺噻唑、磺胺吡啶、磺胺甲基嘧啶、磺胺二甲基嘧啶、磺胺甲二唑、磺胺甲氧哒嗪、磺胺间甲氧嘧啶、磺胺对甲氧嘧啶、磺胺氯哒嗪、磺胺二甲氧嘧啶、磺胺多辛、磺胺甲唑、磺胺异唑、磺胺苯吡唑)混合标准溶液的质量浓度为10 µg/mL,20 种喹诺酮类药物(脱乙烯基环丙沙星、马波沙星、依诺沙星、氟罗沙星、诺氟沙星、氧氟沙星、培氟沙星、环丙沙星、达氟沙星、洛美沙星、恩诺沙星、奥比沙星、沙拉沙星、司帕沙星、二氟沙星、西诺沙星、哌啶酸、喹酸、萘啶酸、氟甲喹)混合标准溶液的质量浓度为10 µg/mL,9种四环素类药物(二甲胺四环素、4-差相土霉素、土霉素、甲基土霉素、四环素、去甲基金霉素、金霉素、多西环素、4-差相四环素)混合标准溶液的质量浓度为100 µg/mL。混标均购自北京Dikma公司。
1.2 标准溶液的配制
分别精确吸取16种磺胺类药物混标溶液1.00 mL、20种喹诺酮类药物混标溶液1.00 mL、9种四环素类药物混标溶液0.10 mL于同一个10 mL棕色容量瓶中,用甲醇溶液定容至刻度,制备成3类抗生素的混合标准储备液(质量浓度均为1.0 µg/mL),储存于-20 ℃冰箱内备用。精确吸取3 类抗生素的混合标准储备液1.00 mL于10 mL棕色容量瓶中,用甲醇溶液定容至刻度,制备成3类抗生素的混合中间液(质量浓度均为100.0 ng/mL)。
1.3 样品前处理
取尿液样品5.0 mL 置于15 mL 离心管中,加入 0.1 mol/L 的EDTA-2Na 缓冲溶液5.0 mL,涡旋混匀30 s 后过HLB 固相萃取柱。HLB 固相萃取柱依次用6 mL 甲醇和6 mL 水活化,然后将尿液混合液全部上样至该萃取柱,随后用6 mL 水对萃取柱进行淋洗以除去杂质,真空泵下抽干萃取柱中的残留水分。随后使用6 mL 甲醇洗脱,收集洗脱液,将洗脱液以氮气流吹干。用0.5 mL 甲醇-水(1∶1,体积比)复溶,装入1.5 mL塑料离心管,10 000 r/min离心10 min,上清液供仪器测定。
1.4 UPLC-MS/MS条件
1.4.1 液相色谱条件色谱柱:ThermoAccucore RP-MS 色谱柱(100 mm×2.1 mm,2.6 µm);流速:0.35 µL/min;柱温:40 ℃;进样量:10 µL;流动相A为乙腈,B为0.02%甲酸溶液,梯度洗脱,洗脱程序:0~15 min,5%~95% A;15~17 min,95% A;17~17.1 min,95%~100% A,17.1~19 min,100% A;19~19.1 min,100%~5% A;19.1~22 min,5% A。
1.4.2 质谱条件离子源:电喷雾离子源(ESI);毛细管电压:3.5 kV;离子传输管温度:350 ℃;辅助气加热温度:325 ℃;鞘气:5.58 L/min(50 Arb);辅助气:7.97 L/min(10 Arb);扫描方式:正离子扫描;检测方式:选择反应监测(SRM)模式;各待测物的质谱信息及保留时间等参数详见表1。
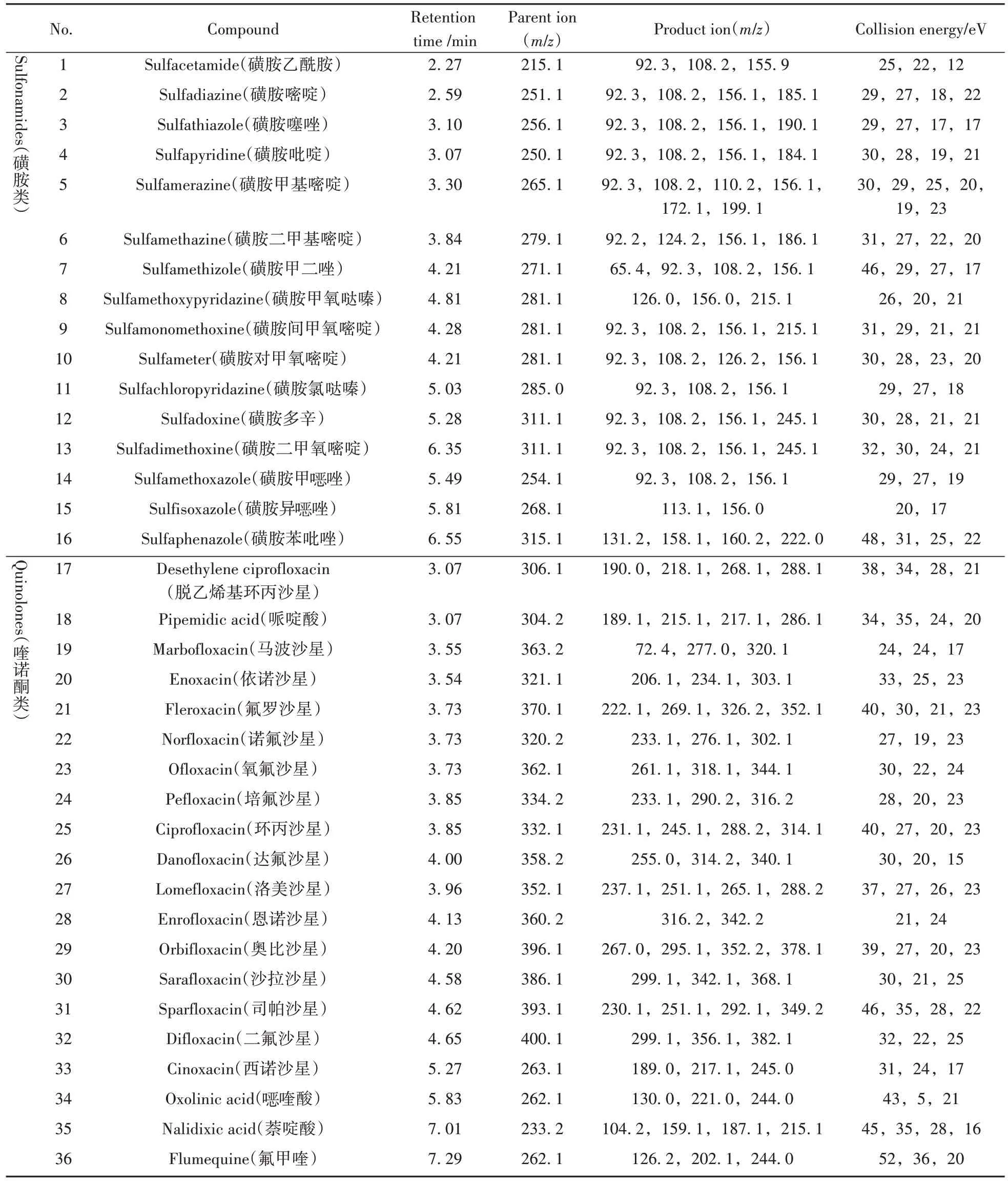
表1 各化合物的保留时间及质谱参数Table 1 Retention time and mass spectrometry parameters of each compound
2 结果与讨论
2.1 仪器条件的优化
2.1.1 质谱条件的优化为确定质谱参数,通常采用流动注射的方式进行参数确认,在正离子(ESI+)扫描模式下,磺胺、喹诺酮、四环素类抗生素化合物及其代谢产物多为正离子,在液相色谱-质谱检测中一般会产生[M+H]+的分子离子峰。质谱检测过程中,高分辨质谱多用来定性筛查,再通过三重四极杆质谱进行定量检测。本研究尝试采用三重四极杆质谱完成定性筛查,并进行定量检测。定性检测中,离子对的选取多参考欧盟2002/657/EC规范,当两个离子对满足IP 4分法时,即可进行质谱定性。但实际检测中发现,定性离子受到干扰时,不能满足定性要求,将造成假阴性误判。在三重四极杆质谱仪缺少飞行时间质谱仪定性的情况下,采用多离子对结合丰度比的定性方式,可以满足定性的要求,避免基质干扰带来的误判。本研究绝大部分化合物采用3 对或以上的定性定量离子对,避免了检测结果的不确定性,可以获得更准确的定性结果,同时以三重四极杆质谱进行定量分析,可同时实现筛查确证与定量,详细质谱信息见表1,各化合物的基质混合标准溶液谱图见图1~3。
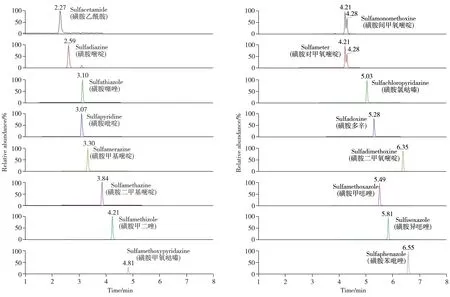
图1 16种磺胺类抗生素的基质混合标准溶液色谱图(10.0 µg/L)Fig.1 Chromatograms of 16 sulfonamide antibiotics matrix standards solutions(10.0 µg/L)
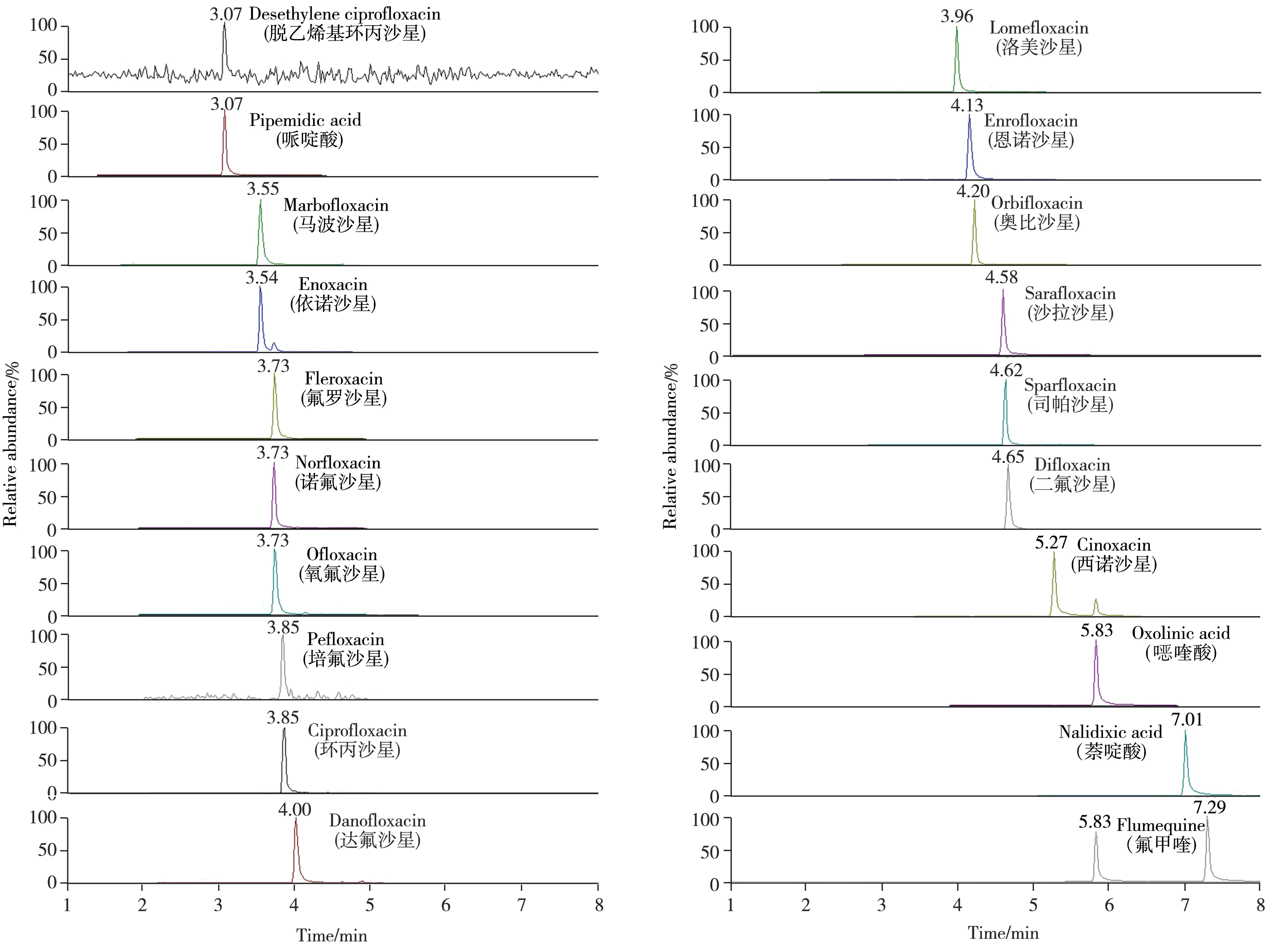
图2 20种喹诺酮类抗生素的基质混合标准溶液色谱图(10.0 µg/L)Fig.2 Chromatograms of 20 quinolone antibiotics matrix standards solutions(10.0 µg/L)
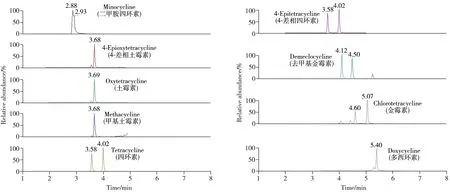
图3 9种四环素类抗生素的基质混合标准溶液色谱图(10.0 µg/L)Fig.3 Chromatograms of 9 tetracycline antibiotics matrix standards solutions(10.0 µg/L)
2.1.2 液相色谱条件的优化正离子模式下,一般在流动相中添加甲酸可提高响应值,增加灵敏度,但使用Thermo Accucore RP-MS 色谱柱检测时,部分抗生素在甲酸体系下的峰形会出现展宽,导致灵敏度下降。因此,本研究分别考察了0.1%甲酸水溶液-乙腈、0.05%甲酸水溶液-乙腈、0.02%甲酸水溶液-乙腈、纯水-乙腈为流动相时对目标化合物色谱行为与质谱响应的影响。结果显示,以Thermo Accucore RP-MS 色谱柱为分离柱时,选用0.02%甲酸水溶液-乙腈为流动相进行梯度洗脱,45 种化合物峰形良好,灵敏度最高。
2.2 前处理条件的优化
磺胺、喹诺酮、四环素类抗生素是目前最为常见的几类兽药,国家针对这3 类抗生素制定了一系列动物性食品检测方法,GB 31658.17-2021《食品安全国家标准 动物性食品中四环素类、磺胺类和喹诺酮类药物残留量的测定》[17]中同时规定了基于HLB 固相净化小柱的此3 类抗生素的混合前处理方法。同时,基于该固相小柱检测多种抗生素残留的方法已经有大量报道[16],国标方法与文献方法中均对HLB小柱的优化条件进行了介绍,此处不再赘述。
抗生素在动物性食品中的低残留导致人体尿液样本中的残留量极低,不宜采用QuEChERS 方法进行净化。而固相萃取柱具有较强的浓缩富集性,可将大体积尿液样本通过过柱的方法进行浓缩。本文通过固相萃取柱将5 mL 尿液中的3 类抗生素吸附到柱上并将体积浓缩至0.5 mL,提高了检测灵敏度。另外,由于四环素类药物极易与金属螯合导致回收率下降,故加入0.1 mol/L EDTA-2Na溶液以避免四环素类药物的螯合,提高其回收率;同时,磺胺类化合物在酸性条件下易发生降解,应避免在前处理过程中引入甲酸等酸性溶剂,防止磺胺类化合物回收率下降。
2.3 检出限及定量下限
为减少基质抑制效应对3 类抗生素检测结果的影响,采用阴性尿液制备空白基质溶液,并配制0.5、1.0、2.0、5.0、10.0、20.0 µg/L的基质匹配标准溶液,以色谱峰面积对相应标准溶液中化合物的质量浓度进行线性回归。结果显示,在0.5~20.0 µg/L 范围内,各物质线性良好,线性相关系数(r)均大于0.999。以信噪比为3时对应的质量浓度为方法检出限(LOD),信噪比为10时对应的质量浓度为定量下限(LOQ),磺胺、喹诺酮、四环素3类目标物的LOD为0.1~0.5 µg/L,LOQ为0.3~1 µg/L,结果见表2。
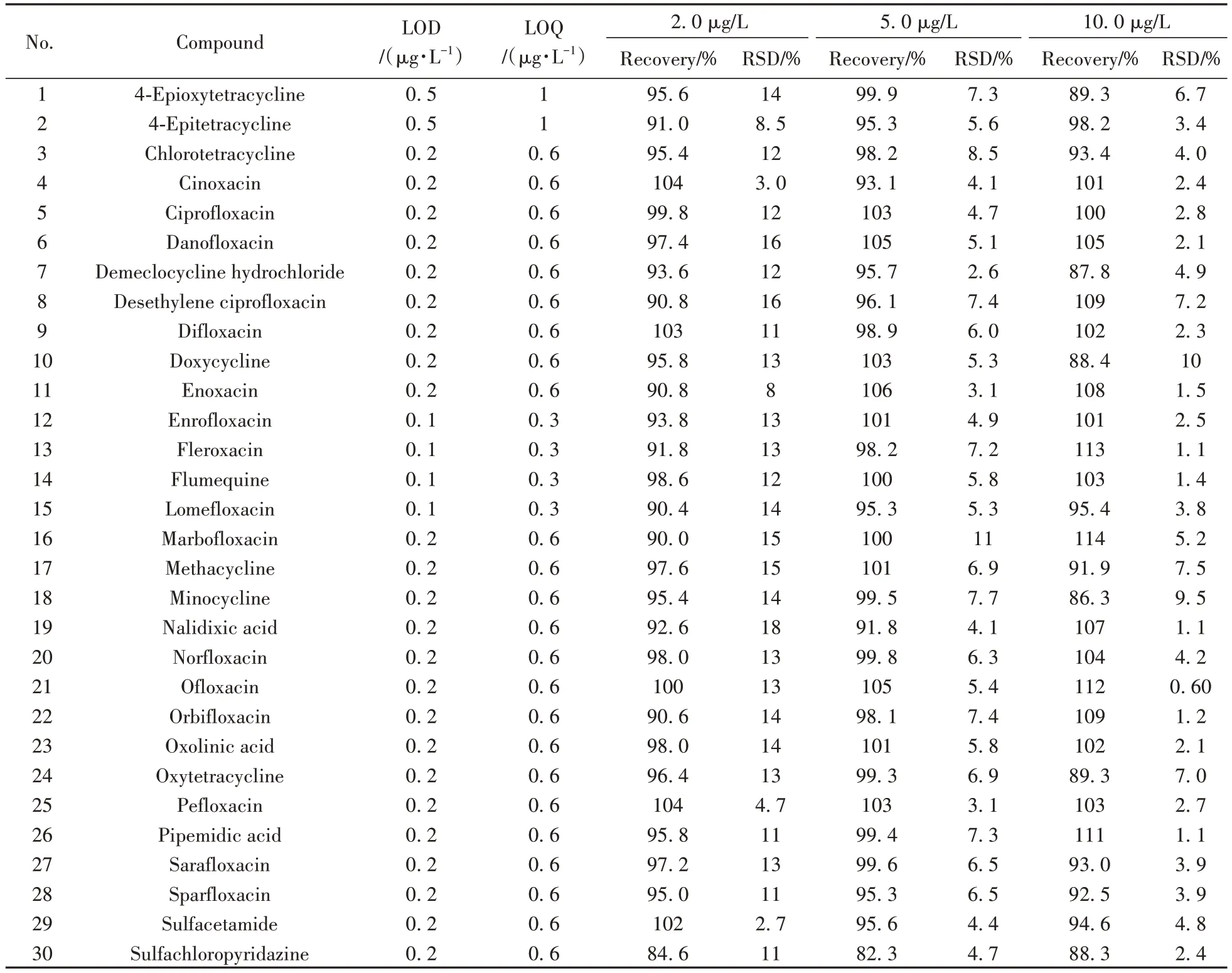
表2 方法的检出限、定量下限、回收率及相对标准偏差(RSD, n=6)Table 2 LODs,LOQs,recoveries and RSDs of the method(n=6)
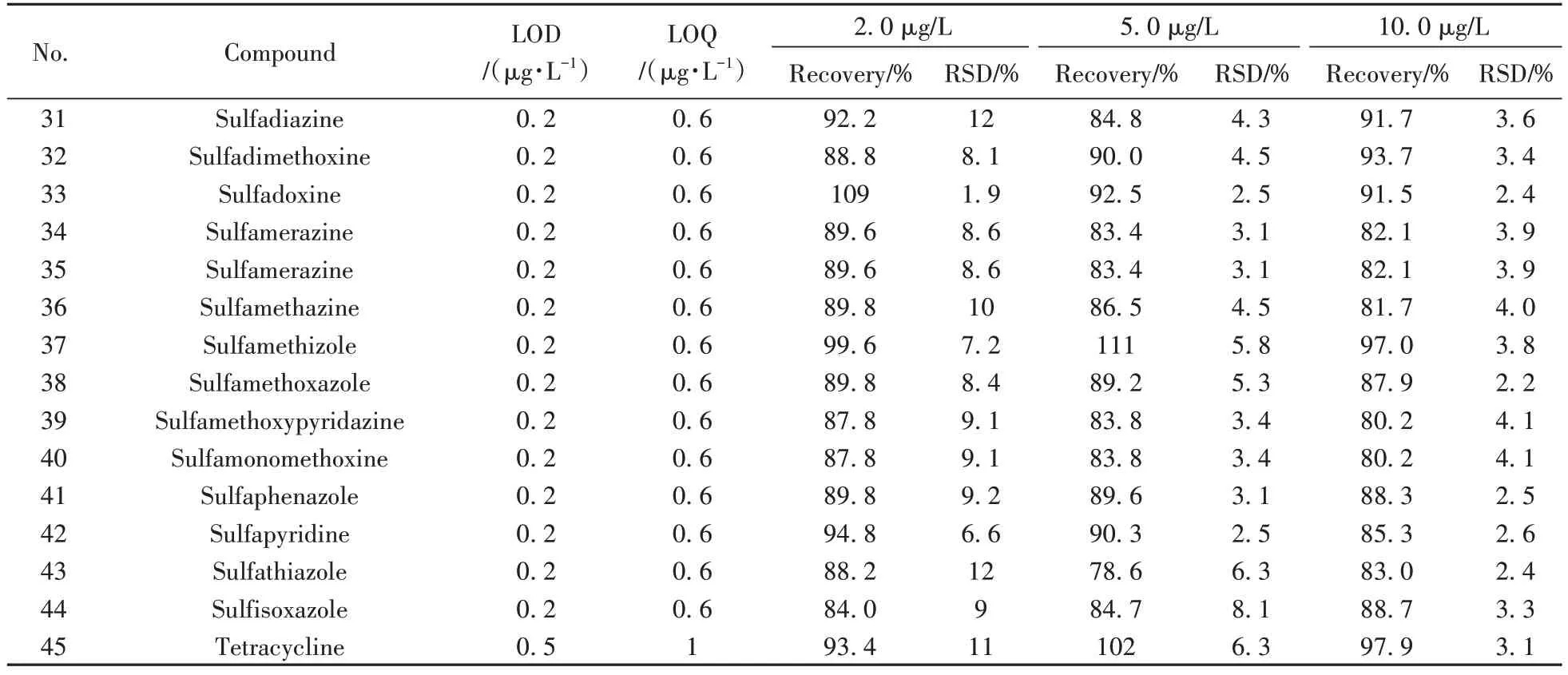
(续表2)
2.4 回收率及相对标准偏差
以阴性尿液样品为基质,进行2.0、5.0、10.0 µg/L 3个水平的加标实验,计算回收率和相对标准偏差(RSD,n=6),结果见表2。由表可见,本方法的回收率为78.6%~114%,RSD为0.60%~18%。方法准确度及精密度良好,可用于尿液中磺胺、喹诺酮、四环素3类抗生素残留的筛查与定量检测。
2.5 实际样品测定
对采集的280 份北京市健康儿童、青少年的尿液样本进行检测,均未检出相关抗生素残留。检测对象为健康人群的尿液样本,故抗生素暴露来源于膳食摄入,该检测结果与北京市近年来食品安全风险监测的兽药残留监测数据相一致。在实际样本检测过程中,以每70 份样本加做6 个平行回收进行质量控制,在5.0 µg/L的加标水平下,方法回收率在80%~100%之间,RSD值小于10%。
3 结 论
本文基于超高效液相色谱-串联质谱法成功测定了尿液中的3 类共45 种抗生素,建立的方法简单准确,为人体生物基质中抗生素的检测提供了新思路。

