电性矿物强化脱氯菌对水中TCE的降解
李铁龙,谭 鹏,王 薇, 2
电性矿物强化脱氯菌对水中TCE的降解
李铁龙1,谭 鹏1,王 薇1, 2
(1. 南开大学环境科学与工程学院,天津 300350;2.南开大学沧州渤海新区绿色化工研究院,沧州 061108)
针对地下水环境中脱氯菌污染修复周期长、电子供给难度大、易带来二次污染等问题,设计以天然矿物电气石的电场刺激、水解供氢和水体调节性能强化含脱卤拟球菌(spp.)的混合脱氯菌功能,通过将电气石和脱氯菌共同固定化,开发适用于地下水环境的生物强化原位修复技术.研究了共同包埋的电气石和脱氯菌对地下水典型有机污染物三氯乙烯(TCE)的降解性能.结果表明,在包埋材料海藻酸钠含量6%、凝固剂氯化钙含量6%、电气石含量1.0%、交联时间24h 条件下制得的固定化微球弹性好,机械强度高,粒径均匀分布在3~5mm,具有多孔洞内结构和较为致密的外表面,既可提供电气石和细菌附着的场所,又能有效地防止微球内部菌体的流失.同时,包埋后的电气石仍能快速调节水体的pH和ORP,为厌氧脱氯菌提供适宜的生长代谢环境.无论是固定化还是分离体系,电气石的加入均增强了脱氯菌对TCE的还原脱氯效果,而电气石-脱氯菌共同固定化体系不仅能加快TCE 的降解,在无外加电子供体的情况下仅180h即可将16mg/L的TCE完全去除,还显著促进了中间产物的进一步脱氯,反应800h时终产物乙烯的转化率达到64%,比菌体系提升了1倍.电气石对共同包埋的脱氯菌更有效地起到了电场刺激和电子供体的作用,使其快速稳定的增殖.该复合固定化的应用方式促进了脱氯菌的富集及与电气石的接触,更加充分地发挥了电气石表面电场的直接和间接强化作用,可解决实际地下水修复过程中微生物和强化剂易分离失效的问题,促进地下水有机污染原位生物修复技术的发展.
电气石;脱卤拟球菌;固定化;三氯乙烯;产乙烯
作为一种重要的工业有机溶剂,三氯乙烯(TCE)在化妆品制造、制药、油漆、造纸、金属工艺、冰箱制冷剂等领域的广泛应用和不合理处置使其在环境中不断累积,污染了大气、地表水、土壤以及地下水.TCE密度比水大,能迅速迁移到地下,在重力作用下垂直迁移形成污染羽,随后由于毛细作用力、吸附、介质空间差异和溶解等作用分散在水和土壤之间,长期威胁饮用水安全[1-2].
作为溶解力最强的一种有机氯溶剂,TCE对人体和动物等都具有明显的毒性作用;可通过呼吸道、皮肤或消化道引起中毒,临床表现为神经系统功能紊乱,心脏、肝、肾受损,头痛、恶心、视、味觉产生障碍,食欲下降,记忆力减退,皮肤损伤等[3-4].美国环境保护署(USEPA)于1976年已将其列入“优先控制化合物”,欧共体的“黑名单”和中国环境优先监测和控制污染物中也都包括TCE.
TCE已成为国内外地下水环境中分布最广、检出率最高的有机污染物之一.荷兰于20世纪80年代对本国232个地下水抽水站检测发现,TCE检出率达67%.美国环保局在对39 个小城镇的供水水源地取样检测发现了11种挥发性氯代有机物,其中检出率最高的是TCE(36%).日本15个工业城市中发现约30%的供水井受到不同程度的TCE污染[5].对我国69个城市的地下水污染检测发现,有机污染指标中检出率最高的也是以TCE为代表的挥发性卤代 烃[6].张达政等[7]对我国某地区地下水中TCE进行检测,检出率在20%~70%之间.李海明[8]发现我国北方某城市地下水超标率最高的TCE(超标14.38倍)最大浓度高达956.6μg/L.
在地下水有机污染修复中,原位生物技术具有成本消耗低和对生态环境影响小等方面的优势.虽然环境中广泛存在一些厌氧菌种可以TCE为电子受体,但它们对TCE的降解并不彻底,往往止步于毒性更强的中间产物二氯乙烯(DCE)或氯乙烯(VC)[9-10].产乙烯脱卤拟球菌(spp.)是目前发现的唯一能将TCE彻底还原脱氯为无毒产物乙烯(ETH)的菌属[11-13].此类TCE降解菌以H2或产氢有机物(如甲醇、乙酸、乳酸等)为电子供体,并仅以H2作为其代谢的最终电子供体[14-16].然而H2的溶解度低、难以在地下水中进行传质,其易燃易爆性也增大了供氢操作的难度,有机电子供体又易带来二次污染问题.因此在氯乙烯污染场地采用原位生物强化的方法进行现场修复时,如何持续有效地供给脱氯菌所需的电子供体以提高生物活性,促进有毒中间产物的进一步转化是亟待解决的问题.
天然矿物材料电气石(tourmaline)是以含硼为特征的铝、钠、铁、镁、钙的环状结构硅酸盐矿物,晶体结构中构成[Si6O18]复三方环的6个Si-O四面体的角顶指向相同,使其沿c轴存在强大的异性电极,产生自发电场,可电解周围的H2O分子,产生H2和活性羟基负离子OH-(H2O)[17-19].
在促进微生物增殖代谢、提高生物活性方面,提供适宜的微电场刺激是一种相对安全和极具发展潜力的新方法.近年来,学者们开始研究是否能以电气石的矿物自发电场来代替传统电场进行生物强化,证明了电气石能促进.[20]、[21]、[22]、[23]、JH-9[24]、、和[25]等微生物的代谢和增值;提高低温下好氧阶段氨氮的氧化速率和硝酸盐的形成速率,以及缺氧阶段的反硝化速率[26];有利于序批式生物膜反应器中胞外聚合物的分泌[27];并能提升猪粪堆肥过程中的腐殖化程度[28].
以上研究分析电气石的生物强化作用来自于其电场作用下微生物细胞膜渗透性的改变和环境介质中水分子间氢键的破坏,提高了生物大分子的功能和物质的跨膜运输,加快了其对营养物的吸收,促进了细胞的代谢[25,29].笔者首次考察了电气石作用下含spp.菌群的生物效应,发现除了直接的电场刺激外,电气石自发电场作用下水电解产生的氢也可为脱氯菌提供直接的电子供体以显著提升活性[30-31],这为氯乙烯污染的原位修复提供了一种廉价、安全和持久的潜在生物强化方法,将有广阔的发展前景.
但若将电气石作为spp.的强化介质共同应用于地下水环境中,随着地下水的流动,电气石和菌易分散流失,这将是限制矿物表面电场和产氢有效生物利用的关键问题.确保电气石与脱氯菌的高效复合、接触传质,是发挥两者协同作用的前提和重要手段.为解决这一技术应用的瓶颈,本研究将电气石和spp.为主体的脱氯菌群进行共同固定化处理,不仅能对脱氯菌产生富集作用,增强微生物对环境的耐受能力,还可进一步发挥电气石为生物还原脱氯原位提供电场刺激、电子供体和还原环境的强化功能,提供该生物强化技术在地下水环境中高效、便捷的应用方式.电气石独特的自发永久电场可以取代额外电场来施加生物刺激;氢来自水的电解,可在没有矿物消耗的情况下,不断为脱氯菌提供最直接有效的电子供体,避免外加电子供体带来的成本及二次污染问题.通过矿物和菌的固定化确保原位电场强化和电子供应,可为解决地下水TCE原位生物修复的瓶颈问题提供一条绿色、经济的新途径.
笔者研究了脱氯菌和电气石的固定化方法,选择海藻酸钠作为载体,采用包埋法对电气石和脱氯菌群进行共同固定.通过比较成球状况、机械强度、渗透性等选择固定化微球的适宜制备条件;验证了电气石包埋后对环境水体性能的调节能力;比较了分离和固定化脱氯菌/电气石体系降解TCE的性能;并结合不同电子供体的体系脱氯过程分析了脱氯菌和电气石共同固定化后的优势和性能强化机理.
1 材料与方法
1.1 试剂与仪器
主要试剂:四水合氯化亚铁(FeCl2·4H2O)、九水合硫化钠(Na2S·9H2O)、碳酸氢钠(NaHCO3)、海藻酸钠(SA)和无水氯化钙(CaCl2)均为分析纯,购自天津市江天化工技术有限公司;三氯乙烯(TCE)、顺-1,2-二氯乙烯(-1,2-DCE)、氯乙烯(VC)、乙烯(ETH)和甲醇购自北京百灵威科技有限公司;电气石购自天津鸿雁天山石业纳米有限公司.
张洁等[3]利用鱼骨图从环节、护士、患者、环境四个方面找出导致患者液体出入量记录不正确的多种原因,并采取要因论证的方法,最终确定与护士相关的主要因素为估算标准不统一:(1)记录方法不统一;(2)液体出入量记录流程不规范;(3)上级部门监督力度不够。测量工具的问题:(1)测量工具不准确;(2)量具不清洁;(3)量具消毒不规范;(4)测量时光线不足致看不清。上述研究与刘世美等[4]调查结果一致,考虑到此次调查对象为危重症患者,因病情危重,自理能力较差,患者自身对出入量记录的影响较小,结合调查中出入量记录时存在的具体错误情况,主要为护士自身、测量工具及管理制度的问题,现总结如下。
主要仪器:日本岛津GC-2000plus气相色谱仪,德国徕卡(Leica)AF7000活细胞工作站,德国蔡司MERLIN Compact(6164)型扫描电子显微镜(SEM),瑞士梅特勒DELTA320pH计,LE501 ORP复合电极,上海比朗仪器有限公司CHA-S气浴恒温振荡器.
1.2 实验菌株的培养
含spp.的混合脱氯菌液由美国Rice大学提供,菌种从氯乙烯污染场址中提取后经实验室驯化培养.混合菌液置于500mL的血浆瓶中进行间歇式厌氧培养.培养液由10g/L NaHCO3及基础盐、微量元素储备液各10mL加入灭菌去离子水中配置,后经高纯氮气吹脱30min进行除氧处理.另加入40mg/L FeCl2·4H2O和300mg/L Na2S·9H2O作为培养液的还原剂.菌液每天加入50mg/L的TCE(以体积比为1∶5溶于甲醇中)进行活化;每隔4d 移去培养体系中10%体积量的混合液,以相同量的新鲜培养液替换,水力停留时间为40d.
1.3 固定化微球的制备
电气石粉用稀盐酸(0.1mol/L)浸泡30min后清洗、真空干燥备用;取6g海藻酸钠溶于80mL去离子水中,120℃处理30min后冷却至室温静置4h;取20mL脱氯菌液和/或电气石粉体,用氮气脱除溶液中的残留氯化物后与上述材料混匀,连通恒流泵滴入CaCl2溶液中,形成微球;将获得的微球置于冰箱中4℃交联一定时间,使用前用灭菌的生理盐水(0.9%)清洗去除交联剂.制备的微球缩写如下:海藻酸钠微球(SA)、电气石微球(SA-T)、脱氯菌微球(SA-D)、电气石-脱氯菌微球(SA-TD).
1.4 TCE的降解反应
将制备的微球或等量电气石粉体/脱氯菌加入100mL密封棕色反应瓶中,体系中电气石使用量为1.0g/L,与50mL含16mg/L TCE的模拟地下水溶液(无氧)混匀后置于恒温振荡器中,在温度22℃、转速110r/min条件下振荡反应,间隔一定时间用气密进样针从反应瓶中顶空取气样100µL,用气相色谱仪测定TCE及其还原脱氯产物的含量.
2 结果与讨论
2.1 固定化微球的组分配比确定
在固定化微球制备过程中,包埋的组分配比条件会影响微球的物理特性.以形状、粘连及拖尾衡量成球状况;振荡后的破碎情况来反映微球的机械强度;浸渍酸性蓝93后横切面染色情况指示微球的渗透性.综合表1的分析结果,选用SA、电气石、CaCl2含量分别为6%、1.0%和6%,交联时间为24h作为后续包埋制备的组分配比.
表1 反应条件对固定化微球物理特性的影响

Tab.1 Effect of reaction conditions on the physical prop-erties of the immobilized microspheres
注:数字代表微球各性能的效果:1—较差;2—一般;3—好;4—很好.
优化条件下制备的固定化微球形状均匀,粒径分布于 3~5mm(图1).用SEM 观察微球结构发现,SA颗粒外表面有较为致密的球壳,内部布满蜂窝网状孔道(图 2).这种多孔洞微细结构有利于电气石和细菌的附着以及基质的传递,致密的外表面能有效防止菌体的外流.SA-T微球表面产生了一些纳米级微孔,这为污染物的进入提供了通道.电气石和微生物共同包埋的SA-TD球体更为致密,表面粗糙度提高,同时表面多孔结构利于污染物的传递和代谢产物的输出.

图1 制备微球的形貌
2.2 电气石微球调节水体性能研究
含spp.的混合脱氯菌群适宜在弱碱性厌氧环境中生存,水体环境的改变将直接影响菌群的生长和代谢情况.以往的研究发现电气石粉体具有自发调节水体pH值的功能,为分析固定化后的电气石是否仍具有调节脱氯菌生理生化环境的功能,笔者考察了电气石微球对水环境pH值和氧化还原电位(ORP)的影响,结果如图3所示.
测试不同电气石含量的SA-T调节酸性、中性、碱性水体pH的能力发现,不同电气石含量的微球均能使酸性水体(pH=3.5)显著提升至近中性、中性水体(pH=7)趋于弱碱性,碱性水体(pH=11)下降,显示水能穿过微球孔道与包埋的电气石发生作用.而这种调节能力随微球中包埋的电气石含量增加呈先升高后降低的趋势.如添加含0.2%、0.5%、1.0%、2.0%、4.0%电气石微球中性体系反应120min后的pH值分别升至7.47、7.78、7.85、7.86、7.56.这可能是由于包埋过多的电气石会堵塞微球内的孔道,影响其与水的接触传质.

图3 电气石微球对水体pH和ORP的影响
比较SA-T与中性水混合30min前后体系的ORP,观察到电气石被固定至微球内部后仍能显著降低水体的ORP,含0.2%、0.5%、1.0%、2.0%、4.0%电气石微球分别将水体的ORP降低了41.3%、51.1%、56.7%、60.8%、56.4%.可见包埋后的电气石仍具备提供宜于厌氧脱氯菌群生存的水体环境的作用.
电气石对水体性质的调控作用一方面是由矿物破碎过程中,价键断裂而造成表面裸露着的OH-和金属阳离子(Na+、Mg2+、K+等)引起的.与水接触后,这些离子被极性水分子所吸引,导致水体pH值发生变化,溶液中OH-含量较高时则会抑制OH-的释放[32].金属阳离子的缺失会造成电气石表面荷负电,吸引H+,升高溶液的pH值[33].另一方面,电气石表面几十微米范围内存在着1×104~1×107V/m的静电 场[18],可电解水分子产生H+和OH-(式(1)~(3)).OH-与H2O结合形成活性羟基负离子,H+从电场中获得电子生成H2,使水的ORP降低.
H2O→H++OH-(1)
2H++2e-→H2↑ (2)
OH-+H2O→OH-(H2O)(3)
2.3 固定化微球的TCE生物强化降解性能分析
对比分析了脱氯菌和电气石直接混合体系和固定化体系生物强化降解TCE的性能.如图4所示,各体系中TCE降解速度由快到慢顺序依次为:电气石-脱氯菌微球(D)体系、电气石与脱氯菌游离(B)体系、脱氯菌微球(C)体系、脱氯菌(A)体系.D体系仅在180h即可将TCE完全去除,B体系需要300h,而C、A体系分别需要400h和480h才能完全去除TCE.C体系的降解速率快于A体系,显示菌固定化后产生富集作用,可提升降解性能.D体系相比于C体系和B体系相比于A体系,TCE降解时间分别缩短了55.0%和37.5%,说明电气石的加入增强了脱氯菌对TCE的还原去除能力,相比于分离体系,固定化体系中电气石的生物强化作用更加明显.D体系相比于B体系将TCE的降解时间缩短了40%,也表明将电气石和脱氯菌共同固定后,更好地发挥了电气石的强化脱氯效果.

生物体系中TCE的还原路径为依次脱氯,即顺序降解为DCE、VC和ETH(图4(a)).对各体系中的降解产物进行分析发现,由于DCE降解为VC的速度慢于TCE降解为DCE的速度,而VC向ETH的转化是整个降解过程最缓慢的速度控制步骤[28],中间产物DCE和VC均出现累积过程.D体系中的DCE已呈现出先增加、后逐渐下降的变化趋势,可见共同固定化的电气石也显著促进了脱氯菌降解中间产物的过程,因此积累的DCE开始进一步降解.而其他体系中的中间产物降解较慢,反应800h时DCE还没有出现明显的下降现象.此时,A体系中的DCE积累量最高,然后依次为C和B体系,可见对中间产物降解的促进作用也是固定化体系高于未固定化体系、有电气石体系高于无电石气体系.由于整个脱氯过程中VC向ETH的转化最为缓慢、电气石和脱氯菌共同固定的D体系中的DCE更快转化,其VC的积累量略高于其他三体系,该体系终产物ETH的产量最高,为单纯菌体系的近2.0倍.A、B、C、D体系中最终产物ETH的转化率分别为33%、45%、41%、64%.
考察电气石剂量对固定化微球降解效果的影响(图5)发现,使用0.5、1.0、2.0g/L 3种电气石剂量制备的微球降解TCE时,TCE完全降解所需要的时间分别为300h、180h和240h.其中1.0g/L和2.0g/L体系中DCE均在出现峰值后开始降低,反应800h时1.0g/L体系中DCE的积累量最低,仅为18%,此时VC和ETH的产量也最高.可见,随着电气石用量的增加(从0.5g/L到1.0g/L),更强的电场和供电子效应使对TCE生物还原脱氯过程的强化推动作用提升.但当微球中的电气石进一步增多(从1.0g/L到2.0g/L)时,生物强化作用减弱,这可能是由于过多的电气石会占据微球的孔隙,降低微球的渗透性,阻碍反应物的传输,导致脱氯菌对TCE的还原作用减弱.
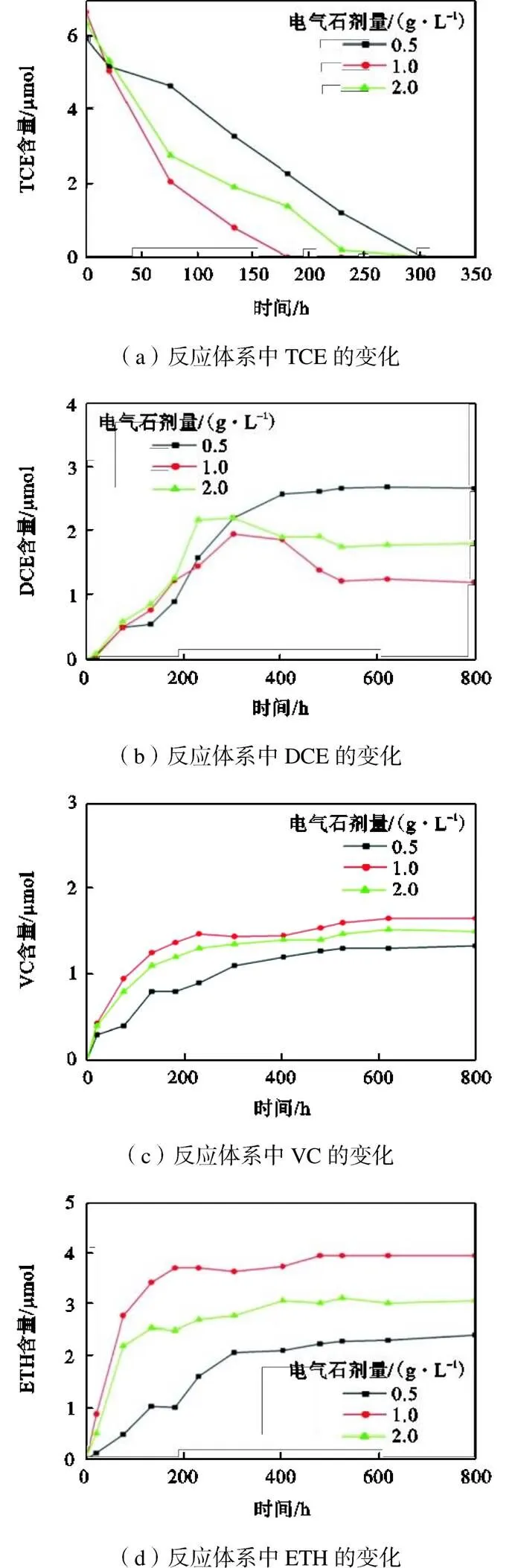
图5 不同电气石剂量微球对TCE 的降解性能
为考察菌石共同固定化微球的长效稳定性,将反应800h 后1g/L体系中的微球取出清洗后重新加入TCE,进行了两轮重复降解实验(图6).在反应180h时,第1次反应体系中TCE已完全去除,第3次反应中此时的TCE的去除率为 80%,中间产物的产量略有降低,乙烯的产率仅下降了10%.反应过程中微球未见明显破损,产生的少量粉末沉淀在下一次实验前被去除.可见,共同包埋的电气石能持续地为脱氯菌提供电性强化和电子供体,使菌群能够长期稳定地发挥更好的降解作用.

图6 菌石微球的重复使用性能
2.4 固定化微球的生物促进机理
为了从微生物的生长状态直接观察电气石的强化作用,在不影响生长环境的条件下,笔者采用活细胞成像技术记录了脱氯菌的增殖情况.选取菌培养周期的0、12、24、48h进行拍摄,对菌体系和电气石/菌复合体系进行对比观察,结果如图7所示.对比两体系中菌的增殖现象,可以发现电气石的加入很大地提 高了体系中脱氯菌的密度.未添加电气石的体系菌量增加较慢,添加电气石的脱氯菌体系中脱氯菌菌量增加明显,且相同时间点的菌分布更加均匀.提取菌液DNA采用定量PCR(qPCR)分析spp.的16S rRNA基因拷贝数,计算得到反应48h 时菌石体系的菌量为菌体系的1.7倍.说明电气石的电场刺激及对脱氯菌生长环境水体性能的调节,都起到了强化菌增殖的作用,促使微生物快速稳定的增长,故而可促进脱氯菌对TCE的还原脱氯,缩短微生物降解TCE所需的时间.
电气石电场电解水可产生氢气这一脱氯菌的直接电子供体.为验证共同固定化微球中电气石为脱氯菌提供电子供体的功能,实验比较了有无外加电子供体的4个微球体系降解TCE的过程.如图8所示,由于没有专门添加电子供体,仅在TCE溶液中含作为助溶剂的少量甲醇(2μL),菌球体系以极低的速率脱氯,所有TCE在反应400h后才被完全去除,体系中出现中间产物DCE和VC的积累,ETH产量较低.加入50μL甲醇的菌球体系中TCE完全去除的时间缩减近1/2(230h),说明添加于水体中的甲醇能够进入微球,为脱氯菌提供有效电子供体.而值得注意的是,菌石球体系比菌球+甲醇体系的TCE降解速率更快,仅需180h即可完全去除TCE.电气石电场作用下微球中的脱氯菌迅速增值,对电子供体的需求更大,此阶段TCE的快速降解显示菌石球体系中存在甲醇以外的其他电子供体,分析应为电气石的电解产氢,在反应前期能够为脱氯菌提供足够的电子供体.此部分氢气产量应是低于外加50μL甲醇的产氢量,故随着菌群的增值,菌石球体系中间产物的转化要慢于菌球+甲醇体系.可以看到菌球+甲醇体系在反应约600h时DCE已完全去除,而菌石球体系在反应800h时DCE还处于下降阶段.菌石球+甲醇体系在电气石电场强化和充足电子供体的共同作用下,TCE和中间产物的降解速度均明显加快.TCE于140h内去除,DCE仅需300h时就完全转化,此后VC的量也开始明显下降,反应800h时终产物的转化率已达93%.

图7 微生物体系活细胞成像照片
脱氯菌群的氢气需求阈值为(2.2±0.9) nmol/L[34],本研究中,在仅含电气石的微球体系里,180h时产生了107µmol/L H2,而菌石共同包埋微球体系里未检测到H2,也表明微球里的电气石表面电场电解水产生的H2可作为电子供体被共同固定化的脱氯菌利用.

图8 不同电子供体微球体系TCE降解性能比较
以上结果表明,经过与脱氯菌的共同固定化后,电气石的直接电场刺激作用、间接调节水体性能和产氢作为电子供体功能均能在微球结构中更加有效的发挥,以促进混合菌群的代谢增殖,提升其脱氯降解性能.
3 结 语
用海藻酸钠共同包埋电性矿物电气石和含spp.的混合脱氯菌群,在SA、电气石、CaCl2含量分别为6%、1.0%和6%和交联时间为24h条件下获得了具有较好弹性、机械强度和渗透性的固定化微球.复合微球中的电气石能自发调节水体的pH从中性至弱碱性(pH=7.85)并使ORP降低56.7%,形成更有利于厌氧脱氯菌的水介质环境,并通过近距离的电场刺激和电解水原位供氢,促进脱氯菌的快速增殖,显著促进TCE脱氯降解.与单独菌和菌石简单复合体系相比较,菌石球体系TCE去除的时间分别缩短了300h和120h,乙烯的产量提升为2.0倍和1.4倍.证明将脱氯菌群和电气石共同固定化提供了使用廉价、绿色矿物材料强化地下水有机污染生物原位修复的经济、便捷的应用方式.
[1]Kenneke J F,McCutcheon S C.Use of pretreatment zones and zero-valent iron for the remediation of chloro-alkenes in an oxic aquifer[J]. Environmental Science & Technology,2003,37(12):2829-2835.
[2]Mohammad O I,Kibbey T C G. Dissolution-induced contact angle modification in dense nonaqueous phase liquid/water systems[J]. Environmental Science & Tech-nology,2005,39(6):1698-1706.
[3]Mandel J,Kelsh M. A review of the epidemiology of tri-chloroethylene and kidney cancer[J]. Human and Eco-ogical Risk Assessment,2001,7(4):727-735.
[4]Wartenberg D,Reyner D,Scott C S. Trichloroethylene and cancer:Epidemiologic evidence[J]. Environmental Health Perspectives,2000,108(Suppl 2):161.
[5]何江涛,李 烨,刘 石,等. 浅层地下水氯代烃污染的天然生物降解[J]. 环境科学,2005,26(2):122-125.
He Jiangtao,Li Ye,Liu Shi,et al. Chlorinate solvents natural biodegradation in shallow groundwater[J]. Envi-onmental Science,2005,26(2):122-125(in Chi-nese).
[6]高存荣,王俊桃. 我国69个城市地下水有机污染特征研究[J]. 地球学报,2011,32(5):581-591.
Gao Cunrong,Wang Juntao. Research on groundwater organic contamination characteristics in 69 cities of China[J]. Acta Geoscientica Sinica,2011,32(5):581-591(in Chinese).
[7]张达政,陈鸿汉,李海明,等. 浅层地下水卤代烃污染初步研究[J]. 中国地质,2002,29(3):326-329.
Zhang Dazheng,Chen Honghan,Li Haiming,et al. Halogenated hydrocarbon contanminants in shallow groundwater[J]. Geology in China,2002,29(3):326-329(in Chinese).
[8]李海明. 浅层地下水有机污染研究——以某城市近郊为例[D]. 北京:中国地质大学水资源与环境学院,2002.
Li Haiming. Study on Shallow Groundwater Contami-ated by Organic Chemicals in the Suburb of a City[D]. Beijing:School of Water Resources and Environment,China University of Geosciences,2002(in Chinese).
[9]Nelson J L,Fung J M,Cadillo-Quiroz H,et al. A role forspp. in the reductive dehalogenation of dichlorobenzenes and monochlorobenzene[J]. Environ-ental Science & Technology,2011,45(16):6806-6813.
[10]Suyama A,Iwakiri R,Kai K,et al. Isolation and char-acterization ofsp. strain Y51 capable of efficient dehalogenation of tetrachloroethene and poly-hloroethanes[J]. Bioscience,Biotechnology,and Bio-hemistry,2001,65(7):1474-1481.
[11]Maymó-Gatell X,Chien Y,Gossett J M,et al. Isola-ion of a bacterium that reductively dechlorinates tetra-hloroethene to ethene[J]. Science,1997,276(5318):1568-1571.
[12]He J Z,Sung Y,Krajmalnik-Brown R,et al. Isolation and characterization ofsp. strain FL2,a trichloroethene(TCE)- and 1,2-dichloroethene-respiring anaerobe[J]. Environmental Microbiology,2005,7(9):1442-1450.
[13]Löffler F E,Yan J,Ritalahti K M,et al.gen. nov.,sp. nov. ,obligate organo-alide-respiring anaerobic bacteria relevant to halogen cycling and bioremediation,belong to a novel bacterial class,nov. ,orderord. nov. and familyfam. nov. ,within the phylum[J]. Interna-ional Journal of Systematic Evolutionary Microbiology,2013,63(2):625-635.
[14]Yang Y,Mccarty P L. Biomass,oleate,and other pos-ible substrates for chloroethene reductive dehalogena-ion[J]. Bioremediation Journal,2000,4(2):125-133.
[15]Heimann A C,Friis A K,Jakobsen R. Effects of sulfate on anaerobic chloroethene degradation by an enriched culture under transient and steady-state hydrogen sup-ly[J]. Water Research,2005,39(15):3579-3586.
[16]Leys D,Adrian L,Smidt H. Organohalide respiration:Microbes breathing chlorinated molecules[J]. Philoso-hical Transactions of the Royal Society B,2013,368:20120316.
[17]Yamaguchi S. Surface electric fields of tourmaline[J]. Applied Physics A:Solids and Surfaces,1983,31:183-185.
[18]Nakamura T,Kubo T. The tourmaline group crystals reaction with water[J]. Ferroelectrics,1992,137:13-31.
[19]Jin Z Z,Ji Z J,Liang J S,et al. Observation of spon-aneous polarization of tourmaline[J]. Chinese Physics,2003,12(2):222-225.
[20]Qiu S,Ma F,Wo Y,et al. Study on the biological effect of tourmaline on the cell membrane of[J]. Surface and Interface Analysis,2011,43(7):1069-1073.
[21]Wang C P,Yu L,Zhang Z Y,et al. Tourmaline com-bined withto remediate agricultural soil contaminated with PAHs and OCPs[J]. Journal of Hazardous Materials,2014,264:439-448.
[22]Wang W,Jiang H Y,Zhu G Q,et al. Effect of tourma-line on denitrification characteristics of hydrogenotrophic bacteria[J]. Environmental Science and Pollution Re-earch,2016,23:4868-4875.
[23]Xia M S,Hu C H,Zhang H M. Effects of tourmaline addition on the dehydrogenase activity of[J]. Process Biochemistry,2006,41(1):221-225.
[24]Zhang S,Li A,Cui D,et al. Biological improvement on combined mycelial pellet for by tourmaline in SBR process[J]. Bioresource Technology,2011,102(19):9282-9285.
[25]Ni H,Li L,Li H H. Tourmaline ceramic balls stimulate growth and metabolism of three fermentation microor-ganisms[J]. World Journal of Microbiology & Biotech-ology,2008,24(5):725-731.
[26]Han Y H,Qiu S,Zeng H Y,et al. Short-term effects of tourmaline on nitrogen removals and microbial com-unities in a sequencing batch reactor at low tem-eratures[J]. International Journal of Environmental Re-search and Public Health,2018,15(6):1280-1291.
[27]Tan C,Xu H R,Cui D,et al. Effects of tourmaline on nitrogen removal performance and biofilm structures in the sequencing batch biofilm reactor[J]. Journal of Envi-ronmental Sciences. 2018,30(5):127-135
[28]Ren X N,Wang Q,Zhang Y,et al. Improvement of humification and mechanism of nitrogen transformation during pig manure composting with black tourmaline[J]. Bioresource Technology,2020,307:123236.
[29]Shevkunov S V,Vegiri A. Electric field induced transi-tions in water clusters[J]. Journal of Molecular Structure,2002,593(1):19-23.
[30]Wang W,Liu X Y,Li K,et al. Dechlorinating per-formance ofspp. mixed culture en-hanced by tourmaline[J]. Chemosphere,2018,194:9-19.
[31]Li T L,Wen J X,Li B J,et al. Biological effects of tourmaline treatment onspp. during the reductive dechlorination of trichloroethylene[J]. RSC Advances,2021,11:12086.
[32]展 杰,葛炳辉,王 朋,等. 天然热释电材料电气石的微结构及对水的pH影响机理的研究[J]. 功能材料,2009,40(4):556-559.
Zhan Jie,Ge Binghui,Wang Peng,et al. Study on the micro-structure of natural tourmaline and mechanism of its influence on pH value of water[J]. Journal of Func-ional Materials,2009,40(4):556-559(in Chinese).
[33]冀志江,金宗哲,梁金生,等. 电气石对水体 pH 值的影响[J]. 中国环境科学,2002,22(6):36-40.
Ji Zhijiang,Jin Zongzhe,Liang Jinsheng,et al. Influ-ence of tourmaline on pH value of water[J]. China Envi-ronmental Science,2002,22(6):36-40(in Chinese).
[34]Yang Y R,McCarty P L. Competition for hydrogen within a chlorinated solvent dehalogenating anaerobic mixed culture[J]. Environmental Science Technology,1998,32:3591-3597.
Degradation of TCE in Water by Electrical Mineral Enhanced Dechlorination Bacteria
Li Tielong1,Tan Peng1,Wang Wei1, 2
(1. College of Environmental Science and Engineering,Nankai University,Tianjin 300350,China;2. Nankai University Cangzhou Bohai New Area Institute of Green Chemical Engineering,Cangzhou 061108,China)
Focusing on the problems of long pollution recovery period,difficult electron supply,and secondary pollution in groundwater remediation by dechlorination bacteria,this study aimed to strengthen the function of dechlorination bacteria containingspp.by electric field stimulation,hydrolysis hydrogen supply,and water regulation performance of natural mineral tourmaline.By immobilizing tourmaline and dechlorination bacteria together,an enhancedgroundwater bioremediation technology was developed. The degradation of trichloroethylene(TCE),a typical organic pollutant in groundwater,by co-entrapped tourmaline and dechlorination bacteria was examined. The experimental results showed that the immobilized microspheres,which were prepared under the conditions of 6% sodium alginate as the embedding material,6% calcium chloride as the coagulant,1.0% tourmaline,and 24h crosslinking time,have good elasticity,high mechanical strength,and uniform particle size of 3—5mm. They have a porous inner structure and a relatively dense outer surface,which cannot only provide a place for tourmaline and bacteria to attach but also effectively prevent the loss of bacteria inside the microspheres. Moreover,the embedded tourmaline can still rapidly adjust the pH and oxidation-reduction potential(ORP) of water,providing a suitable growth and metabolic environment for anaerobic dechlorination bacteria. The addition of tourmaline promoted the reductive dechlorination of TCE by the dechlorination bacteria in both the immobilization and separation systems. While the tourmaline-dechlorination bacteria co-immobilized system can not only accelerate TCE degradation,completely removing 16mg/L TCE in only 180h without the addition of an electron donor,but also significantly promote the dechlorination of the intermediates. In this system,the conversion rate of the end product ethylene reaches 64% at 800h,which is twice as high as that of the bacterial system. Tourmaline more effectively applies electric field stimulation and acts as an electron donor for the co-embedded dechlorinated bacteria,thus promoting their rapid and stable proliferation. The application mode of co-immobilization enhances the enrichment of dechlorinated bacteria and the contact between bacteria and tourmaline. The direct and indirect strengthening effects of the tourmaline electric field are more fully exerted. This can solve the problem that microorganisms and enhancers are easily separated and invalidated in the groundwater environment and promote the development of in situ bioremediation technology for organic-contaminated groundwater.
tourmaline;spp.;immobilization;trichloroethylene;ethylene production
10.11784/tdxbz202208017
X523
A
0493-2137(2023)11-1177-10
2022-08-12;
2022-10-19.
李铁龙(1976— ),男,博士,副教授,litielong@nankai.edu.cn.Email:m_bigm@tju.edu.cn
王 薇,nkwangwei@126.com.
国家自然科学基金资助项目(22036004);国家重点研发计划资助项目(2018YFC1802002);天津市自然科学基金资助项目(19JCYBJC23400);南开大学沧州渤海新区绿色化工研究院基金项目.
the National Natural Science Foundation of China(No. 22036004),the National Key Research and Development Program of China(No.2018YFC1802002),the Natural Science Foundation of Tianjin,China(No.19JCYBJC23400),Nankai University Cangzhou Bohai New Area Institute of Green Chemical Engineering Fund,China.
(责任编辑:田 军)

