复方苦参注射液联合新辅助化疗对乳腺癌患者免疫功能的影响*
吴海滨 马志强 湛喜梅 李 帅 苗雅云 张冠男 王文胜
乳腺癌病死率高,男性少见[1]。针对乳腺癌的临床治疗以外科手术、化疗、放疗等为主[2,3]。其中,新辅助化疗指在外科手术实施前、放疗实施前进行系统性化疗,可有效杀灭癌细胞,提高外科手术切除率,预防远处转移,使患者临床获益、生存期延长[4]。但是,新辅助化疗实施过程中不良反应发生率高,部分患者较难耐受。中医学对乳腺癌的认识由来已久,中医药辅助乳腺癌临床治疗,可抑制癌细胞生长,还能缓解外科手术/放疗/化疗所致毒副作用。因此,现阶段针对乳腺癌的临床治疗已朝向多学科综合治疗的方向发展,推荐与中医药有机配合[5]。复方苦参注射液(Compound kushen injection,CKI)由苦参(君药)、白土苓(臣药)2味中药提取而制,能清热解毒、行滞止痛等[6]。苦参碱的抗炎、抗癌等多重作用已得到现代药理学研究证实[7]。本研究主要分析对乳腺癌进行CKI联合新辅助化疗的效果。
1 资料与方法
1.1 一般资料选取2021年4月—2022年4月医院收治的乳腺癌患者96例,按照随机数字表法分为2组,对比对照组(48例)与研究组(48例)的一般资料,P>0.05。本研究经医院伦理委员会批准。
表1 2组患者一般资料比较 (例,
1.2 纳入与排除标准纳入标准:①确诊乳腺癌;②能正常沟通;③TNM分期处于Ⅱ~Ⅲ期;④预期生存期>6个月;⑤知情同意。排除标准:①神经系统障碍;②肿瘤远处转移;③视、听、语言障碍;④罹患其他恶性肿瘤;⑤肝、肾等重要脏器功能障碍;⑥对CKI、新辅助化疗存在治疗禁忌。
1.3 方法
1.3.1 对照组新辅助化疗:环磷酰胺(生产商:江苏盛迪医药有限公司,规格:0.5 g,批号:20210109)静脉注射,600 mg/m2+表柔比星(生产商:辉瑞制药(无锡)有限公司,规格:10 mg,批号:20210317)静脉注射,75 mg/m2+多西他赛(生产商:齐鲁制药有限公司,规格:0.5 ml∶20 mg,批号:20210214)经脉注射,75 mg/m2,以21 d为1个周期,连续完成4个周期。
1.3.2 研究组CKI(生产商:山西振东制药股份有限公司,规格:2 ml)联合新辅助化疗(同对照组)。CKI 20 ml+生理盐水250 ml,静脉注射,1次/d,以21 d为1个周期,连续完成4个周期。
1.4 观察指标
1.4.1 近期疗效完全缓解(Complete remission,CR)为患者全部病灶消失且维持至少4周、部分缓解(Partial remission,PR)为患者基线病灶最大径总和缩小>30%且维持至少4周、疾病稳定(Stable disease,SD)为介于PR与PD之间、疾病进展(Progressive disease,PD)为患者基线病灶最大径总和增加>20%,或已有新的病灶出现。客观缓解率(Objective response rate,ORR)=CR+PR,疾病控制率(Disease control rate,DCR)=CR+PR+SD。
1.4.2 血清肿瘤标志物表达治疗前后,空腹采血5 ml,3000 r/min离心15 min,取血清,以酶联免疫吸附法检测癌胚抗原(Carcinoembryonic antigen,CEA)、糖类抗原125(Carbohydrate antigen 125,CA125)、糖类抗原153(Carbohydrate antigen 153,CA153)。
1.4.3 免疫功能治疗前后,以流式细胞仪(美国Becton Dickinson公司,FASCCAN型)、免疫透射比浊法检测CD4+、CD3+、CD4+/CD8+。
1.4.4 癌组织中Survivin 细胞核增殖抗原(Proliferating cell nuclear antigen 67,ki-67)蛋白表达治疗前、后,检测癌组织中survivin(+)、ki-67(+)的构成比。
1.4.5 不良反应统计有无发生骨髓抑制、消化道反应、脱发、白细胞减少、血红蛋白降低。
1.5 统计学方法数据分析用SPSS 23.0。计量资料符合正态分布的,用均数±标准差表示,行t检验;计数资料用率(%)表示,行χ2检验。P<0.05差异有统计学意义。
2 结果
2.1 近期疗效研究组ORR高于对照组(P<0.05),研究组DCR与对照组差异无统计学意义(P>0.05)。见表2。
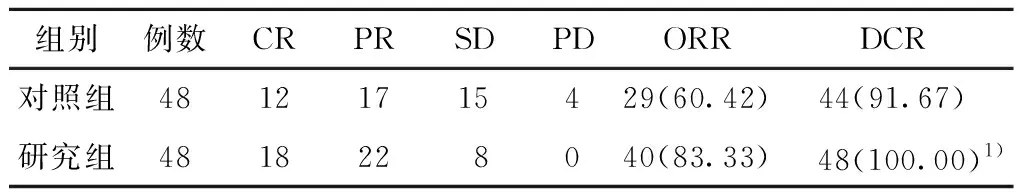
表2 2组患者近期疗效比较 (例,%)
2.2 血清肿瘤标志物表达治疗后,2组的CEA、CA125、CA153低于治疗前(P<0.05),且研究组低于对照组(P<0.05)。见表3。

表3 2组患者血清肿瘤标志物表达比较 (例,
2.3 免疫功能治疗后,对照组的CD4+、CD3+、CD4+/CD8+低于治疗前(P<0.05),研究组的CD4+、CD3+、CD4+/CD8+高于治疗前(P<0.05),且研究组高于对照组(P<0.05)。见表4。

表4 2组患者免疫功能比较 (例,
2.4 癌组织中Survivin ki-67蛋白表达治疗后,2组的Survivin(+)构成比、ki-67(+)构成比均低于治疗前(P<0.05),且研究组低于对照组(P<0.05)。见表5。

表5 2组患者癌组织中Survivin ki-67蛋白表达比较 (例,%)
2.5 不良反应研究组的各不良反应发生率均低于对照组(P<0.05)。见表6。

表6 2组患者不良反应比较 (例,%)
3 讨论
乳腺癌与古代医籍记载的“乳岩、乳癖”等十分相似,相关描述如“聚结成核,初如豆大,渐若棋子……渐渐而大,始生疼痛……日后肿如堆栗,渐渐溃烂,深者如岩穴……名曰乳岩”(《外科正宗》)、“若初起,内结小核……此属肝脾郁怒,气血亏损,名曰乳岩”(《妇人大全良方》)、“若夫不得于夫……脾气消阻,肝气横逆,遂成隐核……名曰奶岩”(《格致余论》),可见,“痰”“虚”等均是乳腺癌发生的重要因素。现代中医研究指出,化疗同样可耗伤正气、阴液,气血无力运行,促进痰、瘀、邪、癌毒内侵经脉,伤及脏腑,致津亏阴虚,经络受损,水湿停运,留结成痰,痰、瘀日久化热,加重癌毒。因此,对行新辅助化疗的乳腺癌患者来说,要固本扶正、解毒益气。纯中药制剂CKI能清热解毒、行滞止痛等,临床上常用于癌肿疼痛[8]。研究发现,CKI对H22肝癌荷瘤小鼠[9]、原位肺癌小鼠[10]、宫颈癌海拉细胞[11]显示出肯定的肿瘤生长抑制作用。现代药理学表明,CKI富含活性抗癌成分,例如氧化苦参碱[12]。苦参总碱是CKI的主要活性抗癌成分之一,其能影响端粒酶,杀灭恶性肿瘤细胞,加速肿瘤细胞凋亡[13]。
本研究中,研究组ORR高于对照组,DCR与对照组差异无统计学意义(P>0.05)。提示CKI联合新辅助化疗能提高乳腺癌近期疗效。CEA、CA125、CA153是常见的肿瘤标志物,表达水平高低与乳腺癌严重程度有关[14-16]。本研究观察了CEA、CA125、CA153治疗前后变化,可知,CKI联合新辅助化疗治疗乳腺癌,能下调血清肿瘤标志物。细胞免疫在乳腺癌等肿瘤疾病产生、病情进展等方面均发挥着重要作用。受疾病本身、化疗等影响,机体免疫功能下降。因此,需重视改善乳腺癌患者的免疫功能。T淋巴细胞,是反映机体免疫功能的常用指标[17]。本研究中,对照组治疗后的CD4+、CD3+、CD4+/CD8+低于治疗前(P<0.05),表明,新辅助化疗可影响乳腺癌患者免疫功能,呈免疫抑制状态。而治疗后研究组的CD4+、CD3+、CD4+/CD8+高于治疗前,且研究组高于对照组(均P<0.05)。结果说明,CKI联合新辅助化疗在抗肿瘤的同时,能改善乳腺癌患者的免疫功能。CKI中的活性成分氧化苦参碱、苦参碱均能增强机体抗毒效应,调节细胞免疫[18]。
Survivin在癌组织中均有表达,可促进肿瘤发生,与肿瘤病情进展、患者预后均有关[19]。依据Ki-67表达情况可辅助判断细胞增殖能力,其多表达于增殖细胞的细胞核内,可用于评估新辅助化疗的敏感性[20]。结果说明,CKI联合新辅助化疗治疗乳腺癌,能下调癌组织中Survivin(+)、ki-67(+)蛋白表达。采用新辅助化疗治疗乳腺癌,可杀灭肿瘤细胞,然而因该方法选择性差,治疗期间不可避免伤及正常细胞,带来不良反应,部分患者恐难耐受。中医药起效较缓、作用时间持久,与新辅助化疗周期长、时间久的特点相符。因此,为保证新辅助化疗顺利、安全,有必要寻找一种中药药物辅助治疗,以增毒减效,提高患者新辅助化疗依从性,达到治病目的。本研究中重点观察了CKI联合新辅助化疗能否减少不良反应,从统计结果可以看出,2组乳腺癌患者经治疗后均出现程度不一的不良反应,然而,研究组同时联合CKI治疗,结果显示:研究组的各不良反应发生率均低于对照组。说明,CKI联合新辅助化疗治疗乳腺癌,可有效缓解消化道反应、脱发、白细胞减少等不良反应。这是由于CKI中苦参富含多种活性成分,例如苦参碱,其能降低新辅助化疗的毒性作用,故安全性尚可。
综上所述,CKI联合新辅助化疗能改善乳腺癌患者的免疫功能,下调血清肿瘤标志物与癌组织中Survivin(+)、ki-67(+)蛋白表达,提高近期疗效,且不良反应少。但本研究仅限于本地一家医院,且样本量有限,可能使结果存在偏倚,后续还将开展多中心、大样本研究。

