三阳性乳腺癌的强化辅助治疗方案选择
李晨希,查卓岑,李 娜,罗 琳,杨 扬,陈文林
(云南省肿瘤医院/昆明医科大学第三附属医院乳腺外三科,云南 昆明 650118)
根据2022 年的癌症统计数据[1],乳腺癌依然是全球第1 大癌症,女性乳腺癌的发病率继续以每年约0.5%的速度缓慢增长,是女性癌症死亡的第2 大原因,仅次于肺癌。雌激素受体(estrogen receptor,ER)具有核(基因组)和非核(非基因组)功能,是乳腺癌的主要驱动因素,在大约四分之三的乳腺癌中表达,而HER2 基因扩增仅在12%~15%的病例中存在[2]。如果雌激素受体(ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体(HER2)共同表达为阳性的乳腺癌通常称为“三阳性乳腺癌(triple positive breast cancer,TPBC)”。TPBC 乳腺癌的发病率占乳腺癌亚型的10%~15%[3]。在HER2 过表达的乳腺癌中,TPBC 的发病年龄更早(48.0 岁 VS 54.3 岁,P<0.05),而且其中PIK3CA 突变率更高,TP53 突变率更低,TPBC 与HER2+乳腺癌之间存在着生物学的异质性[4-5]。ER 通路和HER2信号通路之间的串扰(crosstalk,CT)是TPBC 在抗HER2 靶向治疗或内分泌治疗时引起耐药的主要原因,治疗时可能互相干扰信号传导,靶向和内分泌治疗无法兼顾。因此,优先治疗和串扰的关键机制也在不断的研究中。
虽然抗HER2 靶向治疗药物扭转了HER2 阳性乳腺癌的治疗格局,但是曲妥珠单抗1 a 标准辅助治疗后,15%~25%的患者仍出现复发[6],约40%~60%的患者可以达到病理完全缓解(pathologic complete response,pCR)[7-9]。一些探索性强化治疗尝试如将曲妥珠单抗治疗延长至2 a,或曲妥珠单抗与拉帕替尼(HER1 和HER2 双重抑制剂)或贝伐珠单抗(抗血管内皮生长因子单克隆抗体)联合使用,均未得到加倍的临床获益[10],而奈拉替尼序贯曲妥珠单抗证明了强化辅助治疗的可行性[10]。对于HR+/HER2-乳腺癌,内分泌治疗是主要的辅助治疗手段,单药5 a 内分泌治疗似乎不能满足所有患者的生存需求,高达30%的患者发生癌症复发[11],强化或者延长辅助内分泌治疗的理论也已经融入临床治疗中。
目前,仅给予抗HER2 治疗对于TPBC 尚有不足。一定原因在于既往研究中TPBC 往往都被归类在HER2+乳腺癌中,多在临床试验亚组分析中进行讨论,并没有针对这个分型进行独立的临床试验,近年来关于TPBC 的临床试验,见表1。目前指南[12]推荐的治疗方案也多为抗HER2 靶向联合化疗。尽管抗HER2 靶向药物的出现彻底改善了HER2 阳性乳腺癌的治疗现状,但TPBC 患者病情进展后,其治疗相对比较困难,完成标准辅助强化治疗或称为辅助附加治疗,日益受到肿瘤医生的关注。由于HER2+是独立预后因素[13],靶向升级和内分泌强化治疗已经受到重视。此外,对于那些在新辅助治疗后未达到pCR 的高危患者,需要进行强化治疗。强化治疗方案的选择需要遵循现有的临床试验证据。

表1 TPBC 临床研究Tab.1 Clinical Research about TPBC
1 TPBC 耐药重要的ER/HER 通路串扰的分子机制
HR+/HER2+乳腺癌通常早期对内分泌治疗和/或HER2 靶向治疗有反应,但一旦病情进展和出现耐药,多线治疗的缓解时间均有限。ER 和HER2 信号通路之间的串扰以及其他下游通路的参与,如PI3K 和MAPK,可以导致肿瘤在整个治疗过程中改变进程。HER2 的过度表达(或HER2下游信号通路)可干扰ER 的表达和活性,成为HR+乳腺癌中过度表达HER2 的潜在逃逸途径,从而导致内分泌抵抗状态。过表达HER 信号激活的下游激酶(Akt、MAPK)在mRNA 和蛋白水平上都会逆调节降低ER 的表达[14]。Akt 使代表ER 基因转录的关键调控因子的蛋白FOXO3a 失活,从而下调ER 表达信号,而MAPK 的激活直接导致ER 降解,同时,这些下游激酶(Akt、MAPK)使ER 及其辅助调节因子(AIB1 等)磷酸化,使他莫昔芬等SERM(选择性雌激素受体拮抗剂)的药理作用从拮抗作用转变为激动性作用,从而导致他莫昔芬耐药性。另一个重要的机制,MAPK、PI3K 等HER 信号转导成员可以与ERβ 相互作用,削弱其拮抗雌激素(E2)刺激ERα 增殖的能力,从而削弱其对肿瘤的生长抑制作用[15]。HER通路对ER 表达水平施加的这种负面调控作用的一个潜在后果是SERM 内分泌治疗敏感性的降低。而反过来,有效阻断HER 通路会导致HER2+乳腺癌中ER 水平的增加或恢复,而重新激活的ER信号又可以成为导致抗HER2 耐药的逃逸途径。经过拉帕替尼和曲妥珠单抗处理后的HER2+乳腺癌细胞中,ER 或其下游信号靶点增加[16]。18%的HER2+/ER-乳腺癌经过新辅助拉帕替尼治疗2周后转化为HER2+/ER+[17],表型的转变可能是ER 和HER2 通路之间串扰导致的ER 信号增加成为了抗HER2 治疗耐药的逃逸途径。ER 通路和HER2 信号通路之间的串扰机制示意图,见图1、图2。
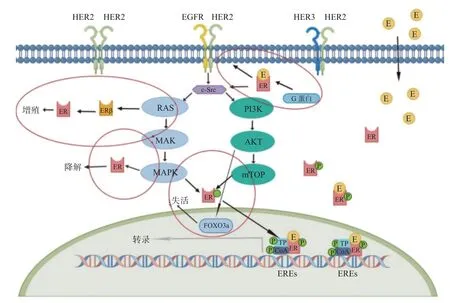
图1 ER 通路和HER2 信号通路之间的串扰机制(1)Fig.1 Crosstalk mechanism between ER pathway and HER2 signaling pathway(1)
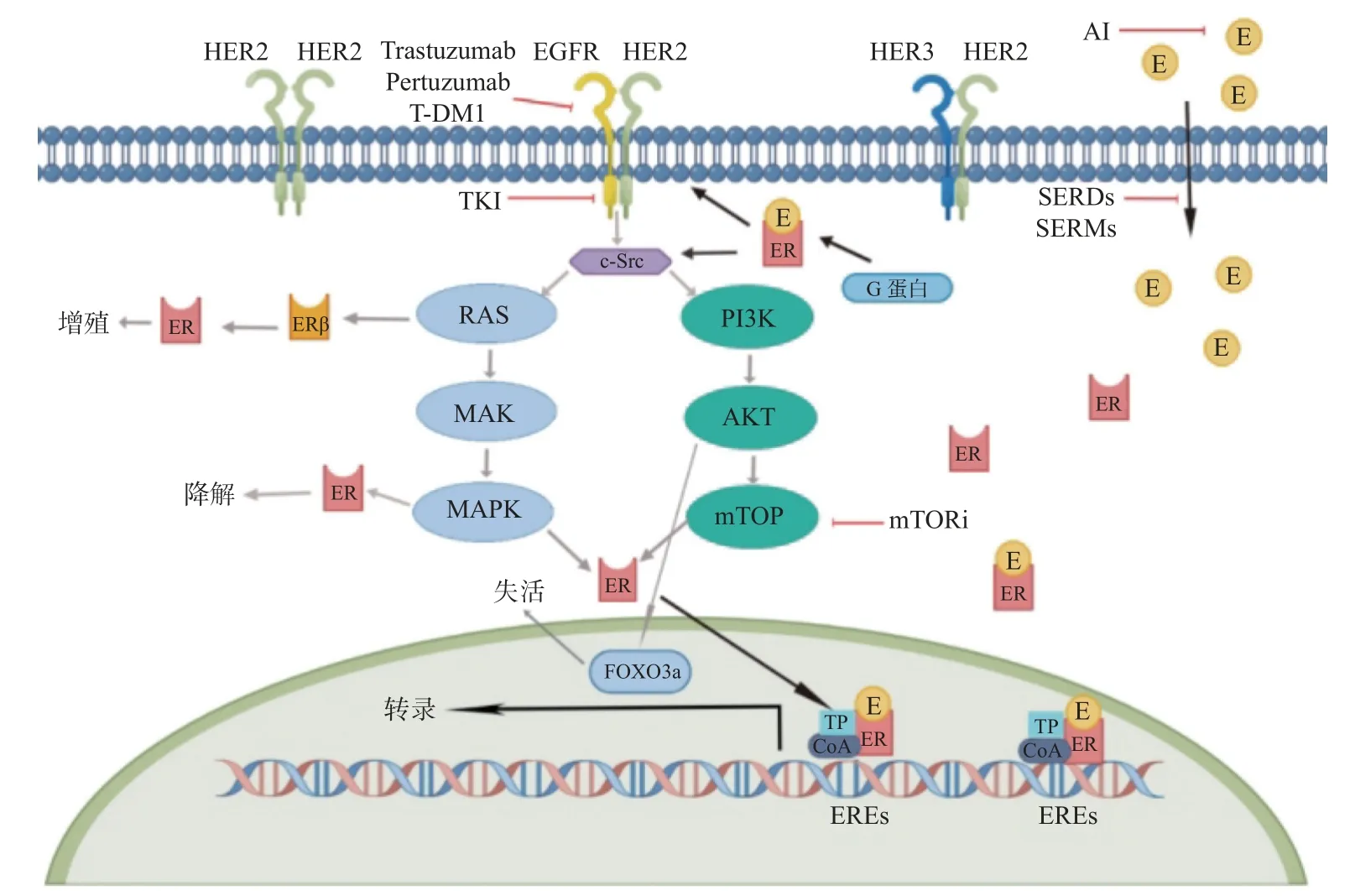
图2 ER 通路和HER2 信号通路之间的串扰机制(2)Fig.2 Crosstalk mechanism between ER pathway and HER2 signaling pathway(2)
ER 与HER 信号通路通过其细胞膜和核,同时存在干扰,可以与HER 信号成员(PI3K、AKT、MAPK、RAS 等)相互作用并激活。与雌激素结合之后,非核雌激素受体(ER)直接或间接(通过G蛋白)与HER2/HER1-4 二聚体相互作用,激活其下游的Ras-MAPK 和PI3K-Akt 通路,进而使ER 和其他转录因子(transcription factor,TF)和辅助激活/辅助抑制因子(Co activation/Co restrain factors,CoA/R)磷酸化,调节基因表达[18]。此外,ER 可以刺激涉及酪氨酸激酶c-Src 和其他HER下游信号成员的信号级联[19]。雌激素信号还可以增加生长因子的表达,如转化生长因子-α(transforming growth factor-α,TGF-α)和胰岛素样生长因子1(insulin-like growth factor 1,IGF1)[20]。另一方面,研究表明,ER 信号可以下调HER1和HER2 的表达,增加IGF1 受体的表达[20-21]。这种ER 诱导的替代生长因子受体通路的过度活动是抗HER2 靶向治疗有效的逃逸原因。ER 和HER2 信号网络之间的所有这些复杂的双向分子环路都可以“共同促进、相互伤害”,对这2 个关键通路的治疗耐药性的产生,今后在潜在“二合一”的靶点的发掘和药物研究中仍需进一步探索。
2 TPBC 的临床治疗
TPBC 的pCR 不高,且易复发和转移,需要通过强化或者附加辅助治疗来改善预后。Katherine[22]研究了在曲妥珠单抗进行新辅助化疗后未达到pCR 的患者辅助性给予T-DM1 的疗效。经亚组分析证实,T-DM1 在激素受体状态、淋巴结状态以及新辅助抗HER2 方案的应用下,其疗效均保持一致。因此,在三阳性乳腺癌患者中,如果新辅助没有达到pCR,采用T-DM1 治疗将会取得良好的疗效,改善新辅助治疗的整体结果,使新辅助治疗更有意义,non-pCR 成为新辅助治疗后强化治疗的重要决策点。在已经公布的HR+/HER+晚期乳腺癌包含TDM-1 的临床研究中,尚未找到早期乳腺癌TDM-1 与内分泌治疗联合治疗的证据,期待NCT02657343 临床研究[23]的后续结果,也许non-pCR 的TPBC 晚期临床试验,可在T-DM1 中进行探索。
ExteNET 研究[24-25]主要评估了2 840 例HER2阳性乳腺癌患者的2 a 和5 a DFS,其中HER2+/HR+患者1 631 例(57.4%),入组的是复发风险高(Ⅱ-Ⅲ期、淋巴结阳性、新辅助治疗后未达pCR)的患者,在曲妥珠单抗辅助治疗后继续使用1 a奈拉替尼。在完成1 a 曲妥珠单抗单药治疗后,与安慰剂相比,经过1a 的奈拉替尼强化辅助治疗,2 a 和5 a 的浸润或死亡风险分别为33%和27%,2 a iDFS 率为93.9%、91.6%,5 a iDFS 率为90.2%、87.7%。其中,HR 阳性亚组的侵袭性无病生存的HR 为0.60(95%CI0.43~0.83),而在HR 阴性的患者中,侵袭性无病生存的HR 为0.95(95%CI0.66~1.35)。因此,TPBC 新辅助治疗后淋巴结阳性、HR 阳性和NonpCR 的患者使用奈拉替尼强化辅助治疗可显著获益。2021 年的ESMO 会议[26]公布了奈拉替尼强化辅助治疗对复发风险高的HER2 阳性、HR 阳性早期乳腺癌疗效的进一步结果。奈拉替尼能有效降低浸润或死亡风险,延长HER2 阳性早期乳腺癌患者或复发风险高的早期TPBC 患者生存期。2022 版COSO指南[27]新增“强化辅助治疗”章节,对所有淋巴结阳性患者,序贯奈拉替尼是一种强化治疗方案,无论是采用H 单靶还是HP 双靶,都被推荐为(I/II 级推荐)。对于绝经前的患者,奈拉替尼是否联合内分泌治疗更能提高疗效,这个猜想将在临床实践中得到验证。
3 强化内分泌治疗
Luminal 型通常认为预后较好,但如携带了Her-2 基因扩增,即使没有腋窝淋巴结转移也被认为是中危患者,CSCO 和CBCS 建议,在绝经前,应该采用靶向治疗,并结合使用卵巢功能抑制药物联合他莫昔芬或芳香化酶抑制药物,以达到最佳治疗效果。目前,MonarchE 研究[28]显示在HR+/HER2-乳腺癌患者中,与单独ET 组相比,ET+阿贝西利组的IDFS 的获益从88.7%增加到92.2%,绝对差异为3.5%,提示高危HR+/HER2-早期乳腺癌患者可从CDK4/6 抑制剂辅助强化内分泌治疗中获益,为HR 阳性、HER2 阴性早期乳腺癌的强化内分泌治疗策略提供了强有力的证据,但TPBC 强化内分泌治疗是否效果更好,值得探讨。
4 TPBC 的靶向联合内分泌治疗
如前所述,临床实验证据提示,在HER2 持续阻断的情况下,ER 是HR+/HER2+乳腺癌细胞的关键逃逸途径。完全阻断HER 通路,同时抑制ER 通路,可能是向TPBC 患者提供的最佳治疗方式[16]。因此,认为同时阻断HER2 和ER 通路比单独阻断某一通路更有效,就目前的临床试验总结如下。
4.1 靶向联合内分泌治疗
SYSUCC-002 研究[29]是1 项开放性、非劣性、Ⅲ期随机对照研究,旨在评估曲妥珠单抗联合内分泌治疗或化疗在HR+/HER2+转移性乳腺癌患者中的疗效及安全性。该研究共纳入了9 个研究中心的392 例HR+/HER2+乳腺癌患者,根据1∶1 的比例,将受试者分成2 组:1 组接受SERMs 或AIs 再加上曲妥珠单抗治疗(ET 组),另1 组接受紫杉醇、卡培他滨或长春瑞滨再加上曲妥珠单抗(CT 组)。在进行了30.2 个月的中位随访之后,ET 组的中位PFS 为19.2 个月(95%CI:16.7~21.7),而CT 组的中位PFS 则为14.8 个月(95%CI:12.8~16.8),HR 0.88(95%CI:0.71~1.09),而P<0.000 1。研究结果表明,在HR+/HER2+乳腺癌的一线治疗方案中,曲妥珠单抗加内分泌治疗的疗效并不逊色于曲妥珠单抗加化疗,且联合内分泌组的毒副反应显著低于联合化疗组。这项研究为后续开展抗HER2 治疗联合内分泌治疗用于HR+/HER2+乳腺癌患者的相关研究奠定了基础。
PERTAIN 研究[30]旨在比较曲妥珠单抗+帕妥珠单抗+芳香化酶抑制剂与曲妥珠单抗+芳香化酶抑制剂,以评估其对晚期一线三阳性乳腺癌患者的有效性及安全性。该研究采用了随机、双臂、开放式的方法,进行了多中心Ⅱ期实验。258 名患者按照1∶1 的比例被随机分至2 组。A 组:帕妥珠单抗+曲妥珠单抗+芳香化酶抑制剂;B 组:曲妥珠单抗+芳香化酶抑制剂。总体人群的中位PFS 为18.89 个月,而约42%的患者没有接受任何诱导化疗。曲妥珠单抗加帕妥珠单抗联合AI 的患者的PFS 为21.72 个月,证实在内分泌治疗的基础上,强化双靶治疗对TPBC 晚期患者的治疗效果是令人满意的。
ALTERNATIVE 研究[31]是另1 项关于转移性TPBC 的大规模随机对照研究,针对以前接受内分泌治疗、曲妥珠单抗治疗和化疗的转移性TPBC 患者,结合TKI 进行内分泌治疗。目的是确定曲妥珠单抗和内分泌疗法的结合是否可以提高拉帕替尼的疗效。曲妥珠单抗+拉帕替尼和AI联合治疗的晚期三阳性乳腺癌患者的PFS 为11个月,显著高于单独使用拉帕替尼联合AI 治疗患者的8.3 个月,以及曲妥珠单抗联合AI 治疗的5.6 个月。曲妥珠单抗+拉帕替尼和+AI 联合治疗的HR+/HER2+晚期乳腺癌患者的OS 达到了46个月,提示靶向联合内分泌治疗的去化疗方案具有良好的预后,可以有效地改善晚期TPBC 患者的生存率。
4.2 靶向联合内分泌治疗和CDK4/6 抑制剂
目前CDK4/6 抑制剂联合抗HER2 药物治疗晚期TPBC 患者的探索,主要集中于CDK4/6 抑制剂联合曲妥珠单抗±内分泌治疗、CDK4/6 抑制剂联合恩美曲妥珠单抗±内分泌治疗以及CDK4/6 抑制剂联合酪氨酸激酶抑制剂+内分泌治疗[23,32-37],目前已公布研究结果二期研究主要包括monarcHER(阿贝西利+曲妥珠单抗±氟维司群)、SOLTI-1 303 PATRICIA(哌柏西利+曲妥珠单抗±来曲唑);NCT02657343(瑞博西尼+曲妥珠单抗)[23,36-37]。其中,monarcHER 研究是CDK4/6 抑制剂联合曲妥珠单抗±氟维司群对比化疗+曲妥珠单抗治疗三阳性晚期乳腺癌的Ⅱ期研究,PFS 作为唯一预设主要研究终点,OS 作为次要研究终点之一,具有很强的临床指导意义。2022 年ESMO 大会公布了MonarcHER 研究[36]OS最终分析。MonarcHER 的研究将晚期乳腺癌患者随机分为3 组:A 组接受阿贝西利、曲妥珠单抗和氟维司群治疗,B 组接受阿贝西利和曲妥珠单抗治疗,C 组接受化疗和曲妥珠单抗治疗。这些患者均为晚期TPBC 患者,曾接受过至少二线抗HER2 靶向治疗。该研究纳入237 例患者,于2020 年公布中位随访19 个月结果,PFS 在预先设定双侧alpha 值0.2 水平上,研究达到主要终点,A 组和C 组mPFS 分别为8.3 个月 VS 5.7 个月(HR 0.67,95%CI:0.45~1.00,P=0.051),B 组和C组mPFS 无显著差异(5.7 个月 VS 5.7 个月,HR 0.94,95%CI:0.64~1.38,P=0.77)。中位随访52.9 个月时,A 组、B 组、C 组的中位OS 分别为31.1 个月 VS 29.2 个月 VS 20.7 个月(A 组 VS C 组:HR 0.71,95%CI:0.48~1.05,P=0.086;B 组VS C 组:HR 0.84,95%CI:0.57~1.23,P=0.365)。结果显示,阿贝西利+曲妥珠单抗+氟维司群较化疗+曲妥珠单抗组不仅显著延长PFS,更加取得OS 显著获益,提示CDK4/6 抑制剂进一步优化晚期三阳性乳腺癌治疗疗效。此外,MonarcHER 研究的RNA 序列分析中,在Luminal亚型晚期三阳性乳腺癌患者中看到PFS 和OS 获益,且预后更佳,提示未来通过内在分子亚型筛选出Luminal 亚型三阳性乳腺癌,给予内分泌通路强化治疗联合抗HER2 免化疗模式未来可期。
在eLEcTRA、TAnDEM 等几项关于HR 阳性、HER2 阳性的转移性乳腺癌的研究中,抗HER2治疗联合内分泌治疗也显示相对良好的耐受性[38-40]。主要指南建议化疗联合靶向治疗仍是TPBC 晚期乳腺癌患者的最佳选择。一些不能耐受化疗的患者可能会选择内分泌治疗联合抗HER2 治疗。随着内分泌治疗联合抗HER2 治疗在TPBC 晚期乳腺癌患者中研究的增加,以及新的抗HER2 药物的批准,适合内分泌治疗联合靶向治疗的合适人群将增加[41]。在2020 年NCCN指南V4 中,推荐内分泌治疗联合抗HER2 治疗;此外,由于内分泌治疗的毒性低,该联合方案被推荐用于非内脏转移或无症状内脏转移的患者,特别是临床特征表明对内分泌治疗敏感的患者(无病间隔时间长 >12 个月,复发部位有限,疾病惰性和老年患者)。
5 TPBC 的潜在治疗靶点探索
脂肪酸合成酶(fatty acid synthase,FASN)通过PI3K/AKT 途径参与ER/HER2 信号传导,雷帕霉素(MTOR 抑制剂)可以抑制ER+/HER2+乳腺癌细胞中的脂肪酸合成酶的表达。雷帕霉素和脂肪酸合成酶抑制剂浅蓝霉素联合应用诱导了ER+/HER2+细胞的凋亡,抑制了细胞的迁移和肿瘤的发生,表明抑制mTOR-FASN 轴对于三阳性乳腺癌可能是一种有效的治疗[42]。然而,mTOR抑制剂依维莫司在晚期乳腺癌的2 项Ⅲ期试验(BOLERO-1 和BOLERO-3)中的效果并不理想,而通过生物标志物分析PI3K 通路中的体细胞突变(PIK3CA、PTEN 和AKT1 基因),可以更准确地预测治疗效果,使用依维莫司后,HER2+/HR+亚组的PFS 获益相对较小,因此,这种抑制mTOR-FASN 轴的策略仍然具有一定的潜力[43-44]。但在HR+/HER2+乳腺癌中运用效果如何尚且缺乏更多证据。
酪氨酸激酶受体IGF1R 也参与了ER/HER2途径的串扰,也可能是ER+/HER2+乳腺癌的有用生物标志物。公开的基因表达数据集表明IGF1R的高表达与ER+/HER2+乳腺癌患者的无病生存期较短有关,而使用他莫昔芬和2 种IGF1R 靶向酪氨酸激酶抑制剂(NVP-AEW2 和BMS-1)抑制乳腺癌细胞系中IGF1R 和ER 会导致生长抑制[45]。曲妥珠单抗的加入进一步抑制了生长,表明ER 和IGF2R 靶向治疗与HER2 靶向治疗相结合的方案可能是治疗ER+/HER2+/IGF1R+乳腺癌的一种方法。
6 正在进行中的TPBC 研究
我国开展的I 期临床研究LORDSHIPS[33],采用CDK4/6 抑制剂达尔西利+酪氨酸激酶抑制剂吡咯替尼+芳香酶抑制剂来曲唑三药联合方案针对HR+/HER2+晚期乳腺癌一线和二线治疗剂量展开探索。结果显示,达尔西利+吡咯替尼+来曲唑三联疗法在在一线治疗可能获益更多,值得进一步研究。达尔西利+吡咯替尼+来曲唑三联用药为HER2 和HR 双阳性晚期乳腺癌患者提供一种安全有效的全口服免化疗的治疗选择。目前正在进行第2 阶段扩大试验PLEASURABLE 研究,以进一步验证CDK4/6 抑制剂联合内分泌治疗和抗HER2 治疗的疗效和安全性。
口服SERD 药物Giredestrant 可完全拮抗ER、阻断ER 信号通路、并实现ER 降解,从而抑制肿瘤细胞增殖,可能会为患者带来更多的获益。HeredERA 研究是 1 项在既往未经治疗的HER2+/ER+局部晚期或转移性乳腺癌患者中评估在妥妥双靶皮下制剂(Phesgo)+诱导化疗(紫杉类)后Giredestrant(口服SERD 药物)与Phesgo 联合治疗比较Phesgo(+/-内分泌治疗)的有效性和安全性的随机、开放性、多中心、Ⅲ期研究。在TPBC晚期一线患者中明确Phesgo 抗HER2 治疗的基础上联合内分泌治疗的疗效,并且探索联合不同内分泌治疗药物的区别,为后续临床中TPBC 治疗策略的制定以及内分泌治疗药物的选择提供指导。
四川大学华西医院的1 项Ⅲ期临床研究,正在全球招募既往接受乳腺癌根治性切除手术治疗的HR+/HER2+乳腺癌辅助内分泌治疗的患者,以考察阿贝西利联合内分泌治疗或安慰剂联合内分泌治疗在乳腺癌辅助治疗阶段的临床疗效和安全性。
7 小结
TPBC 是一类相对特殊的临床亚型,具有不同于其他亚型的生物学特性和生存结局。近年来,随着CDK4/6 抑制剂、TKI 小分子酪氨酸激酶抑制剂、T-DM1 以及抗体偶联药物(ADC)相继应用于临床,在TPBC 临床治疗策略的选择上,应考虑到HR 与HER2 2 条信号通路相互干扰和辅助强化治疗理念。一般情况下,TPBC 始于靶向联合化疗,维持于内分泌联合靶向,附加于TKI 的靶向强化。解救依靠ADC,PIK3CA 抑制剂,以抗HER2 治疗为主线。
今后的TPBC 治疗的创新之路,兼顾ER 和HER2 信号的治疗效果,克服通路之间的串扰,更好地在 HER2 靶向治疗、内分泌治疗、化疗中选择更佳的治疗策略和组合从而使药物发挥最大作用仍是未来临床研究的重点。笔者认为,就现在看来,TPBC 的强化辅助治疗选择内分泌联合双靶治疗,患者可以得到更大的获益。希望在将来,能够出现维持内分泌和靶向治疗平衡且大幅度提高患者生存的新的治疗理念和方法。

