云南地区宫颈癌癌前病变患者HPV 56 的分子流行病学调查
周紫云 ,王莹莹 ,严志凌 ,赵凌锋 ,杨 希 ,许金美 ,张 芍
(1)曲靖市疾病预防控制中心,云南 曲靖 655000;2)昆明医科大学基础医学院,云南 昆明 650500;3)昆明医科大学第三附属医院妇科,云南 昆明 650118)
宫颈癌是全球女性中第四大常见肿瘤,主要致病因素是高危型人乳头瘤病毒的持续性感染[1]。80%以上的女性在一生中经历过至少1 次人乳头瘤病毒(human pappilomavirus,HPV)感染,但90%以上的HPV 感染可在2 a 内自然清除,仅不足1%的患者可能发展成为癌前病变(cervical intraepithelial neoplasia,CIN),甚至引发宫颈癌(cervical cancer,CC)[2]。癌前病变一般依据宫颈上皮内瘤变的严重程度划分为CIN1、CIN2、CIN3。目前,与宫颈癌发生相关的高危型HPV 型别主要包括HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58、HPV59、HPV68 等[3]。
1989 年,Lörincz 等[4]在华盛顿特区1 名妇女的CIN 组织样本中首次发现了HPV56 基因型。尽管HPV56 感染导致宫颈癌发生的比例在全球范围来看相对较小,但在亚洲地区,特别是中国,HPV56 具有相对较高的检出率。2014 年,Yang等[5]在中国西南地区74 例宫颈癌组织标本中发现HPV56 阳性率为1.64%(1/74)。2019 年,Zhao等[6]对华北地区HPV56 的感染率研究表明,在宫颈正常组中单一感染HPV56 型阳性率为0.66%(61/9 256);在癌前病变组中单一感染HPV56 型在CIN1 期的阳性率为6.80%(7/103),在CIN2 期为0%(0/97)。以上研究数据表明,HPV56 在癌前病变组和宫颈癌组中的感染率远高于宫颈正常组,HPV56 可能在宫颈癌的发生发展中发挥重要作用。
HPV 基因组分为3 个功能区,分别是长控制区,早期基因区和晚期基因区[7]。长控制区主要调控病毒的转录和复制,控制病毒蛋白和感染颗粒的产生;早期基因区编码产生E1,E2,E4,E5,E6 和E7 蛋白,其中E6 和E7 蛋白为病毒癌蛋白,在细胞癌变过程中发挥极其重要的作用;晚期基因编码产生在病毒颗粒自我组装以及侵入目标细胞时起协调和识别作用的L1 和L2 病毒衣壳蛋白[7]。研究表明[8-11]HPV 基因变异可导致致癌风险发生改变,特别是E6 和E7。E6 和E7 基因变异可导致编码氨基酸改变而使致癌能力发生改变。另外,L1 基因变异导致的L1 氨基酸序列变化可能会对病毒的抗原性和感染能力造成影响[12]。研究表明[13-14],根据L1 基因的序列变异特征,HPV56 分为A 谱系和B 谱系。
本研究以云南省宫颈癌癌前病变患者为研究对象,将患者组织样本进行HPV 分型,选取单一感染HPV56 的样本提取基因组,扩增得到HPV56 E6,E7 和L1 基因,并对获得基因序列进行测序,以此分析云南地区HPV56 谱系分布特征及E6,E7 和L1 基因的遗传变异数据,为进一步HPV56疫苗研发及相应的诊断和治疗提供参考数据。
1 资料与方法
1.1 样本采集
选取2022 年2 月至2023 年2 月昆明医科大学第三附属医院妇瘤科宫颈癌癌前病变患者作为研究对象,采集宫颈组织样本,将组织样本保存于组织保存液中,-80℃保存。诊断标准依据《临床诊疗指南-妇产科学分册》[15],研究对象纳入标准为:(1)所有患者有性生活史;(2)单一宫颈、无其它宫颈病变。研究对象排除标准为:(1)未接受过化疗、放疗、手术等抗肿瘤治疗;(2)未合并或继发其他恶性肿瘤。所有研究对象均为彼此之间无血缘关系并且长期居住于云南地区的汉族个体,研究方案经昆明医科大学第三附属医院伦理审查委员会批准(KYCS2021193),所有样本采集均征得本人知情同意。
1.2 样本DNA 提取
取-80℃冷冻保存的宫颈组织样本30~60 mg,于室温融化。加入钢珠及600 mL Buffer RLT,置于超声破碎仪,50 HZ 破碎2 min,取出钢珠,8 000 r/min 离心3 min。取上清置于新的离心柱,8 000 r/min 离心1 min,而后加入500 µL AW1 于8 000 r/min 离心30 s,弃上清。每个样本中再加入500 µL AW2 后14 000 r/min 离心2 min。加入100 µL EB,室温孵育10 min,然后8 000 r/min 离心1 min。得到的溶液即含释放的DNA,取出备用。
1.3 HPV 检测分型
使用基于核酸分子导流杂交系统的HPV 分型检测试剂盒(凯普生物科技有限公司)对样本DNA进行HPV 分型。
1.4 HPV56 E6、E7、L1 基因扩增测序
根据分型结果,选取检测出单一HPV56 阳性的患者作为研究对象,扩增HPV56 E6、E7、L1基因。根据参考文献[13]设计针对HPV56 E6、E7、L1 基因的扩增和测序引物,交由生工生物工程(上海)有限公司合成。用于设计扩增引物和测序引物的HPV56 序列为X74483.1,各基因的扩增引物和测序引物,见表1。PCR 反应体积为50 µL,反应条件为98℃预变性2 min,98℃变性10 s,Tm℃退火5 s,72℃延伸45 s,72℃延伸5 min,共35 个循环。PCR 产物经2%琼脂糖凝胶电泳成像验证后,把PCR 原液送交生工生物工程(上海)有限公司测序。

表1 HPV56 E6、E7、L1 基因的扩增引物和测序引物Tab.1 The amplification primers and sequencing primers of E6 E7 and L1 genes of HPV56
1.5 HPV56 E6、E7、L1 基因变异和系统发生树分析
将测序所得的HPV56 E6、E7、L1 基因序列分别用Molecular Evolutionary Genetics Analysis(MEGA)v 7.0 软件中的Clustal W 多重比对工具进行比对,而后分析基因序列的变异情况。用于分析基因变异情况的参考序列下载于GenBank,登录号为X74483.1。选用Molecular Evolutionary Genetics Analysis(MEGA)v 7.0 软件中的ML 法来构建系统发育树,通过bootstrap 值为1 000 对树的可信度进行评估,选用模型为Kimura 2-parameter(Kimura-2 参数)。构树参考序列从GenBank 序列数据库下载,参考序列的登录号分别为:EF177176.1、EF177177.1、EF177178.1、EF177179.1、EF177180.1、EF177181.1、KU298915.1、KU298916.1、KU298917.1,KU298918.1 和KU298919.1。
1.6 统计学处理
本研究HPV56 型E6、E7 和L1 基因变异发生数的录入及基因变异发生频率的计算等处理均采用Microsoft Excel 软件完成。
2 结果
2.1 HPV56 E6、E7、L1 基因扩增情况
本研究通过对300 例癌前病变患者组织样本进行检测,发现单一感染HPV56 的样本有32 例,其中CIN1 期16 例,CIN2 期16 例。从32 个样本中分别扩增出完整HPV56 E6 序列25 条(CIN1 期14 条,CIN2 期11 条)、HPV56 E7 序列23 条(CIN1 期11 条,CIN2 期12 条)、HPV56 L1 序列28 条(CIN1 期16 条,CIN2 期12 条)。
2.2 HPV56 E6、E7、L1 基因的系统发生树分析
本研究用从样本中扩增得到的HPV56 E6,E7 和L1 序列来构建系统发生树,结果表明,扩增得到的HPV56 E6 序列中A 谱系23 例(CIN1 期14 例,CIN2 期9 例),B 谱系2 例(CIN1 期0 例,CIN2 期2 例),见图1;HPV56 E7 序列中A 谱系21 例(CIN1 期11 例,CIN2 期10 例),B 谱系2例(CIN1 期0 例,CIN2 期2 例),见图2;28 例HPV56 L1 序列中A 谱系26 例(CIN1 期16 例,CIN2 期10 例),B 谱系2 例(CIN1 期0 例,CIN2期2 例),见图3。
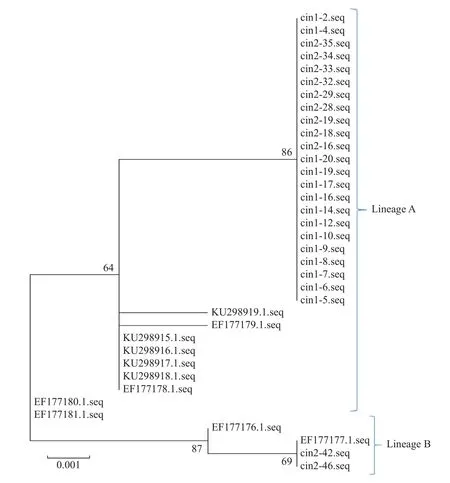
图1 HPV56 E6 基因系统发生树Fig.1 Phylogenetic tree of E6 of HPV56
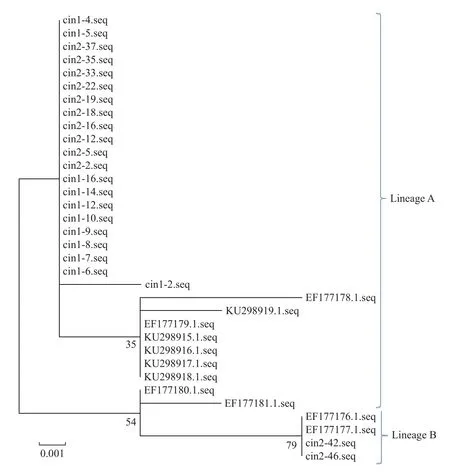
图2 HPV56 E7 基因系统发生树Fig.2 Phylogenetic tree of E7 of HPV56

图3 HPV56 L1 基因系统发生树Fig.3 Phylogenetic tree of L1 of HPV56
2.3 HPV56 E6、E7、L1 基因的变异分析
经比对扩增得到的HPV56 E6,E7 和L1 基因系列,发现共存在13 个遗传变异位点,其中E6基因中6 个、E7 基因中4 个、L1 基因中3 个,见表2。E6 基因中发现6 个核苷酸变异,分别是A141C(S14R)、T158C(S19S)、A241G(N47S)、A263C(K54N),G279A(D60N)和G437A(P112P),其中A141C(S14R)、A241G(N47S)、A263C(K54N)变异占扩增序列的8.0%,T158C(S19S)、G279A(D60N)、G437A(P112P)变异占扩增序列的92.0%,见表2。E7 基因中发现4 个核苷酸变异,分别为C601A(D10E)、G605A(V12I),G770C(E67Q)和G802C(Q77H),其中C601A(D10E)和G770C(E67Q)变异占扩增序列的91.3%,G605A(V12I)变异占扩增序列的8.7%,G802C(Q77H)变异占扩增序列的13.0%,见表2。L1 基因中发现3 个核苷酸变异,分别为A5867G(N126D),G6454T(P321P)和A6868C(I459I),其中G6454T(P321P)发生100%变异,A5867G(N126D)和A6868C(I459I)变异占扩增序列的96.4%,见表2。

表2 HPV56 E6、E7、L1 基因变异情况Tab.2 E6,E7 and L1 gene variation of HPV56
3 讨论
HPV56 是导致宫颈癌发生的高危型HPV 之一[16],其感染率在1.1%~10.9%之间,尤其在亚洲地区具有相对较高检出率[6,17-19]。因此,本研究对云南地区CIN 患者中HPV56 型E6、E7 和L1 基因进行了测序,并基于以上3 个基因的序列数据对云南地区HPV56 谱系特征及其变异特征进行了分析。
在本研究中,HPV56 L1 基因系统发生树结果显示,92.9%的患者感染的HPV56 病毒属于A 谱系(26/28),而仅有7.1%的患者属于B 谱系(2/28)。2018 年,Jing 等[13]对四川地区HPV56分布特征进行研究,结果显示,50.0%的患者感染属于A 谱系(8/16),50.0%的患者属于B 谱系(8/16)。该结果表明,在四川地区和云南地区流行的HPV56 型的L1 基因存在一定的差异,所以造成了基于L1 获得的谱系分析结果存在差异。2015 年,Wu 等[20]对四川地区宫颈癌患者中HPV16 进行分子流行病学调查后发现,四川地区HPV16 类型主要属于欧洲谱系(病例组:86.7%),但是在云南地区HPV16 以亚洲谱系为主导地位(病例组:72.7%)[21]。该研究结果之间的差异也充分说明四川和云南人群所感染的HPV 谱系是存在一定差异的。
E6 蛋白是HPV 主要的2 个致癌蛋白之一,在宫颈癌的发生发展中发挥着极其重要的作用。HR-HPV E6 蛋白可通过直接或间接调控PI3K/AKT/mTOR、p53 等细胞凋亡信号传导中的关键蛋白、从而促进肿瘤的发生发展[22-23]。HPV E6 蛋白含有2 个CXXC-X29-CXXC 锌指结构,分别位于E6 蛋白的33-69 和106-142 氨基酸序列区域。本研究发现A241G(N47S),A263C(K54N)和G279A(D60N)非同义突变均位于HPV56 E6 蛋白的第1 个锌指结构区域内,这些位点的变异可能会导致HPV56 E6 蛋白的锌指结构区域折叠结构的改变或是与E6 靶标的结合而影响E6 蛋白的功能[23-24]。同时,本研究发现A141C(S14R)和A263C(K54N)变异,但2008 年,Hiller 等[25]研究发现携带A141C(S14R)和A263C(K54N)突变的HPV56 变异株的E6 蛋白与HPV56 原型的E6蛋白在促使p53 降解的功能上并无差异。因此,尽管A141C(S14R)和A263C(K54N)在云南地区CIN 患者中存在变异,但这2 个变异可能与CIN和宫颈癌的进展无关。
E7 蛋白是HPV 另一个重要的致癌蛋白,主要是通过与视网膜母细胞瘤蛋白质(Rb)家族结合促使Rb 家族蛋白水解而刺激细胞周期失控,进而促进宫颈癌的发生发展。HPV E7 蛋白N 端一般含有2 个保守区域(CR1 和CR2),与Rb 家族蛋白结合的LXCXE 基序和酪蛋白激酶II 磷酸化位点位于CR2 区域内,另外,在E7 蛋白的C 端含有1 个和E6 蛋白相似的CXXC-X29-CXXC 锌指结构[26]。本研究发现4 个非同义突变中的C601A(D10E)和G605A(V12I)位于E7 蛋白的CR1 区域内,G770C(E67Q)和G802C(Q77H)位于E7 锌指结构区域,CR2 区域的LXCXE 基序未发现突变,提示CR2 区域可能在E7 基因中较CR1 及锌指结构保守。
HPV L1 蛋白是HPV 病毒的衣壳蛋白,是HPV 病毒的主要结构蛋白,在病毒DNA 导入宿主细胞并整合进入宿主细胞染色体过程中起着重要作用。研究表明L1 蛋白可以作为人体细胞免疫反应靶蛋白被用于HPV 疫苗的研究中[26]。有研究表明,HPV L1 基因变异而引起的氨基酸改变会影响L1 蛋白的自我组装和免疫细胞对VLPS的识别从而导致免疫原性产生差异以及造成免疫逃逸发生[27-28]。Jing 等[13]发现HPV56 L1 基因中引起K116M 和N126D 氨基酸变化的变异可能具有破坏性,而本研究所发现的HPV56 L1 基因的3 个变异位点中有仅A5867G(N126D)为非同义突变,而未发现存在导致K116M 氨基酸改变的变异。
在HPV 疫苗研究中,预防性疫苗主要关注点在于HPV L1 的特征研究,而治疗性疫苗则主要关注于HPV E6 和E7 的特征研究,为此,本研究为了解HPV56 的变异特征和疫苗研发提供了参考数据。本研究的局限性主要在于由于HPV56 在人群中感染比例较小,故纳入本研究的样本数量有限,从而导致在分析基因变异及HPV56 谱系分布特征代表性可能不足。

