补阳还五汤浸膏制备过程中指纹图谱变化及美拉德反应研究*
赵佳柱,祝雨辰,邓俊林,贺福元,3,杨岩涛,3
(1.湖南中医药大学药学院,湖南 长沙 410208;2.中药成药性与制剂制备湖南省重点实验室,湖南 长沙 410208;3.湖南中医药大学中医药超分子机理与数理特征化实验室,湖南 长沙 410208)
中药作为一种多组分体系,中药指纹图谱可检测其复方及其制剂加工过程中多组分整体量变规律。同时高效液相色谱(HPLC)、高效毛细管电泳(HPCE)、气相色谱(GC)、高效液相色谱-质谱联用法(HPLC-MS)、GC-MS、红外光谱(IR)[1-5]等技术能建立二维、三维图谱,标示其化学特征。总量统计矩法系运用总量零阶矩(AUCT)、总量一阶矩(MCRTT)、总量二阶矩(VCRTT)等参数来描述一张完整的指纹图谱[6],并在指纹图谱总量统计矩分析法的基础上,通过两指纹图谱正态曲线下重叠面积之和,运用正态分布曲线的计算原理,计算补阳还五汤浸膏制备过程,分析不同样品指纹图谱间的相似度[7],从而考察其成分在此过程中的变化情况。
美拉德反应是一种非酶促反应,是羰基化合物(还原糖及脂质等)和氨基化合物(氨基酸及蛋白质)间的反应,广泛应用于食品加工过程中[8-10]。同时这些化学成分在中药中广泛存在,中药材在煎煮过程中会发生美拉德反应。加热可使原来的化学成分结构改变而得到新物质,或将某些结合在植物体内的成分解析出来,重新组装形成大分子或直接以小分子形式存在于药液中。物理相互作用和化学反应的共同作用使微粒之间的结合方式更为多样,结构更为复杂。美拉德反应产物的还原性能是其多种基本生理特性之一。因此本研究尝试以样品液还原性能作为考察指标,以验证中药浸膏制备过程中存在美拉德反应。
1 材料与方法
1.1 仪器与试药 高效液相色谱仪,配备Breeze色谱工作站、Waters 2487双波长检测器(美国Waters公司);SP-756型紫外可见分光光度计(上海光谱仪器有限公司);TP-1200C型电子天平(湘仪天平仪器设备有限公司);苦杏仁苷(批号:110820-200403,纯度≥98%)、芍药苷(批号:110736-200629,纯度≥98%)、川芎嗪(批号:110817-200305,纯度≥98%)、阿魏酸(批号:0773-9910,纯度≥98%),均购于中国药品生物制品检定所;乙腈为色谱纯,水为重蒸馏水,其他试剂均为分析纯。
补阳还五汤,处方组成:黄芪60 g,当归9 g,川芎6 g,赤芍9 g,桃仁9 g,红花9 g,地龙9 g。以上中药材均购于湖南中医药大学第一附属医院药剂科,经刘塔斯教授鉴定分别为:豆科植物蒙古黄芪[Astragalus membranaceus(Fisch.) Bge.Var. mongho-kicus(Bge.)Hsiao]干燥根;伞形科植物当归[Angelica sinensis(Oliv.)Diels]的干燥根;伞形科植物川芎[Iigusticum chuanxiong Hort.]的干燥根;菊科植物红花[Carthamus tinctorius L.]的干燥花;毛莨科植物芍药[Paeonia lactlora Pall.]的干燥根茎;蔷薇科植物桃[Prunus persica(L.)Batsch]的干燥成熟种子;环节动物门钜蚓科动物参环毛蚓[Pheretima aspergillum(E. perrier)]的干燥主体。
1.2 样品溶液的制备
1.2.1 待测样品溶液的制备 按处方比例称取药材,加8倍量蒸馏水,回流提取2次,每次1 h,合并滤液,浓缩,待浓缩至800 mL,精密移取药液1 mL,过0.45 μm微孔滤膜,制得1号样品溶液;继续浓缩至400 mL,精密移取药液1 mL,稀释1倍,过0.45 μm微孔滤膜,制得2号样品溶液;继续浓缩至200 mL,精密移取药液250 μL,加蒸馏水定容至1 mL后,过0.45 μm微孔滤膜,制得3号样品溶液;继续浓缩至100 mL,精密移取药液125 μL,加蒸馏水定容至1 mL后,过0.45 μm微孔滤膜,制得4号样品溶液;继续浓缩至40 mL,精密移取药液50 μL,加蒸馏水定容至1 mL后,过0.45 μm微孔滤膜,制得5号样品溶液;继续浓缩后置于真空干燥箱中制得干浸膏,取适量浸膏加水制备成与前5号样品等处方浓度的药液,过0.45 μm微孔滤膜,制成6号样品溶液。
1.2.2 对照品溶液的制备 分别精密称取苦杏仁苷、川芎嗪、阿魏酸对照品19.810 0、10.970 0、13.410 0 mg,用甲醇定容至10 mL;精密称取芍药苷对照品7.332 0 mg,定容至1 mL。分别精密吸取上述各对照品溶液500 μL,混合,摇匀,过0.45 μm微孔滤膜,制成每1 mL含苦杏仁苷0.495 2 mg、芍药苷1.833 0 mg、川芎嗪0.274 2 mg、阿魏酸0.335 2 mg的混合对照品溶液。
1.3 色谱条件 色谱柱:MLtimate-XB C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈(A)∶水(B,含1%乙酸);梯度洗脱,洗脱程序:0~10 min,0%A;10~25 min,0%A~7%A;25~35 min,7%A~12.5%A;35~45 min,12.5A%~18%A;45~55 min,18%A~25%A;55~65 min,25%A~30%A;65~70 min,30%A~32.5%A;70~71 min,32.5%A~37%A;71~80 min,37%A~40%A;80~100 min,40%A~80%A;100 ~115 min,80%A~100%A;115 ~120 min,100%A~0%A;流速:1 mL/min;波长:264 nm;柱温:40 ℃;进样量:10 μL。
1.4 样品溶液还原能力(Fe3+→Fe2+)测定[11]1~6号样品稀释40倍后,取1mL置于5mL离心管中,加入1mL磷酸盐缓冲液(0.2mol/L,pH值6.6)和1 mL质量分数为1%的铁氰化钾溶液,混匀,置50 ℃水浴中20 min,取出,再加入1 mL质量分数为10%的三氯乙酸溶液,混匀,迅速冷却。取1 mL混合溶液置于5 mL离心管,加入1 mL超纯水和0.2 mL质量分数为0.1%的三氯化铁溶液,迅速混匀,测定溶液在700 nm的吸光度值(A)。平行测定3次。
2 方法与结果
2.1 HPLC指纹图谱测定方法学考察
2.1.1 指纹图谱积分条件的确定 精密吸取10 μL空白样品,进样测得图1中S7,以仪器最小的积分门槛值进行积分得空白甲醇指纹图谱参数,再考虑进行梯度洗脱时,流动相的比例改变,甲醇杂质产生的稳定空白对照峰后,提高最小峰面积再次进行积分,结合总量统计矩加合原理[12-13],以信噪比3∶1确定该指纹图谱的积分阈值:半峰宽为35s,响应率为67mAu/s,面积总量为6000 μAu·s,峰高为280 μAu。
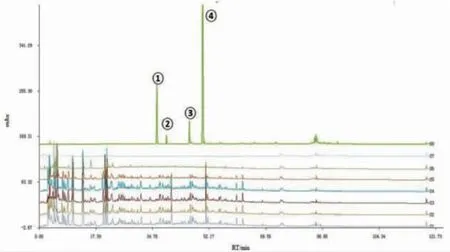
图1 混合对照品、甲醇空白、补阳还五汤样品溶液指纹图谱
2.1.2 线性关系考察 依次精密吸取混合对照品溶液0.1、0.2、0.4、0.6、0.8、1.0 mL,用甲醇稀释并定容至1 mL,按“1.3”项下色谱条件进样10 μL。以对照品质量浓度(X)为横坐标,峰面积(Y)为纵坐标,进行线性回归,得到各对照品的回归方程。结果显示各对照品在所取浓度范围内线性关系良好。对照品溶液的标准曲线、线性范围、最低检测限见表1。
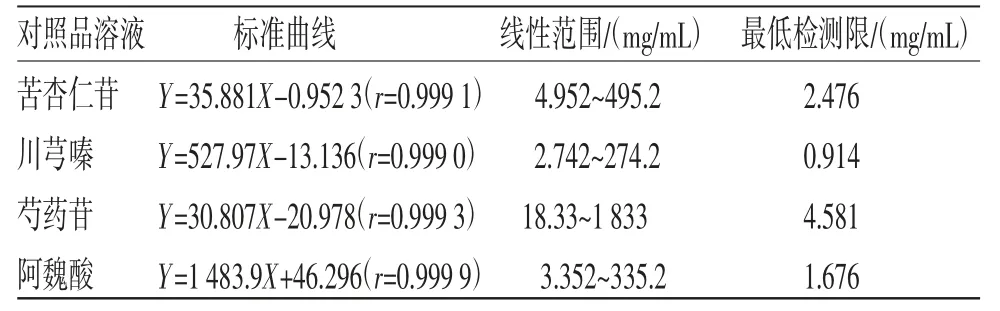
表1 对照品溶液标准曲线、线性范围、最低检测限表
2.1.3 精密度试验 取供试品液,按“1.3”项下色谱条件连续进样6次,每次10 μL,根据其指纹图谱计算其总量统计矩各参数,可得指纹图谱的总量零阶矩、一阶矩、二阶矩的RSD分别为2.60%、3.20%和3.70%,均小于5%。
2.1.4 稳定性试验 取同一份供试品,放置0、2、6、12、24 h后按“1.3”项下色谱条件分别进样10 μL,得其总量零阶矩的RSD为0.57%,总量一阶矩的RSD为0.82%,总量二阶矩的RSD为3.10%。
2.1.5 重复性试验 取同一供试品溶液,连续进样5次,每次10 μL,可得其总量零阶矩的RSD为3.50%,总量一阶矩的RSD为4.20%,总量二阶矩的RSD为1.60%。
2.2 样品的测定 取按“1.2”项下方法制备的1~6号样品溶液,按“1.3”项下色谱条件,各进样10 μL,得指纹图谱S1、S2、S3、S4、S5、S6,空白甲醇样品指纹图谱S7,混合对照品溶液指纹图谱S8。(见图1)
2.3 指纹图谱总量统计矩参数及相似度计算 按“2.1.1”项下方法对指纹图谱积分,依法计算各指纹图谱的总量统计矩参数。(见表2)
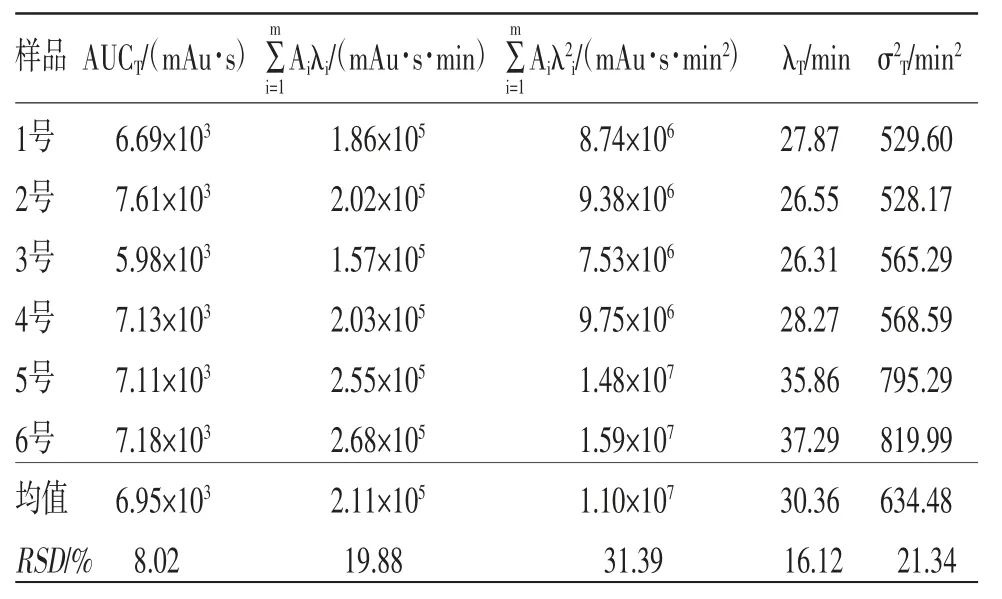
表2 补阳还五汤样品液指纹图谱总量统计矩参数
依据计算所得各指纹图谱总量统计矩参数,按总量统计矩相似度法计算各指纹图谱间相似度。结果见表3。
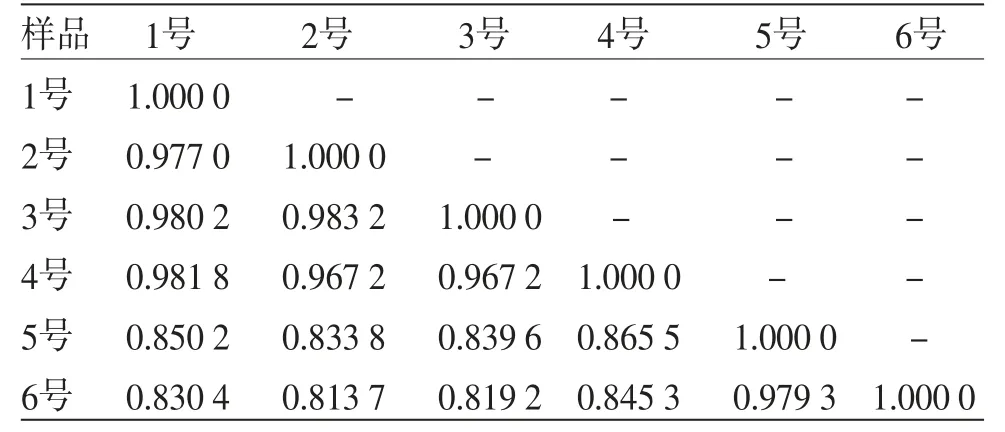
表3 各样品液指纹图谱相似度
2.4 样品溶液还原能力(Fe3+→Fe2+) 以700 nm波长下样品溶液的吸光度值来表征产物的还原能力,1~6号样品溶液还原能力测定结果见图2。
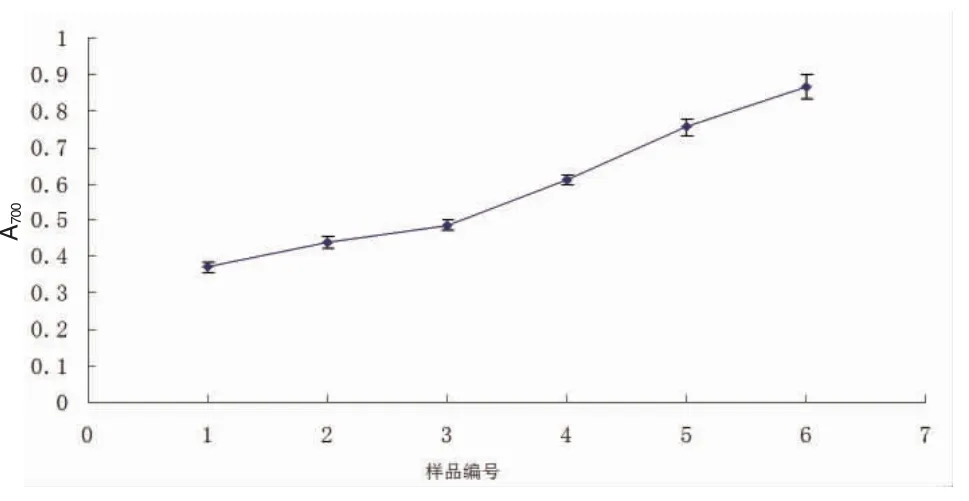
图2 各样品溶液还原能力
3 讨论
中药复方成分众多,并且在煎煮、浓缩、干燥等一系列制备加工过程中存在各类化学反应发生的可能[14],如柴胡-白芍药对在煎煮后出现了16种新成分[15]。浓缩和干燥过程中长时间高温条件下成分也会发生较大的变化。这都会影响中药复方药效物质基础,也是造成中药复方物质基础难以阐明的原因之一。因此,在尊重原方的基础上,将中药复方开发成制剂,以提高中药复方临床顺应性,则有必要对中药复方制剂制备过程中相关化学反应的发生进行研究。美拉德反应已被证实存在于中药复方制备过程中。美拉德反应产物还原性的变化可证实美拉德反应的发生[16]。前期研究[17-19]表明,水是美拉德反应的重要溶剂。若含水量低于3%,反应则会受到抑制;当含水量为0%时,反应几乎不能进行;若含水量较高,则会明显稀释反应剂的浓度,也会降低反应速率;含水量为10%~15%,有利于化学成分分子扩散,推动反应进行。而作为中药普通煎煮提取溶剂的水,在浸膏制备的过程中,其含量是在不断发生变化的。随着浓缩过程的进行,水分含量不断降低。当水分降低到合适范围时,汤剂中的氨基化合物与羰基化合物之间将会发生美拉德反应[20]。
因此,本研究以补阳还五汤浸膏制备过程中指纹图谱的变化情况为例,尝试探讨此过程中美拉德反应的发生。在补阳还五汤浸膏的制备过程中,1~6号样品溶液间指纹图谱零阶矩的RSD为8.02%,一阶矩的RSD为16.12%,二阶矩的RSD为21.34%,说明指纹图谱的总量统计矩参数随浸膏制备过程的进行产生了显著性变化。在浓缩过程中,各成分之间可能因为“吸附”“沉淀”等过程而改变其溶出率;也可能在高温状态下,物质之间发生络合、水解等反应,而引起中药化学成分及功效等多方面的变化,进一步导致各样品溶液指纹图谱信息发生了显著变化。
相似度计算结果显示,在补阳还五汤浸膏的制备过程中,1~6号样品溶液间的指纹图谱相似度也发生了明显的变化,基本呈现逐渐减小的趋势,说明在浸膏制备过程中,随着浓缩过程的进行,样品中成分的类别、相对浓度等均发生了一定的变化。尤其是浓缩到一定程度后,相似度降低到了0.85以下,说明相似度的降低与水分的减少有着极大的关联。补阳还五汤复方药材中的氨基和羰基的化合物可作为美拉德反应物,如君药黄芪中有11种含有氨基的化合物、54种含有羰基的化合物;臣药当归中有9种含有氨基的化合物、63种含有羰基的化合物。且制备过程营造了较高的水分含量及较高的温度等美拉德反应发生的良好条件[21]。因此补阳还五汤制备过程中会发生复杂的美拉德反应,从而造成中药浸膏复方化学成分发生变化,导致指纹图谱相似度降低。
在补阳还五汤浸膏的制备过程中,1~6号各样品溶液的还原性能呈现逐渐增大的趋势,说明随着浓缩程度的增加,浸膏水分含量不断减少的同时,样品的还原性能在不断增大,而美拉德反应产物的还原性能有可能是造成样品溶液还原能力不断增强的原因之一。还原性作为美拉德反应产物的一种基本特性,其还原性增加又从另一个角度证明了在中药复方浸膏的制备过程中美拉德反应的发生和美拉德产物的不断增多。这表明补阳还五汤浸膏在制备过程中具有较好的研究开发价值。
由于美拉德反应,食品会产生特殊的香味与颜色,故其在食品工艺上有着非常重要的价值[22]。这些变化在中药制剂加工过程中也十分常见,且某些变化已经被证实属于美拉德反应[23-25]。伴随美拉德反应的发生,中药复方产生的美拉德反应产物,将会改善中药的口感,改变中药复方的组成和活性成分。已有研究[26]证明美拉德反应产物具有多种多样的生物活性。其存在也将对中药复方的色泽与气味、药效及毒性产生影响,进而影响中药复方剂量。就制剂过程来说,选择不同剂型,则需要不同的制备加工条件。美拉德反应的类别和程度也将有所区别,也将直接影响复方制剂的临床使用。因此,阐明中药复方制剂加工过程中美拉德反应的机理及其产物种类将为中药复方的物质基础、配伍、剂型及加工工艺带来重大的影响。

