山药皮中黄酮、多酚提取工艺优化及其抗氧化活性
杭书扬,杨林霄,郭建行,钱格格,刘延奇,2,3*
(1.郑州轻工业大学 食品与生物工程学院,河南 郑州 450001;2.食品生产与安全河南省协同创新中心,河南 郑州 450001;3.河南省冷链食品质量安全控制重点实验室,河南 郑州 450001)
山药属薯蓣科植物,是我国传统的功能性食材[1-2],山药含有多种生物活性成分,其中必需氨基酸、多糖、黄酮类化合物和酚酸是主要成分[3],它们具有许多潜在功效,广泛应用于治疗糖尿病、抗氧化和免疫调节[4-5]等方面。山药既可以作为家常菜食用,也可剥皮、切片、晒干或风干制作中草药[6],在处理过程中,产生可达20%的废弃物——山药皮[7]。山药皮中含有的生物活性化合物比可食用部分更多[8],据研究,山药皮提取物的尿囊素、黄酮和总酚含量均高于粉质部位提取物,山药皮提取液中黄酮类化合物含量是粉质部位提取液的1.72~2.23 倍[9]。
黄酮、多酚有着抗氧化、抗菌和抗炎等丰富的生物活性,这些性质对改善人体健康水平有着积极的作用,因此黄酮、多酚类物质一直是食品领域研究的热点。最近的研究表明,每天摄入超过1 g 的多酚可有效降低慢性疾病的患病率[10]。山药皮中有着丰富的黄酮、多酚,已有报道通过热回流法提取铁棍山药皮中黄酮类化合物,但提取量仅为0.338 2 mg/g[11],因此寻找一种高效的提取方法对于开发山药皮的营养功能有重要意义。
提取方式作为从山药皮中获取酚类物质的关键步骤,目前主要有溶剂萃取、机械萃取、超临界萃取、微波萃取、热回流等方法。但通过这些方法回收酚类物质具有局限性,例如在溶剂萃取中使用额外的溶剂、机械萃取的得率低、超临界萃取的成本高以及微波辅助萃取中需要水相等[12]。与这些方法相比,超声辅助提取具有时间和能量需求少、低温提取和保留提取物质量等优点。超声辅助提取是用高强度声波从山药皮中提取黄酮、多酚,利用超声波辐射压强产生的强烈空化效应、机械振动、扰动效应等多级效应,增大物质分子运动频率和速度,增加溶剂穿透力,从而加速目标成分进入溶剂,促进提取的进行[13],与超声辅助提取相关的变量有频率、功率、温度、时间、溶剂类型、液固比,需要精确控制以实现最佳提取。
为研究山药皮黄酮、多酚的高效提取工艺,本试验以铁棍山药皮为原料,以黄酮、多酚得率为考察指标,选择乙醇浓度、液固比、超声时间作为考察因素,利用正交法优化提取条件,并对最优条件提取的山药皮粗提物进行抗氧化性试验,为进一步研究山药皮的营养功能提供参考。
1 材料与仪器
1.1 材料
铁棍山药:市售;芦丁标准品、没食子酸标准品、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、福林酚:上海源叶生物科技有限公司;无水乙醇、NaNO2、Na2CO3、Al(NO3)3、NaOH、复合磷酸盐、铁氰化钾、三氯乙酸、氯化铁、硫酸亚铁、过氧化氢、水杨酸、石油醚(均为分析纯):天津市富宇精细化工有限公司。
1.2 仪器
紫外分光光度计(UV-1800):上海美普达公司;分析天平(BSA223S):德国赛多利斯公司;数控超声清洗机(SB-4200DT):宁波新芝生物科技有限公司;循环式多用真空泵(SHZ-D):河南金友成仪器设备有限公司;旋转蒸发仪器(YRE-52AA):巩义市予华仪器有限责任公司;电热鼓风干燥箱(DHG-9123A):上海精宏实验设备有限公司。
2 方法
2.1 山药皮粗提物提取流程
新鲜山药洗净、去皮(皮厚约为0.2 mm)、烘干、磨粉过80 目筛得山药皮粉末,将山药皮粉末与乙醇溶液按一定比例置于锥形瓶中进行超声提取,提取完成后将溶液离心取上清液,减压浓缩到一定体积后用石油醚进行萃取脱脂处理,旋蒸除去残留的石油醚后,冷冻干燥得山药皮粗提物。
2.2 线性关系考察
2.2.1 多酚含量的测定
参考文献[14]方法并稍作修改,分别移取0、0.2、0.4、0.8、1.2、1.6 mL 没食子酸标准溶液(0.1 mg/mL)于10 mL 比色管中,加入福林酚0.4 mL 摇匀,再加入0.8 mL Na2CO3(质量分数为15%),加蒸馏水定容到10 mL 混匀后避光反应1 h,于760 nm 处测定吸光度。以吸光度(A)对没食子酸的质量浓度(X)进行回归,得方程Y=0.111 7X+0.116 3,R2=0.996 7。
2.2.2 黄酮含量的测定
参考文献[15]方法并稍作修改,分别吸取0、0.5、1.0、2.0、3.0、4.0 mL 芦丁标准溶液(0.1 mg/mL)于10 mL棕色比色管;加入0.3 mL NaNO2(质量分数为5%)避光反应6 min;加入0.3 mL Al(NO3)3(质量分数为10%)避光反应6 min;加入4 mL NaOH(质量分数为4%),去加蒸馏水定容到10 mL 后静置15 min,于510 nm 处测定吸光度。以吸光度(A)对芦丁浓度(X)进行回归,得方程Y=0.011 4X+0.059 7,R2=0.998 3。
2.3 黄酮和多酚得率测定
黄酮得率测定:根据芦丁标曲方法进行吸光度的检测,黄酮得率计算公式如下。
式中:X 为黄酮得率,%;C1为黄酮质量浓度,g/mL;V1为提取液的定容体积,mL;m 为山药皮质量,g;N1为稀释倍数。
多酚得率测定:根据没食子酸标曲方法进行吸光度的检测,多酚得率计算公式如下。
式中:Y 为多酚得率,%;C2为多酚质量浓度,g/mL;V2为提取液的定容体积,mL;m 为山药皮质量,g;N2为稀释倍数。
2.4 单因素试验
准确称取1.0g 山药皮粉末,采用超声辅助提取黄酮、多酚,考察乙醇浓度(40%、50%、60%、70%、80%)、超声时间(10、20、30、40、50 min)和液固比[30∶10、40∶1、50∶1、60∶1、70∶1(mL/g)]对山药皮黄酮、多酚得率的影响。
2.5 正交试验设计
分别以超声时间(A)、乙醇浓度(B)及液固比(C)作为考察因素,以山药皮中黄酮、多酚的得率为考察指标,优化提取工艺。正交试验因素水平因素见表1。

表1 因素水平及编码Table 1 Levels and codes of experimental factors
2.6 抗氧化能力测定
2.6.1 DPPH 自由基清除率测定
参考文献[16]的方法并有所修改,2 mL 山药皮粗提物溶液与2 mL 0.1 mmol/L DPPH-乙醇溶液混合均匀,37 ℃恒温避光反应30 min,以VC作阳性对照,于517 nm 波长处测定吸光度,DPPH 自由基清除率计算公式如下。
式中:M 为DPPH 自由基清除率,%;A0为去离子水代替样品测得的吸光度;A1为样品溶液测得的吸光度;A2为无水乙醇代替DPPH 测得的吸光度。
2.6.2 还原力测定
参考文献[17]的方法测定还原力。将山药皮粗提物配成一系列浓度梯度溶液,取0.5 mL 样品溶液,分别加入0.2 mol/L PBS 溶液0.5 mL、1 g/100 mL 铁氰化钾溶液0.5 mL,50 ℃反应20 min 后加10 g/100 mL的三氯乙酸溶液0.5 mL,4 500 r/min 离心10 min 后取1 mL 上清液,加入0.1 g/100 mL 的氯化铁溶液0.2 mL,混匀后静置10 min,以VC作为阳性对照,于700 nm 波长处测定吸光度,并以该吸光度表征还原力。
2.6.3 羟自由基清除率测定
参考文献[18]并稍作修改,在试管中混合1 mL 不同浓度的粗提物溶液、1 mL 硫酸亚铁溶液(6 mmol/L)和1 mL 过氧化氢(6 mmol/L)。将混合物在室温(25 ℃)下储存10 min,并添加1 mL 水杨酸。轻轻摇动并保持30 min 后,在510 nm 处测定混合物的吸光度。羟自由基清除率计算公式如下。
式中:N 为羟自由基清除率,%;A0为对照组(无样品)的吸光度;A1为试验组(无水)的吸光度;A2为空白组(不含水杨酸)的吸光度。
2.6.4 总抗氧化能力测定
参照文献[19]中总抗氧化能力(total antioxidant capacity,T-AOC)的测定方法,根据试剂盒的T-AOC比色法进行测定。以Fe2+浓度表示总抗氧化能力,以系列亚铁离子浓度(mmol/100 g)为横坐标,相应吸光度为纵坐标,作标准曲线,根据提取液的吸光度在标准曲线上相应的Fe2+浓度,即可得出该样品的抗氧化能力。
2.7 数据处理
各试验重复3 次,采用Excel 整理数据,IBM SPSS Statistics 22.0 软件程序Duncan 检验法进行显著性分析(P<0.05),采用Origin 2021 软件作图。
3 结果与分析
3.1 单因素试验结果
3.1.1 超声时间对黄酮、多酚得率的影响
超声时间对黄酮、多酚得率的影响见图1。

图1 超声时间对黄酮、多酚得率的影响Fig.1 Effect of ultrasonic time on the yield of flavonoids and polyphenols
由图1 可知,在10~20 min 内,黄酮、多酚得率与超声时间呈正相关关系,在20~40 min 时,随着超声的延长,山药皮中黄酮、多酚得率逐渐减小,40~50 min 得率有所增加但低于20 min 的得率。这是因为在最初阶段超声处理时间延长时,超声的空化效应促进了植物组织基质的溶胀、水合作用、破碎和孔隙形成,从而提高了山药皮黄酮、多酚的得率[20],因此选择20 min 进行后续试验。
3.1.2 乙醇浓度对黄酮、多酚得率的影响
乙醇浓度对黄酮、多酚得率的影响见图2。

图2 乙醇浓度对黄酮、多酚得率的影响Fig.2 Effect of ethanol concentration on the yield of total flavonoids and polyphenols
由图2 可知,乙醇浓度分别为70%和60%时,山药皮中黄酮、多酚提取得率最佳,乙醇浓度是影响产量的最重要因素之一,乙醇浓度的增加会增加酚类化合物的产率,直至达到最大乙醇浓度,然后使产率下降,这种趋势与Garcia-Castello 等[21]从柚子残渣中提取黄酮所得结果相符。这种变化趋势可能是由于溶剂的介电常数随着乙醇浓度的增加而降低,从而导致酚类化合物的溶解度和扩散率增加,但是接近100%的乙醇浓度,即高纯度乙醇溶剂会导致山药皮中组织脱水以及蛋白质变性,从而导致产量降低。对于工业生产,溶剂浓度低可有效降低生产成本,此外山药皮黄酮的含量高于多酚,所以选择70%作为最优提取浓度。
3.1.3 液固比对黄酮、多酚得率的影响
液固比对黄酮、多酚得率的影响见图3。
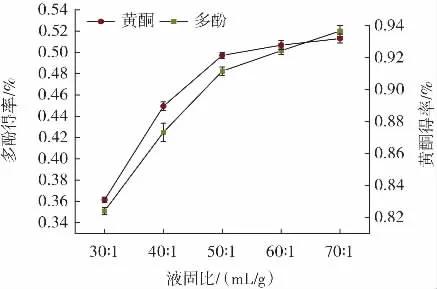
图3 液固比对黄酮、多酚得率的影响Fig.3 Influence of liquid-solid ratio on the yield of total flavonoids and polyphenols
由图3 可知,液固比30∶1~70∶1(mL/g)时,山药皮中黄酮、多酚得率随液固比的增加而增加,当液固比大于50∶1(mL/g)时,黄酮、多酚物质得率增速减慢。这可能是因为在低比例液固比下,山药皮溶液的黏度较高,由于必须克服高黏度溶液中更强的内聚力,因此空化效应更困难。初始阶段,随着液固比增加,萃取介质的黏度和浓度降低,导致更大的空化效应,溶质的较高浓度差增加了溶质在溶剂中的扩散和溶解,从而增强了萃取过程,在高液固比下,施加在副产品基质上的超声强度更高,导致更多的碎裂、侵蚀和孔隙形成效应,从而提高产量。当液固比增加到一定程度时候溶剂与溶质达到饱和,此后继续增加乙醇添加量,也很难增加得率[22]。所以,试验中选择液固比50∶1(mL/g)进行后续试验。
3.2 正交设计及结果
表2 和表3 分别为黄酮、多酚得率正交试验结果。表4 和表5 分别为黄酮、多酚得率方差分析结果。
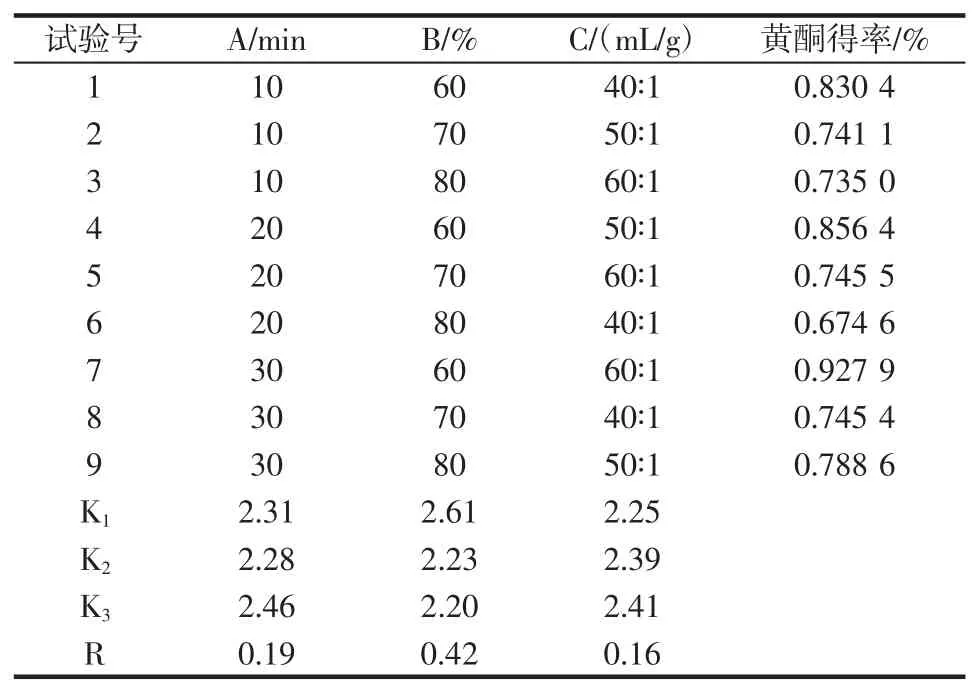
表2 黄酮得率正交试验结果Table 2 Flavonoids yield of orthogonal test
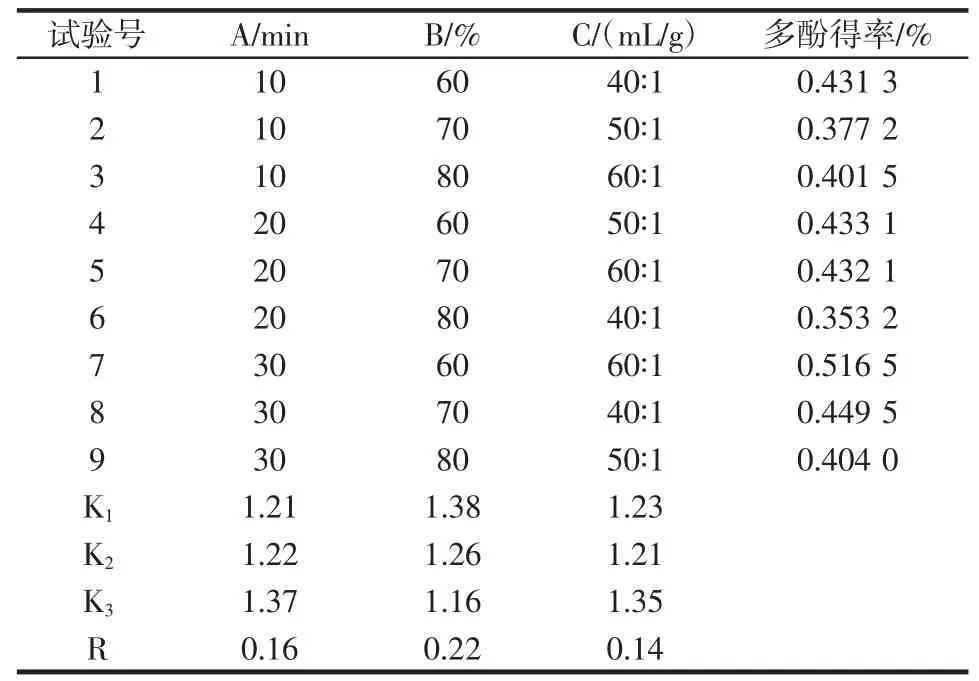
表3 多酚得率正交试验结果Table 3 Yield of polyphenols of orthogonal test

表4 黄酮得率方差分析Table 4 Variance analysis of flavonoids yield

表5 多酚得率方差分析Table 5 Variance analysis of polyphenols yield
由表2 和表4 可知:山药皮中黄酮得率与超声时间、乙醇浓度、液固比显著相关(P<0.05),相关程度依次为B>A>C,即乙醇浓度>超声时间>液固比,优化的最佳提取条件为A3B1C3[提取时间30 min,乙醇浓度60%,液固比60∶1(mL/g)]。由表3 和表5 可知:山药皮多酚得率与超声处理时间和乙醇浓度显著相关(P<0.05),影响次序为B>A>C,即乙醇浓度>超声时间>液固比,优化的最佳提取条件为A3B1C3[提取时间30 min,乙醇浓度60%,液固比60∶1(mL/g)]。此结果与正交试验中最佳组合结果一致,此时黄酮得率为0.929%,多酚得率为0.519%。
3.3 抗氧化试验结果
3.3.1 DPPH 自由基清除率试验结果
VC和粗提物的DPPH 自由基清除率见图4。

图4 VC 和粗提物的DPPH 自由基清除率Fig.4 DPPH radical scavenging rate of VC and crude extract
当DPPH 自由基还原为1,1-二苯基-2-三硝基苯肼时,颜色由紫色变为黄色,导致与样品提供氢/电子能力相关的吸收平衡的降低[23]。由图4 可知,粗提物对DPPH 自由基清除率与样品浓度呈现正相关的对应关系,在浓度为1.0 mg/mL 时达到最大值79.96%,其IC50值为0.158 mg/mL,大于VC的IC50值0.016 mg/mL,说明粗提物的DPPH 自由基清除率弱于VC。
3.3.2 还原力试验结果
VC和粗提物的还原力见图5。
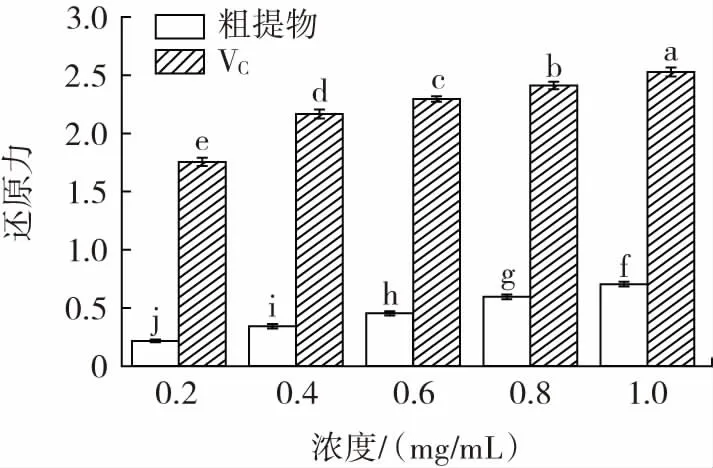
图5 VC 和粗提物的还原力Fig.5 Reducing power of VC and crude extract
抗氧化活性可通过使反应体系中Fe3+还原成Fe2+体现,在700 nm 处吸光度大小变化与还原能力的高低呈正相关[24]。由图5 可看出,粗提物的还原力随着浓度的增大显著增强,但与阳性对照VC相比,各浓度下还原力均低于VC,浓度为1 mg/mL 的粗提物的还原力为0.70,而浓度为1 mg/mL 的VC的还原力可达到2.53。
3.3.3 羟自由基清除率试验结果
VC和粗提物的羟自由基清除率见图6。
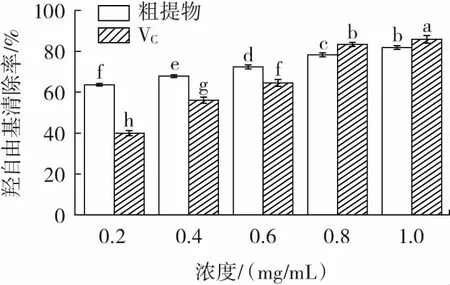
图6 VC 和粗提物的羟自由基清除率Fig.6 Hydroxyl radical scavenging rates of VC and crude extract
由图6 可以看出,粗提物对羟自由基有良好的清除效果。浓度范围为0.2~0.6 mg/mL 时,粗提物羟自由基清除率显著高于同等浓度下VC的羟自由基清除率,粗提物IC50值为0.083 mg/mL,小于VC的IC50值0.302 mg/mL,说明粗提物相比于VC有着更好的羟自由基清除率。
3.3.4 总抗氧化能力试验结果
VC和粗提物的总抗氧化能力见图7。

图7 VC 和粗提物的总抗氧化能力Fig.7 Total antioxidant capacity of VC and crude extract
在酸性条件下,样品中的抗氧化物质还原Fe3+-TPTZ 产生Fe2+-TPTZ,呈现出明显的蓝色,于593 nm 处有最大的光吸收,在Fe3+-TPTZ 过量的情况下,测定蓝色物质的生成量,即可获得待测样品的总抗氧化能力。由图7 可看出,粗提物的总抗氧化能力在0.2~1.0 mg/mL浓度范围内总抗氧化能力逐步上升,在1.0 mg/mL 时达到峰值为0.68 mmol/100 g,这与其还原力的测定结果相对应。但粗提物抗氧化能力不如VC,阳性对照VC在浓度为0.6 mg/mL 时达到峰值为2.27 mmol/100 g。
4 结论
通过对山药皮中黄酮、多酚提取工艺的优化,以及山药皮粗提物抗氧化活性测定试验得出:在提取时间30 min、乙醇浓度60%、液固比60∶1(mL/g)时,山药皮中黄酮、多酚得率最高,分别为0.929%和0.519%;在最优工艺下提取的乙醇粗提物的抗氧化性试验结果表明,粗提物具有良好的DPPH 自由基清除作用(IC50值为0.158 mg/mL)和羟自由基清除作用(IC50值为0.083 mg/mL),具有一定的还原力和总抗氧化能力。因此,超声辅助乙醇提取山药皮中黄酮和多酚是一种高效、可行的方法,同时,山药皮粗提物具有良好的抗氧化活性,为进一步探究山药皮中的生物活性物质提供参考方法。
——营养
——去皮

