基于网络药理学、分子对接及实验验证探讨黄芩抗胃癌的作用机制
崔 杨,王 瑾,陈雨琪,张庆洋,周玉婷
(1陕西中医药大学医学技术学院生物技术教研室,咸阳 712046;2陕西中医药大学附属医院检验科;*通讯作者,E-mail:cuiyang118@foxmail.com)
胃癌是最常见的消化道恶性肿瘤之一,2020年胃癌的全球发病率和死亡率分别为第五(5.6%)和第四(7.7%)[1]。尽管我国胃癌发病率和死亡率呈逐年下降趋势,但目前依然高于全球平均水平,严重威胁着人们的生命健康[2]。由于早期胃癌缺乏特异性的临床症状,检出率较低,导致多数患者在确诊时已处于中晚期。对于中晚期胃癌的治疗,主要以手术、化疗、放疗及靶向治疗为主。但是无论是放化疗还是靶向治疗,都具有一定的毒副作用,治疗效果不佳,患者预后较差。近年来的临床实践表明结合中医药治疗胃癌具有一定的优势,在防治癌前病变、防止并发症、加速术后康复、防止复发转移、放化疗增效减毒、改善生存质量等方面有着明显的效果[3]。因此,中药抗胃癌的作用受到了越来越多的重视,寻找并开发更多高效低毒的天然中医药物已成为胃癌药物研发的趋势之一。
黄芩是唇形科黄芩属多年生草本植物,是一种常见的传统中药。黄芩的主要活性成分是黄酮类化合物及其糖苷[4]。药用价值及含量较高的有黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、千层纸素A等[5]。近些年黄芩在防治肿瘤方面的作用也受到了关注,黄芩中的主要活性成分在抗肿瘤方面均有显著作用,具有抗炎,抗氧化,抗病毒,调节多种肿瘤细胞的增殖、凋亡、运动、侵袭和血管生成等功能[6,7]。已有文献报道指出黄芩提取物[8]及其有效成分黄芩素[9]、汉黄芩素[10]、黄芩苷[11]等能够抑制胃癌细胞的增殖,诱导胃癌细胞的凋亡,发挥抗胃癌作用。但由于中药具有多成分、多靶点、多通路协同作用的特点[12],目前对于黄芩抗胃癌的分子作用机制还没有系统深入的研究。
网络药理学,是一种基于高通量组学数据分析和网络数据库检索的系统生物学与多向药理学相结合的新兴学科[13],旨在通过大数据分析,系统地整合“药物活性成分-疾病靶点-通路”的复杂网络关系,从整体反映药物对疾病的作用机制,为中药分子药理学研究提供新思路[14]。分子对接技术能够预测药物活性分子与受体蛋白间的相互作用模式和亲和力。因此,本研究将在网络药理学和分子对接研究的基础上,从整体角度探讨黄芩抗胃癌作用的主要活性成分、靶基因和作用通路,并通过体外细胞实验对筛选结果进行初步验证,为黄芩抗胃癌的临床应用提供一定的理论支持。
1 材料与方法
1.1 黄芩化学成分及作用靶点信息的获取
利用中医药系统药理学平台(TCMSP数据库)获取黄芩的化学成分,以口服利用度(oral bioavai-lability,OB)≥30%,类药性(drug-likeness,DL)≥0.18为筛选条件,对活性成分进行初步筛选,获得活性化合物及其作用的蛋白质靶点。通过Uniprot蛋白质数据库(https://www.uniprot.org)将化合物作用的蛋白质靶点名称规范化。
1.2 胃癌疾病靶点的获取
以“gastric cancer”“gastric carcinoma”“gastric adenocarcinoma”等与胃癌相关的疾病为关键词,在GeneCards数据库(https://www.genecards.org)、OMIM数据库(http://www.omim.org)、TTD数据库(http://bidd.nus.edu.sg/group/cjttd)以及DRUGBANK数据库(https://www.drugbank.ca)中寻找胃癌疾病靶点。合并4个疾病数据库靶点后,删除重复得到胃癌疾病靶点。
1.3 黄芩和胃癌交集蛋白靶点的PPI网络构建
利用R语言将黄芩作用靶点和胃癌疾病靶点取交集并绘制韦恩图。将交集靶点提交至STRING11.0数据库(https://string-db.org)中,生物种类设定为“homo sapiens”,最小互相作用阈值设定为“highest confidence”(>0.9),其余设置均为默认值,构建蛋白相互作用(PPI)网络模型,并通过CytoScape软件,选择network analyze功能,并根据度值(degree)大小排列靶点,并得到核心靶点。
1.4 “黄芩活性成分-黄芩胃癌交集靶点”的网络构建
制作黄芩活性成分与黄芩胃癌交集靶点相互作用关系(network)及节点属性(type)文件,提交到CytoScape软件中构建“黄芩活性成分-黄芩胃癌交集靶点”网络图,并根据度值判断黄芩抗胃癌的主要活性成分。
1.5 基因本体(Gene Ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析
将黄芩与胃癌的交集靶点录入Metascape平台(http://metascape.org/gp/index.html),设置P<0.01,对生物学过程与通路进行动态富集分析,用R语言对结果进行可视化,绘制GO功能富集分析图和KEGG通路富集图。
1.6 分子对接
在PDB数据库(http://www.rcsb.org/)中下载PPI网络中度值前五的靶点蛋白的三维结构,在PubChem数据库(http://pubchem.ncbi.nlm.nih.gov/)中下载“黄芩活性成分-黄芩胃癌交集靶点”网络中度值前五的黄芩活性成分的三维结构。应用AutoDock软件进行分子对接,计算黄芩活性成分与靶点蛋白的结合强度。再利用Pymol2.5.0软件将对接结果进行可视化处理。
1.7 体外实验验证
1.7.1 细胞、试剂及仪器 人胃癌细胞株AGS、MGC-803(上海中科院细胞库),RPMI 1640培养液、胎牛血清(美国Gibco公司),CCK-8、DMSO(美国Sigma公司),细胞裂解液、BCA蛋白定量试剂盒(江苏碧云天生物技术研究所),PVDF膜(德国Millipore公司),β-actin、p53、Akt、p-Akt抗体(美国Cell Signal Technology公司),辣根过氧化酶标记二抗(美国Jackson公司),黄芩提取物(西安飞达生物技术有限公司)。
CO2恒温培养箱、超净工作台(美国Thermo公司),倒置显微镜(日本Olympus公司),高速离心机、酶标仪(德国Eppendorf公司),电泳仪、电转仪(美国Bio-Rad公司)。
1.7.2 细胞培养 p53野生型胃癌细胞AGS和p53突变型胃癌细胞MGC803在含10%胎牛血清、100 U/ml青霉素、100 U/ml链霉素的RPMI-1640培养液中,37 ℃,5% CO2的培养箱中常规培养,隔天换液。
1.7.3 CCK-8检测细胞活力 分别将处于对数生长期的AGS和MGC-803细胞用胰酶消化并计数,以4×103/孔的浓度接种在96孔板中,培养24 h后,弃去培养基,更换含黄芩提取物培养基,浓度依次为0,20,40,80,120,160,200 μg/ml,每个浓度设置6个复孔。继续培养24 h或48 h后,弃含药培养基,每孔加入CCK-8检测液10 μl,在培养箱中继续孵育1 h后,用酶标仪检测450 nm处的OD值。
1.7.4 细胞划痕实验检测胃癌细胞迁移能力 将AGS细胞以5×105/孔的浓度接种到6孔板中,过夜培养,待细胞铺满后,用灭菌枪头垂直于培养板划直线,用PBS清洗细胞3次后,加入对照(0 μg/ml)和含黄芩提取物(100 μg/ml)的无血清培养基培养。利用倒置显微镜拍照,测量0,24,48 h时,同一视野下细胞划痕的距离。相对划痕愈合率=(划痕后0 h距离-划痕后相应时间点的距离)/划痕后0 h距离×100%。
1.7.5 蛋白免疫印迹实验检测Akt、p-Akt、p53蛋白表达 将AGS细胞以1×105/孔的浓度接种到6孔板中,过夜培养后,更换含黄芩提取物培养基,浓度为0,50,100 μg/ml,培养24 h后,弃培养基,加入细胞裂解液提取细胞总蛋白,并用BCA试剂盒进行蛋白定量。蛋白样本与上样缓冲液混合后,煮沸5 min。以20 μg/孔蛋白样品的浓度上样,进行SDS-PAGE电泳、转膜、封闭后,分别用Akt,p-Akt,p53一抗(1∶1 000稀释)室温孵育2 h,洗涤后加入二抗(1∶10 000稀释),室温孵育1 h,洗涤后加超敏化学发光液,显影,并用Image J分析条带灰度值。
2 结果
2.1 黄芩活性成分及作用靶点的获取
利用TCMSP数据库,以OB≥30%,DL≥0.18两个指标进行筛选,共收集到黄芩活性成分32个(见表1)。黄芩活性成分对应的潜在作用靶点共119个(见图1)。
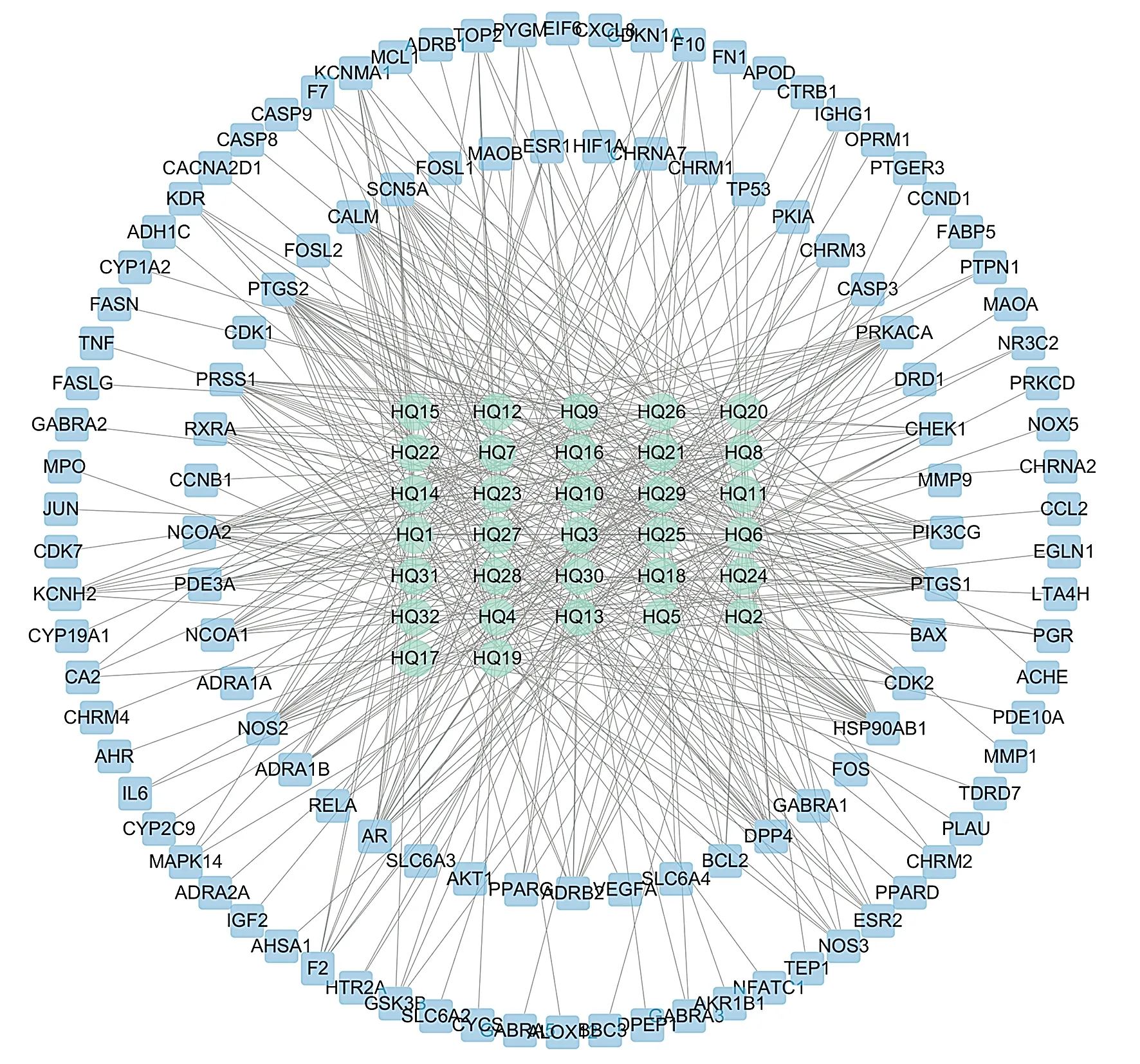
绿色圆形节点为黄芩活性成分,蓝色方形节点为黄芩潜在作用靶点
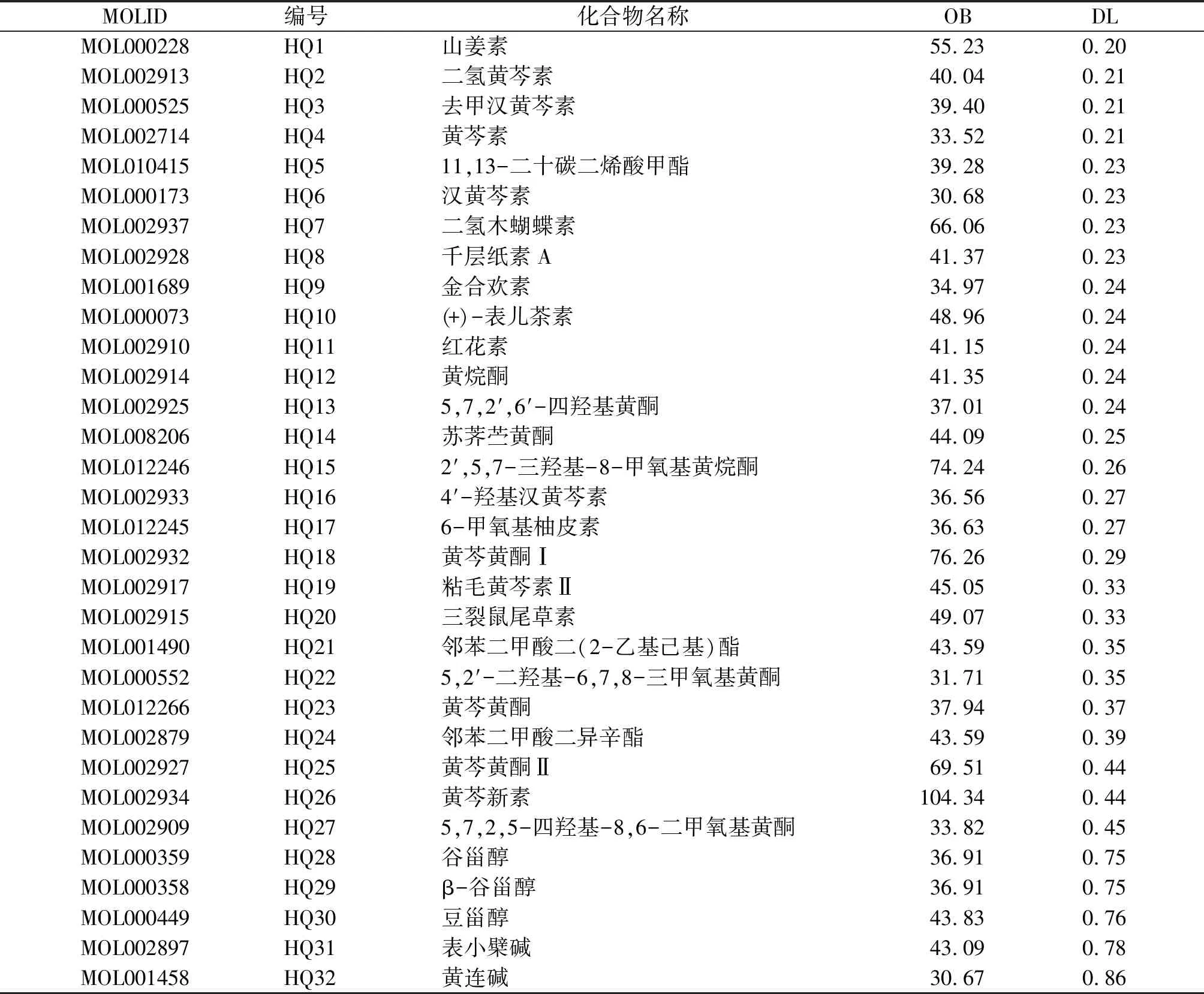
表1 TCMSP数据库中筛选出的32种黄芩活性成分
2.2 胃癌疾病相关靶点的获取
从GeneCards、OMIM、TTD、DRUGBANK数据库分别获取胃癌疾病相关靶点993,199,35,32个,其中Gencards数据库选取的靶点为相关性评分(score)≥20的靶点。合并4个数据库靶点去除重复后,共得到胃癌相关靶点1 069个。
2.3 黄芩活性成分-胃癌交集靶点PPI网络的构建
将筛选的黄芩活性成分靶点与胃癌异常疾病靶点取交集,通过R语言绘制韦恩图,得到黄芩-胃癌交集靶点共57个(见图2)。将57个共同靶点提交到STRING数据库,得到黄芩-胃癌靶点蛋白质相互作用网络(PPI),节点数(靶点蛋白)56个,边数(蛋白间相互作用)718条,随后将STRING平台得到的蛋白相互作用数据导入cytoscape软件,选择network analyze功能,得到PPI网络模型(见图3),根据度值将蛋白靶点从大到小排列,度值前5的核心靶点依次为AKT1(度值50)、TP53(度值49)、VEGFA(度值46)、JUN(度值45)、IL6(度值44)。
2.4 “黄芩活性成分-黄芩胃癌交集靶点”的网络构建
利用cytoscape软件构建黄芩活性成分-黄芩胃癌交集靶点网络(见图4),根据度值排名筛选黄芩抗胃癌核心成分,发现排名前五的核心成分为汉黄芩素(HQ6,度值34)、黄芩素(HQ4,度值22)、金合欢素(HQ9,度值20)、苏荠苎黄酮(HQ14,度值16)、千层纸素A(HQ8,度值15)。
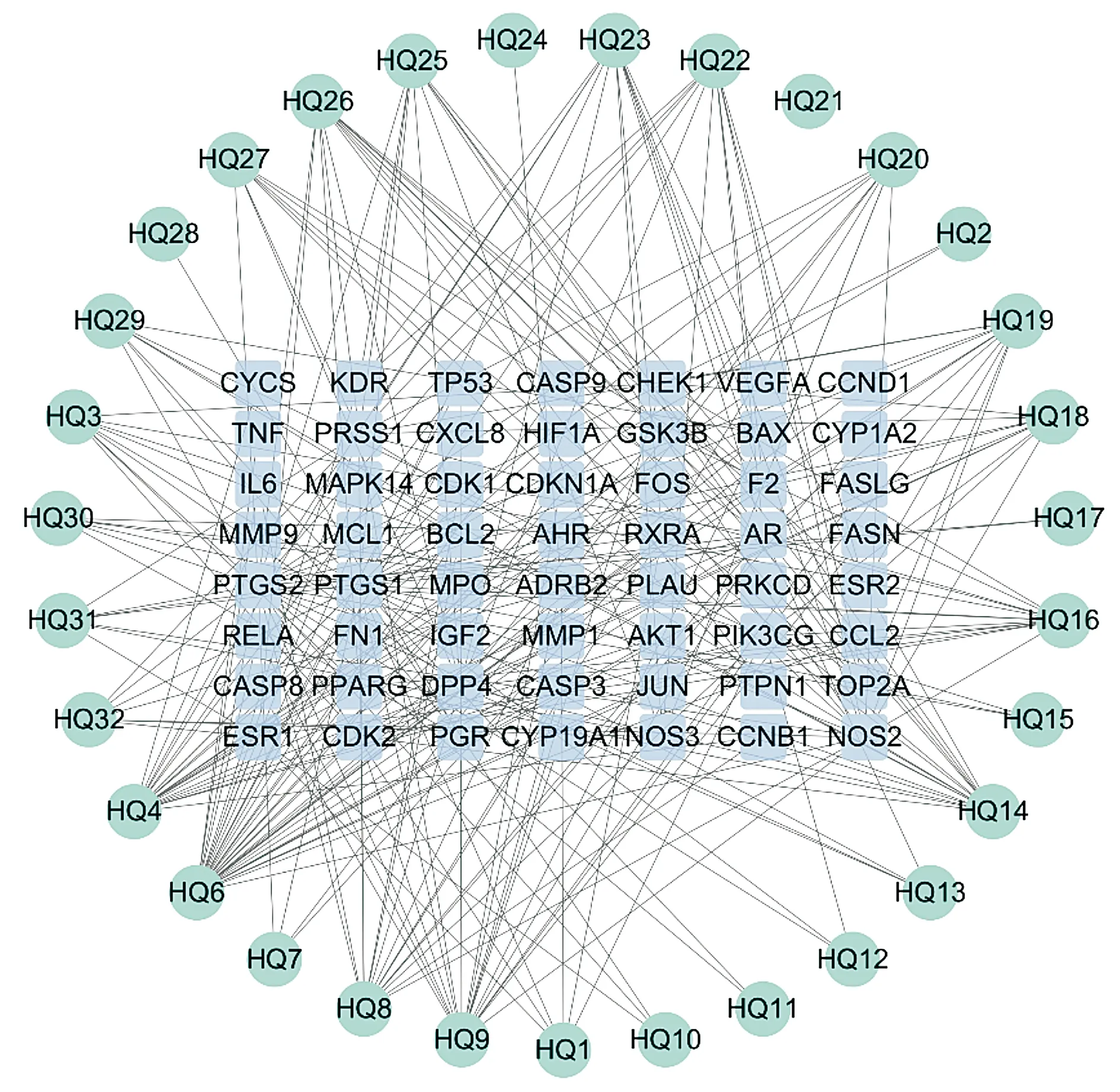
圆形节点代表黄芩活性成分,方形节点代表黄芩胃癌交集靶点,节点与节点之间的边代表黄芩活性成分与交集靶点的相互作用,度值即边数
2.5 GO功能富集分析和KEGG通路富集分析
在metascape数据库中对蛋白靶点进行GO功能富集分析和KEGG通路富集分析,利用R软件,根据P值和基因数对结果进行可视化(见图5,6)。
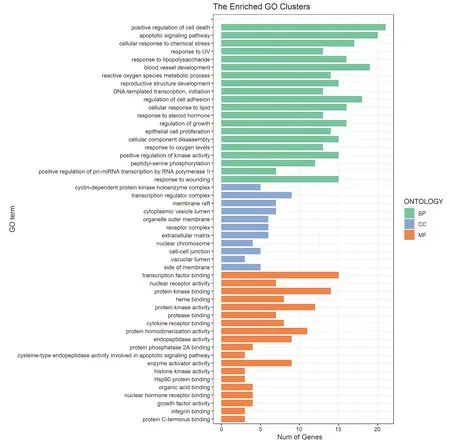
纵轴每一类GO功能富集分析的条目从上到下按照P值从小到大的顺序排列
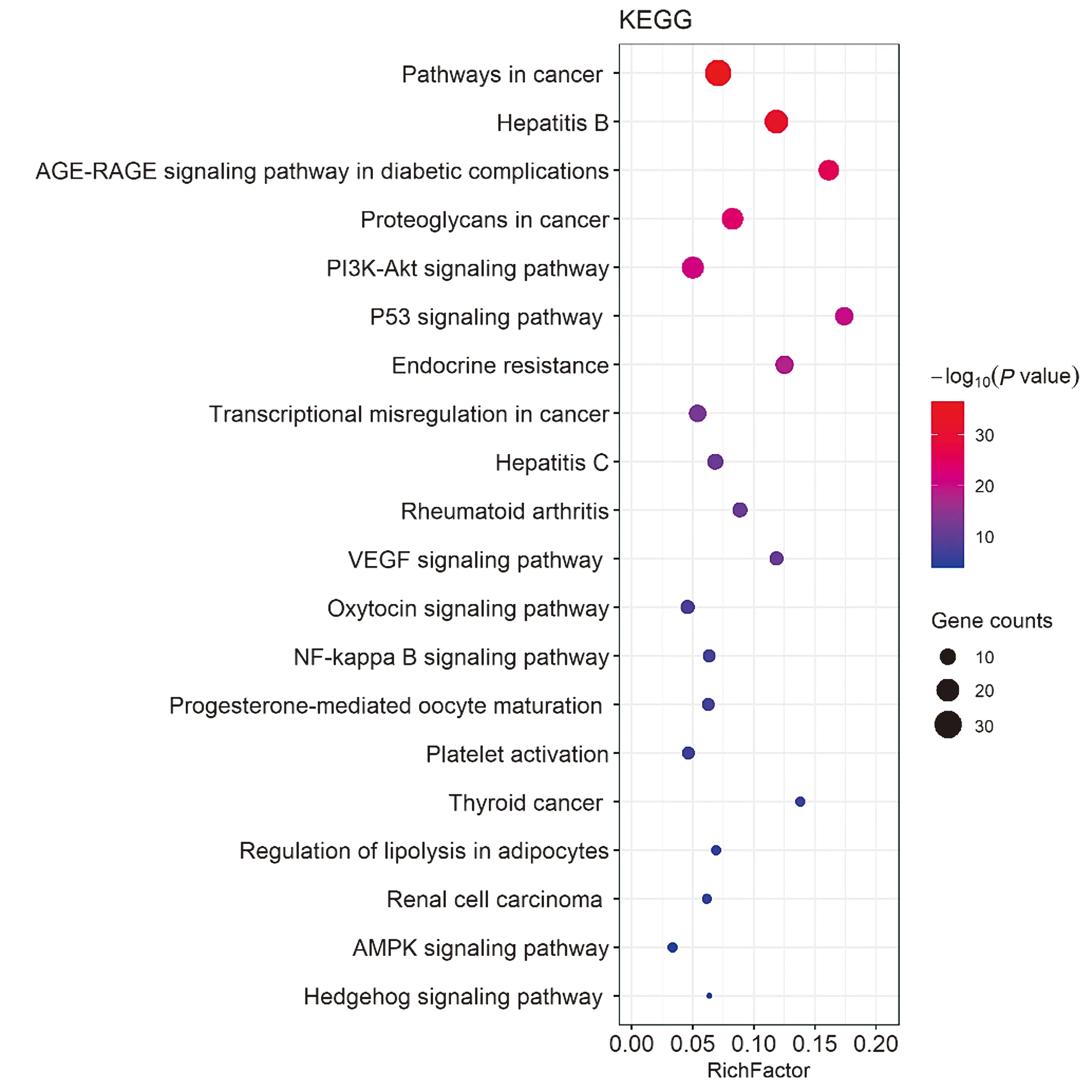
图6 黄芩抗胃癌作用靶点的KEGG通路富集分析
从GO功能富集分析结果可知,黄芩抗胃癌参与的生物过程(biological process,BP)主要集中在细胞死亡的正调控、凋亡信号通路、细胞化学应激反应、紫外线应激反应、血管生成、ROS代谢过程等。细胞组分(cell component,CC)主要涉及周期蛋白依赖性蛋白激酶全酶复合体、转录调控复合体、膜筏、胞质囊腔、细胞器外膜等。分子功能(molecular function,MF)主要包括转录因子结合、核受体活度、蛋白激酶结合、血红素结合、蛋白激酶活性、蛋白酶结合等。
KEGG信号通路富集结果显示,黄芩通过20条汇总通路(summary pathway)发挥作用。通过构建靶点-KEGG通路网络图,发现每条通路涉及多个靶点,每个靶点参与多条通路(见图7)。排除广泛通路后,显示黄芩主要通过癌症相关通路、PI3K-AKT信号通路、癌症相关蛋白聚糖、p53信号通路、内分泌抵抗、癌症中的转录失调、VEGF信号通路、NF-kappa B信号通路、AMPK信号通路等发挥抗胃癌作用。
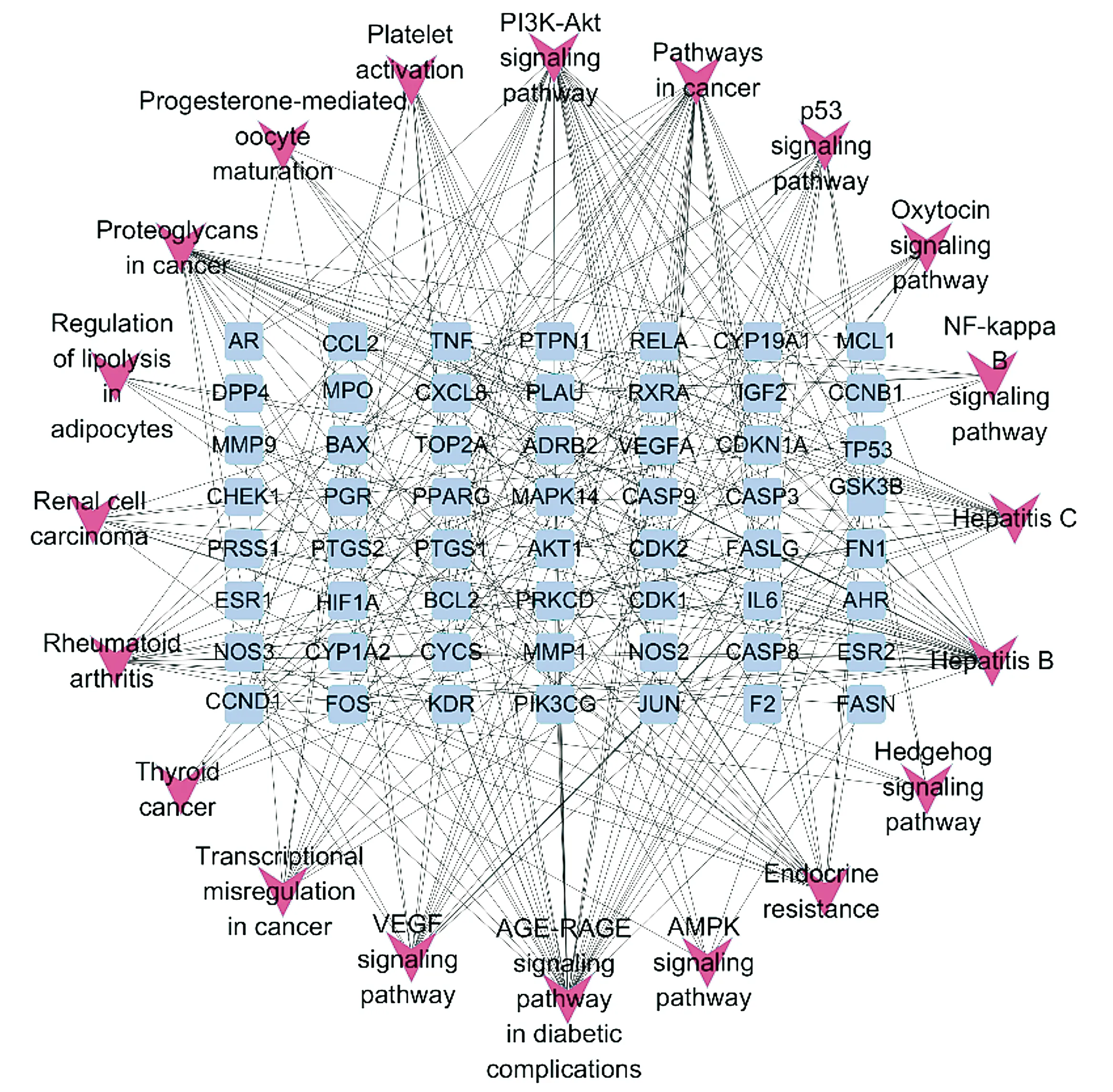
蓝色方形节点代表黄芩抗胃癌作用靶点,紫色三角形节点代表KEGG富集通路
2.6 分子对接
取PPI网络中度值前五的蛋白靶点和“黄芩活性成分-黄芩胃癌交集靶点”网络中度值前五的黄芩活性成分在Autodock软件中进行分子对接,对接结果见表2。结果显示前五的活性成分与核心蛋白靶点的结合能均低于-5 kJ/mol,说明具有较好的亲和力。通过比较发现,黄芩活性成分与AKT1、TP53以及VEGFA的结合能力较强,结合能主要在-8 kJ/mol左右,如汉黄芩素与AKT1,黄芩素与AKT1,黄芩素与TP53,苏荠苎黄酮与TP53,黄芩素与VEGFA,千层纸素A与VEGFA。而JUN和IL6与黄芩活性成分的结合能力相对较弱,主要在-5.5kJ/mol到-6.8 kJ/mol左右。主要黄芩活性成分与靶点分子的可视化对接结果见图8。
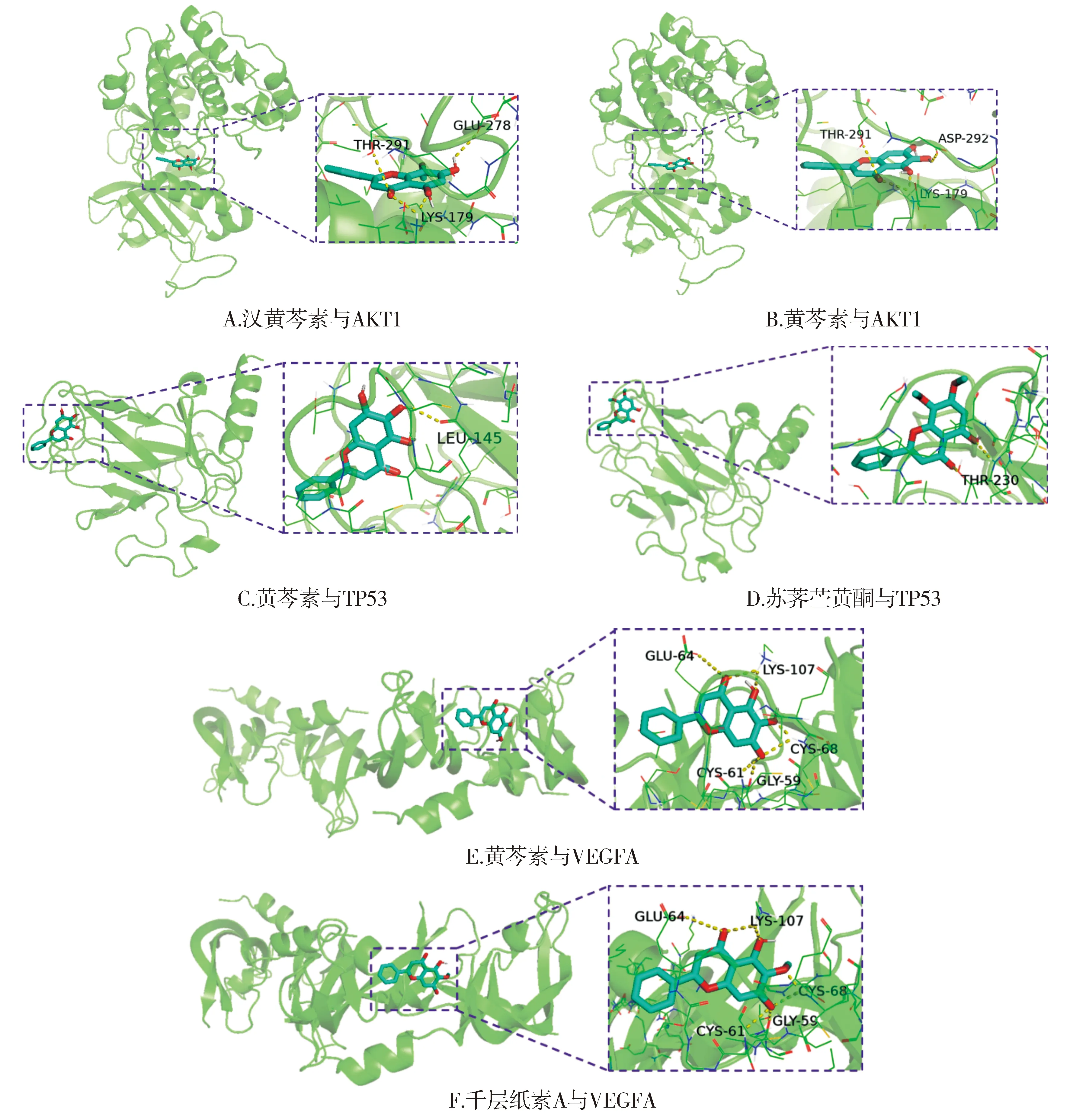
图8 黄芩活性成分与靶点分子对接可视化结果
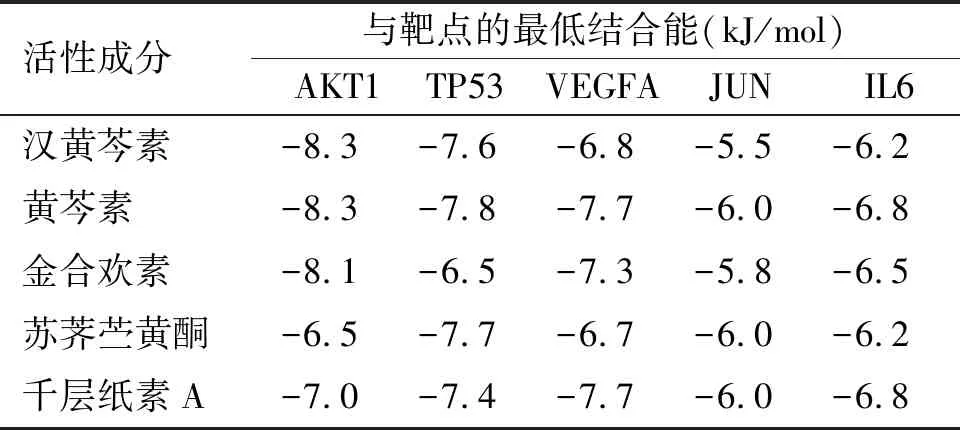
表2 黄芩活性成分与靶点分子对接结果
2.7 黄芩对胃癌细胞生长增殖及迁移的影响
用黄芩提取物处理胃癌细胞AGS和MGC803后,CCK-8检测细胞活力,发现黄芩提取物能够抑制胃癌细胞的生长增殖,且呈浓度依赖性(P<0.01,n=5,见图9)。在24 h时,黄芩提取物对胃癌细胞AGS和MGC803的IC50分别为168.9 μg/ml和357.4 μg/ml;48 h时分别为45.23 μg/ml和80.54 μg/ml。划痕实验结果显示黄芩提取物能够抑制胃癌细胞AGS的迁移(P<0.01,n=3,见图10)。
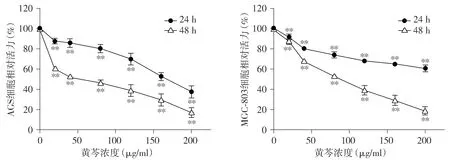
同时点与0 μg/ml相比,**P<0.01
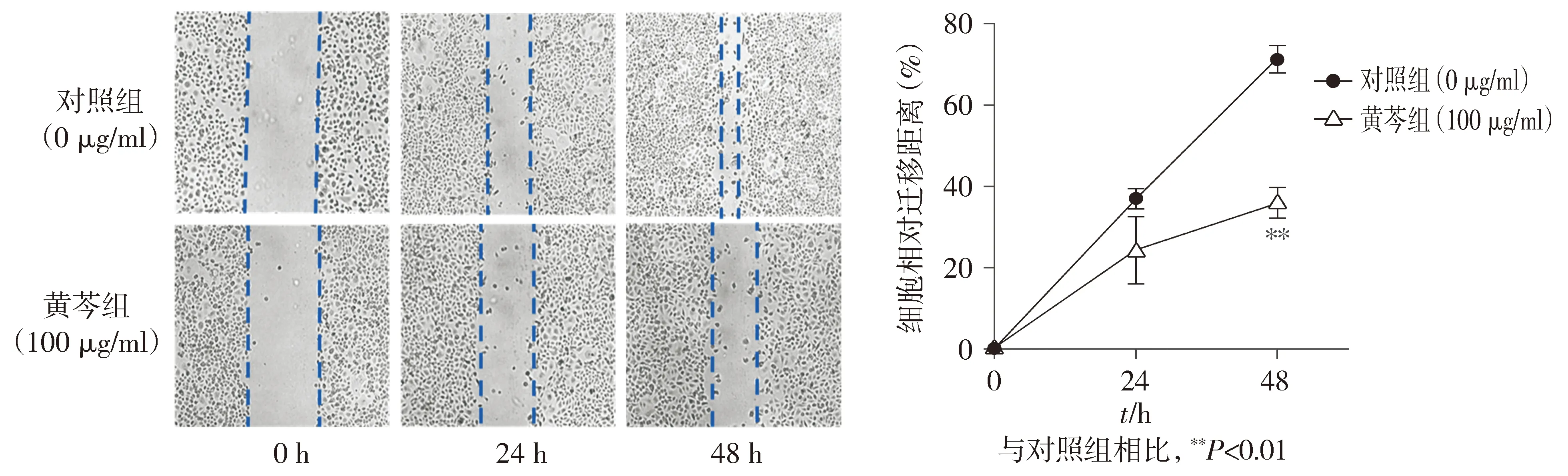
图10 黄芩提取物抑制AGS细胞的迁移
2.8 黄芩对Akt及p53蛋白表达的影响
蛋白免疫印迹实验结果显示,在AGS细胞中,与0 μg/ml相比,100 μg/ml黄芩提取物能够降低Akt的磷酸化水平(P<0.05,n=3),50 μg/ml和100 μg/ml黄芩提取物能够提高p53的表达水平,且呈浓度依赖性(P<0.05,n=3,见图11)。
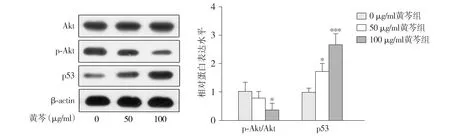
与0 μg/ml黄芩组相比,*P<0.05,***P<0.001
3 讨论
本研究基于网络药理学方法筛选出黄芩抗胃癌的主要活性成分为汉黄芩素、黄芩素、金合欢素、苏荠苎黄酮、千层纸素A。研究显示,汉黄芩素可调节多个靶点,包括转录因子、生长因子、蛋白激酶和其他酶类,影响细胞凋亡、细胞周期、细胞自噬、免疫细胞浸润、氧化应激、内质网应激、糖酵解等进程,发挥抗癌作用,是一种潜在的抗癌药物[15]。已有报道说明在胃癌中汉黄芩素可通过下调HIF-1α和MCT-4的表达[10]、阻碍NF-κB信号通路[16]、调节JNK和ULK1的磷酸化[17],抑制胃癌细胞的生长增殖和代谢,逆转肿瘤耐药,介导细胞的亚硝化应激和自噬。与汉黄芩素作用类似,黄芩素也可通过多通路、多靶点调控肿瘤细胞的凋亡、细胞周期、转移、自噬和免疫逃逸,发挥抗癌作用[18]。在胃癌中,黄芩素主要通过抑制PI3K/Akt相关通路,阻碍胃癌细胞生长和迁移[19],促进胃癌细胞的自噬和凋亡[20],增强胃癌细胞对化疗药物的敏感性[21],抑制胃癌细胞转移和血管生成[9],发挥其抗胃癌作用。金合欢素和千层纸素A也在多种恶性肿瘤中发挥治疗作用,但在胃癌中的报道较少,金合欢素可引起ROS升高及caspase级联反应诱导胃癌细胞凋亡[22],通过PI3K/Akt/Snail通路抑制胃癌细胞侵袭转移及上皮间充质转化[23]。千层纸素A可通过抑制Cdk7调控的Cdc2/p34介导的G2/M期细胞周期阻滞抑制胃癌细胞生长[24]。而目前还未有关于苏荠苎黄酮抗癌的报道。以上研究说明黄芩活性成分在促进胃癌细胞自噬和凋亡,抑制肿瘤转移,诱导细胞周期阻滞,增强胃癌细胞对化疗药物的敏感性等方面发挥着重要的作用。
经PPI网络筛选和分子对接验证我们得到AKT1、TP53、VEGFA、JUN、IL6是黄芩抗胃癌的主要作用靶点。靶点通路富集分析结果显示黄芩抗胃癌主要与PI3K/Akt、p53、VEGF等信号通路相关。AKT1(亦称AKT)是一种丝氨酸/苏氨酸激酶,是PI3K信号通路的核心分子,通过其下游多种靶分子如mTOR、NF-κB、MDM2、GSK3β等发挥凋亡抑制作用。AKT的失调与肿瘤细胞的增殖、凋亡抑制、糖代谢、脂代谢、血管生成等密切相关[25]。有文献报道汉黄芩素[26]、黄芩素[20]、金合欢素[23]均能通过抑制PI3K/AKT通路阻碍肿瘤细胞的生长。TP53是经典的抑癌基因,编码p53蛋白,汉黄芩素[27]能够使p53发生磷酸化和乙酰化,阻止MDM2介导的p53泛素化降解,进而提高p53的稳定性和蛋白水平,阻碍肿瘤有氧糖酵解。有研究发现黄芩素[28]可作为HDAC1和HDAC8的天然抑制剂,提高p53乙酰化水平,促进p53的抗肿瘤作用。同时千层纸素A[29]能够通过抑制CDK9来降低SIRT1和MDM2的磷酸化水平,调控p53的乙酰化水平及稳定性,促进癌细胞的凋亡。VEGFA是血管内皮生长因子(VEGF)家族成员,是血管生成的重要因子,在许多肿瘤中高表达,与肿瘤分期和进展相关。有报道发现,黄芩素[30]和金合欢素[31]能够降低VEGF的表达,但具体作用机制还不清楚。JUN,即AP1,是一种促癌基因,有研究发现黄芩素能够结合到AP1上,抑制c-jun和c-fos的表达,促进它们的酶解,从而抑制脐静脉内皮细胞的血管生成[32]。
我们通过体外细胞实验进一步验证了网络药理学和分子对接的筛选结果。实验结果显示黄芩提取物具有抑制胃癌细胞增殖、迁移的作用,且p53野生型细胞AGS的IC50较p53突变型细胞MGC-803的IC50更低,即p53野生型细胞AGS对黄芩的敏感性更高,说明p53有可能是黄芩抗胃癌的作用靶点。同时,黄芩提取物干预AGS细胞后,p-Akt的水平升高,p53的表达下降,进一步说明Akt和p53是黄芩抗胃癌的潜在作用靶点。
从网络药理学和细胞实验结果可知,黄芩抗胃癌的作用机制具有多成分、多靶点、多通路的特点,可能通过p53、Akt等核心靶点抑制胃癌细胞的生长增殖。这为后续黄芩抗胃癌的机制研究和临床应用提供了新思路和理论参考。但本研究也存在一定的局限性,如黄芩有效成分能否和靶点稳定结合,有效成分通过何种途径调控核心靶点的表达或活性,关键化合物之间是否存在协同作用等,这些问题还需要进一步的深入研究。

