人造子宫真的要来了?
周游

由科学传播者Hashem Al-Ghaili设计的人造子宫概念设施于去年12月亮相并引起热议。图/视觉中国
10月3日,日本《朝日新闻》播放了几条特殊鲨鱼在水箱中游动的画面。在橙红色的培养灯光下,它们的体表发出微微蓝光。日媒称,这是人类首次使用人造子宫培育并产下鲨鱼,此举将人造子宫技术的实际应用又向前推进了一步。去年12月,一则人造子宫工厂的8分钟短片曾引发热议,依据视频描述,未来女性可免受分娩之痛,每年数万婴儿在实验室中降生。
人造子宫技术领域最近大事不断。《自然》杂志于9月14日发表了专题报道,称人造子宫的人体试验可能很快就会启动。9月19日,美国食品药品监督管理局(FDA)召开了为期两天的独立顾问会议,讨论如何将人造子宫研究从动物转移到人类身上。这项技术已在世界范围内的数百只羔羊和一些仔猪身上进行过测试。
与《自然》的预测不同,此次FDA会议并未披露具体的人体试验方案。实际上,在未来一个阶段,人造子宫的首要目标是拯救早产儿,而非取代子宫。FDA儿科治疗办公室首席新生儿学家安·马萨罗在会议上发言称,目前最具挑战性的问题是“我们能接受多少不确定性”。多位与会专家表示,动物模型向人体试验的转换尚需时日,许多关键技术细节与伦理规范亟待完善。
日本冲绳某企业自2017年开始研究人造子宫装置,于今年成功用其培育出细尾灯笼鲨的胎儿,并进行了“人工分娩”。细尾灯笼鲨成年体长只有40~50厘米,是一种小型深海鲨鱼,广泛分布于太平洋地区。让它们发出蓝光的是位于体表的特殊发光器官。目前,世界自然保护联盟将其归类为“数据不足”,且没有长期饲养记录。日本研究者此举意在为细尾灯笼鲨的保护提供新方案。
新加坡国立大学产科副教授马修·肯普也在进行人造子宫系统的开发。他曾在FDA下属儿科咨询委员会发布的公开征询条目中发表过专业意见。该条目于今年7月在FDA官网开放,主题是评估人造子宫技术设备的安全性和有效性,这一征询为9月FDA顾问会议的召开作了铺垫。肯普在给《中国新闻周刊》的回复中称,人造子宫技术发展缓慢,只在近十年有了较多突破,珍稀物种的人工繁衍便是该技术的新兴应用领域之一。他指出,日本顺天堂大学在20年前就进行过胎羊的培育,最早的人造子宫模型可以追溯到1950年代。迄今为止,全球研究人员花了很长时间来填补各项技术空白。
人造子宫从外观上看并不复杂。它是一种充满液体、无菌且温度适宜的“袋子”,类似传统育婴室或孵化器的一个微缩改良版本。这一“袋子”通常由聚乙烯塑料制成,用于提供无菌环境。袋内充满人工羊水,模拟宫内环境,并与导管系统连接。此外,“袋子”还外接血液循环系统,代替了脐带的养分供给和代谢功能。研究人员可以透过这个半透明的袋子直接观察内部胎儿的发育过程。肯普称,2009年美国密歇根大学的一项研究开创了这一“袋子”模型,此后的人造子宫结构便以此为基准。这项研究中,研究者使用无泵导管系统,避免了机械泵对胎儿的伤害,成功使足月羔羊在宫外生存了4小时。
美国费城儿童医院(CHOP)在对“袋子”模型的拓展上走在前列。2017年,CHOP团队用8只胎羊进行试验,并发布了一段证明成果的视频。视频中,一只无毛苍白的羔羊侧卧在袋子中,被浑浊的人工羊水包裹着,双眼紧闭,鼻子和四肢频繁抽动。这只羊在人造子宫内度过了第28天,能够正常呼吸和游泳,生理上相当于妊娠 23~24 周的人类胎儿。2019年,CHOP团队几名成员加入了初创公司Vitara Biomedical,筹集了1亿美元用于人造子宫装置的优化开发。优化后的装置被命名为“新生儿发育子宫外环境”,即EXTEND。今年,CHOP团队凭借EXTEND向FDA提出申请,希望批准人造子宫的首次人体临床试验。
这项工作的负责人、CHOP 胎儿外科医生艾伦·弗莱克在FDA的会议上介绍,人体试验以获取该技术安全性和有效性的临床证据为目的,因而“非常必要”。他认为,如果人体试验成功,那么大多数早产儿将不必进入呼吸机,可以在人造子宫中继续生长。弗莱克同时介绍了EXTEND目前的稳定性表现,称团队已经在人造子宫里孕育了超过300多只羔羊,而且试验非常顺利。当被问及技术具体进步多少时,他拒绝回答,而选择私下与委员会讨论试验安排。会前,弗莱克也曾拒绝《自然》杂志的采访,理由是“利益冲突”和“专有信息的限制”。
世界范围内许多研究团队都在该领域寻求突破。荷兰埃因霍芬理工大学于2019年完成了类似胎羊模型的开发。2021年,《自然》刊发了以色列魏茨曼科学研究所关于小鼠胚胎宫外培养的成果。同年,郑州大学第一附属医院成功实施了国内首次人造子宫胎羊体外培育试验。该院肺移植外科主任医师赵高峰是此试验的负责人。他告诉《中国新闻周刊》,人造子宫技术发展较慢的一大原因是,目前还缺乏长期培养的解决方案。
赵高峰称,人造子宫有五大技术难点。其一是恒温,这在目前的技术条件下已经不成问题。其二是供氧,羊水中的胎儿所需氧气不需要通过呼吸获得,而是通过脐带血输送,在人造子宫里则借助体外膜氧合(ECMO)方式获得。这套系统依靠血管插管将血液导出,在体外人工肺里进行氧合后,再输回胎儿体内。但由于插管本身的限制,ECMO运转过程中,胎儿会出现多种并发症,影响供氧效率。其三、四分别是营养和排泄。胎儿发育所需营养的输送以及废物代谢过程,在人造子宫中都通过循环系统实现。循环系统本身的维护和稳定性依然需要优化,并且这一过程很可能带来第五大难点——感染。
赵高峰回忆,其主导的胎羊试验经历了长时间、多次失败,总共试验羊超过10只。试验过程中需要不断更换人工羊水,如果不慎混入病菌,在广谱抗生素无效的情况下,胎羊很容易感染并引发脓毒败血症。CHOP團队能够把人造子宫里的胎羊培育到28天,而国内团队只达到一周左右,前者装置先进性带来的感染防范水平差异是关键。他认为,长期维持人造子宫稳定性在世界范围内依然存在技术短板。
日本企业研究者表示,试验初期,人造子宫培育的鲨鱼在孵化期结束后,都被直接放入海水箱培养,然而它们几天后全部死亡。他们认为,鲨鱼宝宝们在产后无法及时适应海水环境。此后,研究者开发了一种海水适应方案,让人造子宫内的环境在产前逐步转向海水,然后再转入海水箱培育。新一批试验的其中一只鲨鱼在该方案下存活了七个多月,是该物种目前最长的圈养纪录。这也意味着人造子宫胎儿的长期培养通常有着更高的技术要求。
《自然》杂志在专题报道中提到,EXTEND也许是目前最接近人体试验的方案。然而此次FDA会议未能按既定日程投票。肯普指出,为了批准试验,FDA官员需要确信胎儿能够从EXTEND中受益,且发育表现应该不劣于接受当前标准护理的胎儿,而这很难从动物试验进行外推。他认为,该领域必将继续取得进展,但目前无法证明启动人体试验的合理性。在考虑这项技术的应用前,还有大量的重复工作。
此外,有分析指出,现在的人造子宫模拟环境还不够稳定,装置复杂性也不足,与热议视频中“人造子宫工厂”的设想尚有距离。即使这一设想理论上可以实现,也将面临许多现实操作和伦理上的壁垒。
美国堪萨斯城儿童慈善中心新生儿医生斯蒂芬妮·库科拉在给《中国新闻周刊》的回复中称,羔羊的妊娠期与人类不同,器官发育时间也不同。选择羔羊模型主要为了模仿人类在妊娠 22~24周时的肺部发育,且相关发育阶段的胎羊适合操作。实际上,在这一阶段,胎羊比人类胎儿要大得多,而且它们的大脑发育处于不同的阶段。因此,EXTEND现有数据不能确定人体试验会像胎羊一样成功。

左:妊娠107天的羔羊在人造子宫中生存第4天;右:同一羔羊在第28天显示体细胞在生长和成熟。图/《自然通讯》
在FDA会议上,专家们一致同意,开发人造子宫技术对于帮助挽救一些早产儿、特别是超早产儿的生命至关重要。早产儿在传统护理所使用的恒温箱中时,需要用自己发育尚未完全的肺呼吸,容易造成肺部损伤和感染,CHOP团队也表示,这项技术最根本的目的是模拟自然子宫,改善超早产儿的结局。
世界卫生组织(WHO)将早产定义为妊娠37周之前出生,而超早产儿指妊娠28周之前未足月出生的胎儿。早产可能自然发生,也可能因为特殊情況如感染、激素失衡、高血压或糖尿病等,导致子宫不适合胎儿生存而早产。今年5月,包括WHO在内的多个机构联合发布的最新报告称,2019年,早产已成为5岁以下儿童死亡和残疾的最大原因,当年与早产相关的并发症导致约90万人死亡。2020年,全球约有1340万例早产,其中近100万死于早产并发症。
报告指出,死亡率与婴儿出生时的胎龄密切相关。通常,胎儿在子宫内安全停留的时间越长,长期存活和健康的几率就越高。22周或之前被认为是胎儿生存能力的关键时期,此时期很少有胎儿能在子宫外存活。到28周时,大多数都可以存活,但通常需要大量的生命支持。CHOP团队表示,肺和大脑是人类最后完全成熟的器官,因此胎儿出生后的长期健康问题需要监测。
2022年,《美国医学会杂志》刊登了美国爱荷华大学研究员爱德华·贝尔团队的研究。他们构建了2013~2018年美国多地的病例数据集,提出妊娠22、23、24、25和26周时积极治疗的极早产儿的 1 年生存率分别为30%、55.8%、71.4%、79.9%和88.1%。也就是说,妊娠24周时,71.4%的婴儿能存活到1岁。贝尔数据集及其研究结论在FDA会议上作为推行人造子宫的有力证据而被反复提及。但肯普认为,当前数据表明,仍无法提倡对胎龄24周或以上的婴儿使用未经测试的人造子宫系统,因为它将很难与70%以上的生存率竞争。
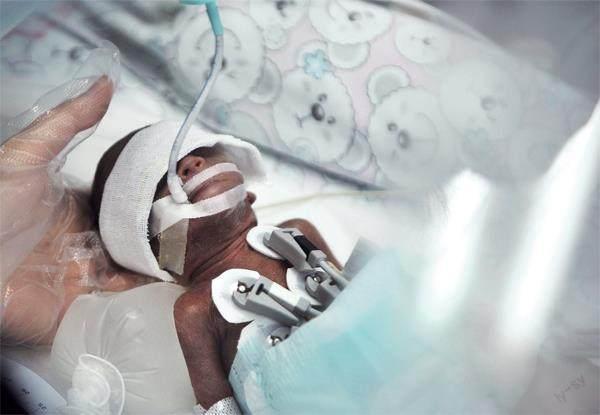
对极早产婴儿的护理显著提高了生存率,但长期的健康问题仍然需要监测。重庆西南医院儿科监护室一名早产宝宝,体重只有660克。图/中新
赵高峰认为,人造子宫技术的用途就是将需要手术的胎儿从母体中取出,让体外手术成为可能。人造子宫可以提供稳定手术环境,将可操作时间从体内的几分钟至半小时,延长到体外的数小时。从临床角度讲,这对于患有先天性畸形等疾病的婴儿有重要意义。先天性病变发育到一定程度之后,会危及胎儿生命,所以需要在合适时间点处理掉畸形或者缺陷,而体外处理可以避免宫内手术的流产风险。因此,人造子宫对于缺陷早产儿护理有着重要意义。
库科拉强调,人们倾向于高估人造子宫的应用前景。该技术是新生儿重症监护的一种替代治疗方案,而非所谓“机器代孕”“胎儿工厂”,更不可能完全替代正常妊娠过程。她举例说,通常情况下超早产儿因肺部发育不完全而容易呼吸衰竭,需要接受机械通气,也即用呼吸机向肺部提供气压。虽然可以挽救生命,但也会对脆弱的肺组织造成创伤,长远来看有疤痕和炎症风险,从而导致支气管肺发育不良(BPD)等病症。患有严重 BPD 的婴儿可能需要长期住院,有时需要长期呼吸支持。人造子宫采用ECMO进行体外氧合,有望消除机械通气造成的组织损伤,减少BPD发病率,提升存活率。
CHOP团队希望EXTEND能减少早产儿的其他并发症,如脑出血等,但动物试验尚不支持这些症状与治疗方法的关联。FDA在会议简报中指出,人造子宫研究在早产儿领域很有前途,但监管和伦理问题需要进一步讨论,因此不对媒体公众开放更多信息。
目前,胎羊28天的存活时长已经达到了学界公认的伦理上限。这些胎羊在试验后都受到了安乐死处理。在被问及人造子宫可能带来的伦理问题时,多位受访者认为,合理的试验设计将有助于减轻这项研究的道德挑战,而其中筛选病例是重要一步。库科拉称,需要通过初期对照试验,来排除那些通过常规治疗很可能获得良好结果的患者。因此,筛选机制应该是严苛的,在此基础上再预估使用人造子宫的安全性和必要性,例如是否有较高并发症风险、呼吸机是否已无法充分支持患者呼吸等。另外,超早产的剖腹产会给孕妇及其未来的生育带来额外风险,这也是试验设计需要考虑的问题。
库科拉还强调,应确保试验参与者充分了解该技术的风险和益处。现有研究表明,患者有时会因为过度信任治疗或治愈可能性而盲目同意参与研究,即使研究人员解释了相关风险。机构审查委员会和利益相关者需共同参与试验设计,从而保证信息在参与者与研究者间是平等的,最大程度避免风险。
赵高峰指出,国内在人体试验方面还处在探索阶段。所有新技术的发展,特别是临床研究都需要过伦理这一关。他举例称,近几年,美国进行了多例异种器官移植,包括两例心脏移植和两例肾脏移植,都按特别病例处理,伦理审查过得非常快。他希望国内在一些开创性领域,伦理方面能更加开放和包容。
今年,赵高峰所在的郑州大学第一附属医院将联合浙江医科大学第二附属医院、郑州大学第三附属医院团队,联合申报国家级课题《人造子宫的基础研究及临床应用》,以期对人造子宫的可能性问题进行更加深入的探讨。赵高峰表示,该课题将脱离胎羊范畴而向人体试验进发,争取在两年以内有重大突破。但目前伦理环节还待审核。
除了伦理不确定性外,肯普认为,考虑人体试验前,需要更多关于胎儿免疫、内分泌和器官生长的信息。监管机构应定义标准化指标,包括体重、内分泌成熟度、循环量等,以促进人造子宫系统的使用。目前,这类定义还属空白,不同系统的实验数据缺乏标准化,将限制系统评估的客观性。当人造子宫应用在生长受限、被感染和炎症困扰的早产胎儿身上时更应注意,因为异常指标需要比正常指标更加精确,以评估胎儿的实际健康状况。

