基于TGF-β1/FOXP3/RORγt信号通路探讨芦荟多糖对小鼠自身免疫性甲状腺炎的保护作用
吴朝文,谢小红,黎清现,魏洪发,刘娇
(深圳市龙华区中心医院内分泌科,广东 深圳 518110)
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是一种典型的器官特异性自身免疫性疾病,主要以血清甲状腺自身抗体水平升高和甲状腺组织损伤为主要特点,甲状腺组织存在不同程度的淋巴细胞和单核细胞浸润并伴有甲状腺细胞凋亡和滤泡结构破坏,最终导致甲状腺功能减退、临床甲状腺肿或甲状腺组织纤维化[1]。据国外流行病学显示,AIT 患病率占总人群的1%~2%,可发生在任何年龄段,女性发病约为男性的10 倍[2]。近年来研究表明AIT 的发病与遗传因素、环境因素、自身免疫、炎症、氧化损伤、凋亡等因素密切相关[3]。在AIT 早期,目前缺乏有效的治疗方法和药物来阻止疾病的进程,当患者出现甲状腺功能减退时,只能使用左旋甲状腺素替代治疗,存在停药后易复发和对甲状腺自身抗体水平改善作用较小等弊端[4],因此寻找高效低毒的抗AIT新药仍是目前研究的重点。
芦荟为百合科植物库拉素芦荟Aloe barbadmsis Miller、好望角芦荟Aloe ferox Miller或其他同属近缘植物叶的汁液浓缩干燥物。作为一种常用传统中药,其药用价值很高,最早被1963年版《中华人民共和国药典》(第一部)收为药用,并一直录用至今。芦荟具有泻下通便、清肝泻火、杀虫疗疳的功效[5]。近年来研究发现其主要有效成分-芦荟多糖具有免疫调节、抗氧化、抗炎、抗凋亡、抗辐射、抗病毒、抗肿瘤等药理作用[6]。芦荟多糖可能通过免疫和炎症调节功能改善AIT,这也是本研究需要验证的科学问题。
1 材料与方法
1.1 药物与试剂
芦荟多糖(成都超九八生物科技有限公司,批号:20220311);完全弗氏佐剂、不完全弗氏佐剂、碘化钠和PTg(Sigma 公司);小鼠TPOAb 化学发光试剂盒和小鼠TGAb 化学发光试剂盒(上海抚生实业有限公司);小鼠TNF-α、IL-1β、IL-10、IL-17 ELISA检测试剂盒(上海江莱生物科技有限公司);小鼠FOXP3、IL-17A、TGF-β1、FOXP3 和RORγt 单抗(中杉金桥公司);小鼠FT3、FT4和TSH ELISA 检测试剂盒(武汉华美生物工程有限公司)。
1.2 主要仪器
JY-ZY5 型WB 转膜电泳仪(北京君意华鑫科技有限公司);DGG-9070B电热鼓风干燥箱(上海森信实验仪器有限公司);LG10-2.4A 型超速离心机(北京医用离心机厂);550 酶标测定仪(日本Bio-red 公司);FA1004型电子天平(上海天平仪器厂)。
1.3 实验动物
SPF 级2 月龄雌性C57BL/6J 小鼠30 只,购于辽宁长生生物技术股份有限公司,生产许可证号:SCXK(辽)2020-0001,实验经广东医科大学动物实验伦理委员会批准,批准号:GDMU-2022-000538。
1.4 方法
1.4.1 分组与给药 小鼠于SPF 级环境适应性喂养1 周后开展实验,并随机分为正常组、模型组和芦荟多糖组(LHDT),每组10 只。其中芦荟多糖组灌胃给药300 mg/(kg·d),其余两组灌胃给予等量生理盐水。药物干预4 周取材。模型组以及LHDT 组通过皮下多点注射PTg+高碘水法建立小鼠AIT模型,模型的建立参照文献[7]。
1.4.2 指标检测 给药干预4周后,异氟烷麻醉小鼠,摘眼球取血,血液4 ℃静置2 h。4 ℃下3 500 r/min离心10 min,随后分离血清,ELISA法分别检测各组小鼠血清FT3、FT4、TSH、TGAb、TPOAb、TNF-α、IL-1β、IL-10、IL-17 水平。采血结束通过颈椎脱臼处死小鼠,小心分离并获得甲状腺,生理盐水冲洗干净,滤纸吸干,用10%(φ)中性甲醛溶液固定24 h,常规石蜡包埋切片、HE 染色以及封片,光镜下观察甲状腺的组织病理学变化。用玻璃匀浆器于冰上制备10% 甲状腺匀浆,4 ℃下3 500 r/min 离心10 min,分离上清,严格按照ELISA检测说明书步骤检测各组小鼠甲状腺STAT3、RORγt、FOXP3、TGF-β、IL-10 和IL-17 水平。免疫荧光法检测FOXP3 和IL-17A 水平:甲状腺石蜡切片组织分别经二甲苯、梯度乙醇和纯化水水化后,0.5%TritonX-100 室温通透20 min,封闭、孵育一抗FOXP3(1∶2 000)和IL-17A(1∶2 000)、洗片、孵育荧光标记二抗(1∶200)、封片,共聚焦荧光显微镜下观察拍照。Western blot 法检测甲状腺TGF-β1、FOXP3 和RORγt 蛋白表达水平:加入适量RIPA 裂解液裂解甲状腺,4 ℃下10 000 r/min 离心10 min,分离上清,BCA 试剂盒检测甲状腺总蛋白浓度,分别进行SDS-聚丙烯酰胺凝胶电泳、转膜、封闭、孵育一抗TGF-β1(1∶2 000)、FOXP3(1∶2 000)和RORγt(1∶2 000)过夜、洗膜、孵育二抗(1∶5 000)、洗膜、显影,Image J 软件分析条带灰度值。
1.5 统计学方法
采用SPSS 22.0 软件进行统计学分析。实验数据用表示,多组间比较采用单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠甲状腺病理形态学变化
正常组小鼠甲状腺腺泡均匀分布且未见炎症细胞浸润。模型组小鼠甲状腺大部分滤泡上皮变性坏死,见大量淋巴细胞浸润。与模型组比较,芦荟多糖组小鼠可明显改善甲状腺上述病理学变化。见图1。
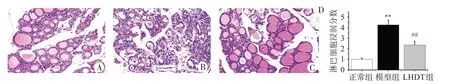
图1 各组小鼠甲状腺病理形态学观察(HE染色,n=10,10×)Figure 1 Histopathological changes in the thyroid gland of mice in each group(HE staining,n=3,10×)
2.2 各组小鼠血清FT3、FT4、TSH、TGAb 和TPOAb水平
与正常组比较,模型组小鼠血清FT3和FT4水平明显降低,而TSH、TGAb 和TPOAb 水平明显升高(P<0.01)。与模型组比较,LHDT 组小鼠血清FT3和FT4水平明显升高,而TSH、TGAb 和TPOAb 水平明显降低(P<0.01)。见表1。
表1 各组小鼠血清FT3、FT4、TSH、TGAb和TPOAb水平Table 1 Serum levels of FT3,FT4,TSH,TGAb and TPOAb in each group of mice(±s,n=10)
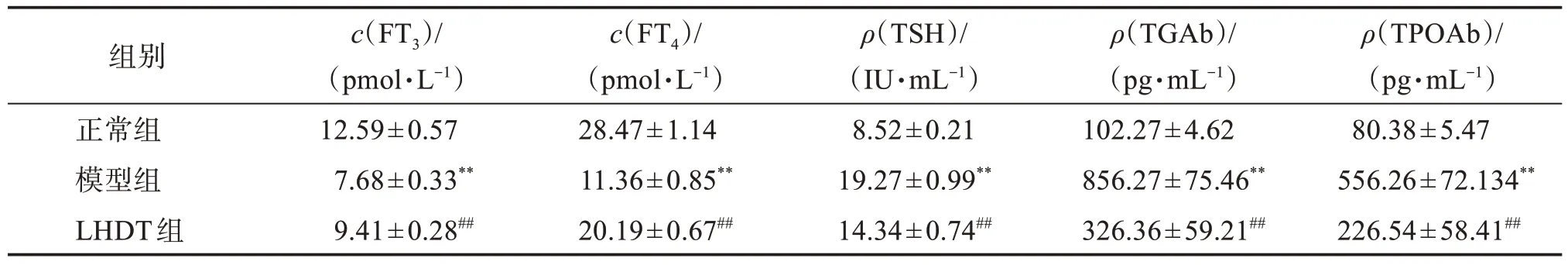
表1 各组小鼠血清FT3、FT4、TSH、TGAb和TPOAb水平Table 1 Serum levels of FT3,FT4,TSH,TGAb and TPOAb in each group of mice(±s,n=10)
与正常组比较:**P<0.01;与模型组比较:##P<0.01。
组别正常组模型组LHDT组c(FT3)/(pmol·L-1)12.59±0.57 7.68±0.33**9.41±0.28##c(FT4)/(pmol·L-1)28.47±1.14 11.36±0.85**20.19±0.67##ρ(TSH)/(IU·mL-1)8.52±0.21 19.27±0.99**14.34±0.74##ρ(TGAb)/(pg·mL-1)102.27±4.62 856.27±75.46**326.36±59.21##ρ(TPOAb)/(pg·mL-1)80.38±5.47 556.26±72.134**226.54±58.41##
2.3 各组小鼠血清TNF-α、IL-1β、IL-10和IL-17水平
与正常组比较,模型组小鼠血清TNF-α、IL-1β和IL-17 水平明显升高(P<0.01)。与模型组比较,LHDT 组小鼠血清TNF-α、IL-1β和IL-17 水平明显降低(P<0.01),而IL-10 水平明显升高(P<0.01)。见表2。
表2 各组小鼠血清TNF-α、IL-1β、IL-10和IL-17水平Table 2 Serum levels of TNF-α,IL-1β,IL-10 and IL-17 in each group of mice (±s,n=10)ρ/(pg·mL-1)

表2 各组小鼠血清TNF-α、IL-1β、IL-10和IL-17水平Table 2 Serum levels of TNF-α,IL-1β,IL-10 and IL-17 in each group of mice (±s,n=10)ρ/(pg·mL-1)
与正常组比较:**P<0.01;与模型组比较:##P<0.01。
组别正常组模型组LHDT组TNF-α 61.28±5.34 358.64±72.55**127.95±39.61##IL-1β 82.74±17.36 457.82±74.69**129.37±37.68##IL-10 89.61±2.38 101.52±9.29 156.48±15.88##IL-17 8.74±1.85 56.43±9.76**26.69±5.72##
2.4 ELISA 法检测各组小鼠甲状腺STAT3、RORγt、FOXP3、TGF-β、IL-10和IL-17水平
与正常组比较,模型组小鼠甲状腺STAT3、RORγt、FOXP3、TGF-β、IL-10和IL-17水平明显升高(P<0.05)。与模型组比较,LHDT 组小鼠甲状腺STAT3、RORγt 和IL-17 水平明显降低(P<0.01),而FOXP3、TGF-β和IL-10 水平明显升高(P<0.01)。见表3。
表3 各组小鼠甲状腺STAT3、RORγt、FOXP3、TGF-β、IL-10和IL-17水平Table 3 Levels of STAT3,RORγt,FOXP3,TGF-β,IL-10 and IL-17 in thyroid of mice in each group(±s,n=10)
与正常组比较:*P<0.05,**P<0.01;与模型组比较:##P<0.01。
组别正常组模型组LHDT组STAT3/(pg·g-1)5 012.33±588.94 21 125.54±1 021.75**12 362.68±815.67##RORγt/(ng·g-1)52.64±6.28 326.53±61.89**124.62±39.87##FOXP3/(pg·g-1)3 254.24±125.12 4 325.76±605.35*5 123.52±401.65##TGF-β/(pg·g-1)8 268.39±426.62 11 325.58±804.41**14 123.66±409.65##IL-10/(pg·g-1)4 235.61±429.96 6 363.69±612.67**8 174.78±810.25##IL-17/(pg·g-1)255.48±26.32 729.85±64.74**426.25±62.22##
2.5 免疫荧光法检测各组小鼠甲状腺FOXP3 和IL-17A水平
与正常组比较,模型组小鼠甲状腺IL-17A 水平明显升高(P<0.01)(图2J-O 和T)。与模型组比较,LHDT 组小鼠甲状腺FOXP3 水平明显升高(P<0.01),IL-17A 水平明显降低(P<0.01)(图2D—I、M—R、S、T)。
2.6 Western blot 法检测各组小鼠甲状腺TGF-β1、FOXP3和RORγt表达水平
与正常组比较,模型组小鼠甲状腺TGF-β1、FOXP3 和RORγt 水平明显升高(P<0.05)。与模型组比较,LHDT 组小鼠甲状腺FOXP3 水平明显升高(P<0.01),而TGF-β1 和RORγt 水平明显降低(P<0.01)。见图3。
3 讨论
基于目前治疗AIT尚无特效药,而中药具有副作用小以及作用靶点多等优势,可能是潜在的抗AIT新药的重要来源。长期以来芦荟一直被认为是一种高效的免疫增强剂,其免疫调节作用已被广泛报道,例如可改善淋巴细胞增殖、激活补体和抗炎作用[8-9]。而芦荟多糖已被证实是芦荟主要的免疫调节化合物[10]。TGAb和TPOAb水平的上调以及甲状腺大量的淋巴细胞浸润是AIT的重要诊断标志物。FT3、FT4和TSH 是临床上甲状腺功能检测的重要指标。研究发现模型组小鼠甲状腺大部分滤泡上皮变性坏死以及大量淋巴细胞浸润,血清TSH、TGAb和TPOAb水平显著升高,而FT3和FT4水平明显降低,提示AIT小鼠模型建模成功。芦荟多糖干预后可有效改善甲状腺上述病理学变化和甲状腺功能。
免疫因素在AIT 的发生发展中起着重要作用[11]。在AIT期间,甲状腺被T 细胞浸润,T 细胞介导的自身免疫性损伤是其关键发病机制。在自身抗原的刺激下,Treg 细胞和其他T 细胞亚群在胸腺中发育。CD4+T 淋巴细胞在免疫中起着至关重要的作用。未成熟CD4+T 淋巴细胞被抗原提呈细胞、CD28 等共刺激分子激活,在IL-6 联合IL-1β、IL-23和TGF-β诱导下分化为Th17 细胞[12-14]。CD4+T 细胞作用于靶细胞,促进促炎细胞因子IL-17A 的分泌。RORγt 被认为是发育的关键转录因子并诱导IL-17A 的分泌[15-16]。而Th17 细胞参与了AIT的发生发展已被证实[17]。本研究发现,模型组小鼠甲状腺RORγt、TGF-β和IL-17A水平明显升高,而芦荟多糖可显著降低RORγt、TGF-β和IL-17A水平,从而减轻AIT的炎症进程。Treg 细胞是CD4+T 细胞的一个亚型,Treg 细胞在维持免疫耐受起着关键作用。其免疫耐受功能的维持需要FOXP3 的调节。Treg细胞通过分泌TGF-β和IL-10 抑制机体免疫反应,FOXP3 在TGF-β作用下诱导Treg 细胞的成熟,而RORγT 诱导Th17 细胞的成熟[18]。Treg 细胞和Th17细胞在慢性炎症和自身免疫性疾病中发挥重要作用[19]。本研究发现模型组小鼠甲状腺TGF-β1、FOXP3 和RORγt 蛋白表达水平明显上调。给予芦荟多糖可明显上调FOXP3 蛋白表达水平,下调TGF-β1和RORγt水平。提示芦荟多糖通过TGF-β1/FOXP3/RORγt 信号通路调节机体免疫功能改善AIT。
综上所述,芦荟多糖对AIT具有较好的保护作用,其作用机制可能是通过调控TGF-β1/FOXP3/RORγt信号通路进而影响机体免疫功能。

