等离子体处理对紫云英种子萌发和生理特性的影响
李想,张梦,刘春增,朱益飞,叶晓馨*
(1. 安徽大学资源与环境工程学院,安徽 合肥 230601;2. 河南省农业科学院植物营养与资源环境研究所,河南 郑州 450002;3. 空军工程大学航空工程学院,陕西 西安 710038)
紫云英(Astragalus sinicus)又名红花草、草子等,豆科(Leguminosae)黄芪属(Astragalus)一年生或越年生草本植物,是我国南方稻田主要冬季绿肥作物,具有土壤改良,提高轮种作物产量和品质的作用[1-2]。亦可作为优质饲料、蜜源植物、药材以及蔬菜等进行综合利用[3-4]。随着社会对生态环境以及食品安全要求的不断提高,作为兼具饲草、蜜源功能的重要绿肥作物,紫云英具有广阔的应用前景和推广价值。然而,紫云英种皮较厚,硬实期可达110 d 以上,成为异地加代及跨区域生产调拨的重要限制因素[5]。同时,紫云英为无限花序草本植物,不同着生部位荚果种子的成熟期可相差14~20 d[6]。成熟度的差异进一步加剧种子硬实度的变异性,对种子发芽一致性及苗期管理造成影响。因此,深入研究打破种子硬实、提高种子活力的生理机制、开发配套技术,对于紫云英加代繁育及标准化生产技术的推广具有重要意义。
目前种子播种前处理的方法主要有物理处理(超声波、电场、离子束等)和化学处理(化学药品和杀菌剂),强烈的超声波或电场可能会损害种子细胞,化学方法成本昂贵且化学残留会污染环境[7]。等离子体处理是近年来逐渐发展起来的种子处理技术,具有高效、无污染和适用性强等特点,能够打破种子休眠,提高种子萌发速度和出苗一致性,增强种子活力,有效提升幼苗建立率[8-9]。Mazandarani 等[10]用介质阻挡放电等离子体处理大麦(Hordeum vulgare)种子,结果表明80 W 处理条件下大麦种子发芽率增加了18%,同时种子活力指数、芽长和根长分别增加了67%、39%和32%。范月君等[11]的研究表明,不同豆科牧草种子的最佳等离子体处理条件不同,其中苜蓿(Medicago sativa)种子在260 W 等离子体处理下发芽率最高,幼苗苗高、根长以及生物量均显著高于对照;而扁蓿豆(Medicago ruthenica)等离子体最佳处理为140 W,发芽率较对照提高18%,幼苗的苗高、根长以及生物量均显著高于对照。
Guo 等[7]的研究认为等离子体处理促进小麦(Triticum aestivum)种子萌发和幼苗生长的原因可能是等离子体激发使小麦种皮软化,吸水性增强,同时等离子体产生的活性物质如活性氮和活性氧渗入种子内部,引起可溶性蛋白的积累(较对照提高15%)。谢成燊[12]和Dobrin 等[13]的研究表明,适宜的等离子体处理有助于调控与种子萌发相关基因及激素的表达,降低种子表观接触角,增加种子湿润性,从而加速种子发芽。除此之外,近年研究认为等离子体处理能够增强作物抗逆性,提高作物对外界环境变化的适应能力[14]。汤小婷等[15]的研究表明,等离子体处理后的穿心莲(Andrographis paniculata)种子,育苗一个月后,幼苗超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)活性分别比对照提高 22%、33%和34%,而丙二醛(malondialdehyde,MDA)含量降低了12%,幼苗的抗逆性显著增强。等离子体处理能够显著提高小麦幼苗在干旱胁迫下的抗氧化酶活性和渗透调节能力,小麦幼苗的SOD 和CAT 活性显著高于对照,MDA 含量比对照降低13%,脯氨酸(proline)和可溶性糖(soluble sugar)含量分别比对照高13%和16%,同时刺激了蔗糖非发酵型蛋白激酶2 和Δ1-吡咯啉-5-羧酸合成酶的合成以抵抗干旱胁迫,有效缓解了干旱胁迫对小麦幼苗生长的不利影响[16]。因此等离子体处理是一种有效的提升种子活力的方法,可以作为种子播种前处理的一种替代方法。
高活力的种子具有显著的生长优势和生产潜力以及逆境胁迫的适应能力,是紫云英产业发展的基本保障。但目前有关等离子体处理对紫云英种子活力和幼苗生长效应影响的研究报道较少。因此,本研究选取了萌发率较高的2 个具有代表性的紫云英地方品种(信紫1 号,赣紫75-3-51)作为研究对象,通过响应面分析法研究不同等离子体处理时间及剂量对紫云英种子萌发、活力、幼苗生长、抗氧化酶活性以及渗透调节产物的影响。由于供试紫云英种子萌发情况较好,因此本研究试图明确能够改善紫云英种子生理代谢,恢复或提高种子抗逆性的等离子体最佳处理条件,进而探讨等离子体处理对紫云英种子的作用机理,以期为开发有效安全环保的紫云英种子播前处理技术提供一定的理论依据和实践指导。
1 材料与方法
1.1 供试材料与试验装置
试验用紫云英品种为信紫1 号和赣紫75-3-51(简称信紫和赣紫),由国家绿肥产业技术体系信阳综合试验站当年扩繁提供,收获保存期30 d。其中信紫是由河南省农业科学院选育而成的高产、优质的紫云英品种,是豫南地区主推紫云英品种,生育期250 d 左右,在越冬期和返青期,信紫会积累大量花青素,叶片呈紫红色。赣紫是江西省农业科学院选育的品种,抗寒力、耐湿性强,抗病性中等,生育期208 d 左右,在越冬期和返青期,叶片呈深绿色。在紫云英生长的不同时期,赣紫的表型性状变异系数总体较信紫高[17-19]。本试验采用的等离子体放电方式为低气压介质阻挡放电,设备装置由纳秒脉冲等离子源(西安空天紫电等离子体有限公司)和自行设计的真空装置组成。装置原理如图1 所示,电源的上下两极板之间连接绝缘介质,种子置于绝缘介质之间。在接通电源前先打开真空泵,使玻璃罩内保持低压环境(1~3 kPa),示数由气压计读出,待示数稳定后打开电源,等离子源在电极两端施加交流电压(设定频率为20 kHz,调制频率为200 Hz,调制占空比50%),绝缘介质之间气体被电离,产生等离子区域。
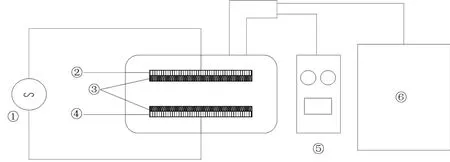
图1 低温等离子体种子处理装置原理Fig.1 Schematic of low-temperature plasma seed treatment device
1.2 种子处理方法和萌发实验
本实验于2022 年3-4 月在安徽大学资源与环境工程学院实验室进行,重复3 次。实验采用不同强度电压和时间对2 个紫云英品种的种子进行处理,等离子体处理电压分别为7、8、9 kV,处理时间分别为1、3、5、10 min,将不进行任何处理的紫云英种子作为对照(CK),每个处理设置6 个重复。选取表面光滑完整,大小基本相同,无明显缺陷的紫云英种子,处理前先用95%乙醇浸泡1 min 以去除种子表面微生物,然后用蒸馏水冲洗3 遍,用滤纸吸干表面水分。紫云英种子进行等离子体处理后,将CK 组和处理组种子均匀放置在铺有两层滤纸的直径为90 mm 的圆形培养皿中,每个培养皿放置50 粒种子,加入8 mL 蒸馏水,实验期间根据情况加入适量蒸馏水,保证滤纸湿润但不积水。将装有紫云英种子的培养皿置于恒温培养箱中培养,在前期的预实验中,发现温度设置为25 ℃时,种子发芽率最高且幼苗生长状况最好,因此培养箱温度设置为25 ℃,光照条件为连续黑暗[20]。
每天统计发芽的种子数,连续统计5 d,发芽标准以胚根突破种皮2 mm 为准,以此计算种子的发芽率、发芽势、发芽指数和活力指数[21-22]。发芽率=(试验中发芽种子数/供试种子总数)×100%;发芽势=(前3 d 发芽种子数/供试种子总数)×100%;发芽指数(germination index,GI)=∑(Gt/Dt)(Gt为置种后第t天的发芽数,Dt为发芽天数);活力指数(vigor index,VI)=GI×S(GI 为发芽指数,S 为幼苗总长)。
1.3 生物量及生理指标测定
将培养皿中的种子继续培养至第7 天,每个培养皿随机选取10 株测量胚根长、胚芽长,整个植株鲜重,并计算根芽比(胚根长/胚芽长)。之后研磨提取紫云英幼苗,测量其抗氧化酶活性、MDA 及渗透调节产物含量。SOD采用氮蓝四唑光化还原法测定,以每min 每g 样品的反应体系对氮蓝四唑光化还原的抑制为50%时为1 个酶活单位(U),SOD 活性单位为U·g-1[23]。POD 采用愈创木酚法测定,一个POD 活性单位(U)用每min 内A470变化0.01个单位来表示,POD 活性单位为U·g-1·s-1[23]。MDA 含量的测定参考高建晓等[24]的方法。脯氨酸含量采用茚三酮比色法测定,可溶性糖含量采用蒽酮比色法测定,可溶性蛋白含量采用考马斯亮蓝比色法测定[25]。
1.4 数据处理
对实验获得的数据用Excel 2019 进行整理,采用SPSS 20.0(SPSS Inc.,Chicago,IL,美国)进行方差分析以及差异显著性检验(Duncan,P<0.05),采用Origin 2022b(Origin Lab Corp.,Wellesley Hills,美国)进行作图。为寻求最佳处理剂量,以等离子体处理电压(X1)和时间(X2)作为自变量,以SOD(Y1)和POD(Y2)活性为因变量,利用SPSS 20.0 进行二元二次回归模型分析(最小二乘法,后退线性回归模块)。通过数据分析发现信紫两种抗氧化酶活性不受电压影响,以电压和处理时间构建的二元二次回归方程拟合性较差,因此本研究只选用了赣紫的结果开展后续分析。基于SPSS 20.0 分析得到的二元二次回归方程,采用Origin 2022b 进行响应面作图,并通过响应面优化等离子最佳处理组合。
2 结果与分析
2.1 等离子体处理对紫云英种子萌发的影响
由表1 可知,等离子体处理对2 个品种紫云英发芽率和发芽势均无显著影响。但等离子体处理时间显著影响了2 个品种紫云英的发芽指数以及赣紫的活力指数,等离子体处理的时间以及电压对信紫的活力指数具有显著的交互作用。

表1 等离子体处理对不同品种紫云英种子发芽指标影响的双因素方差分析Table 1 Two-way ANOVA of the effect of plasma treatments on the germination of two cultivars of A. sinicus seeds
对于信紫,7 kV 电压下,种子的发芽指数和活力指数随处理时间的增加呈上升趋势(图2)。7 kV 电压下处理10 min,信紫的发芽指数和活力指数与对照存在显著差异,比对照提高12.5%和16.0%。在8 和9 kV 电压下,处理时间对信紫种子发芽指数和活力指数影响不显著。处理时间较长(10 min)时,信紫种子的发芽指数和活力指数随着电压的升高呈下降趋势。与信紫相比,赣紫的发芽指数对等离子体处理电压变化的响应不敏感。7 kV 电压下,赣紫种子的发芽指数与对照无显著差异,只有在较高电压下(8 和9 kV),种子的发芽指数随处理时间的增加呈先升高后下降的趋势,在8 kV 处理5 min 时达到峰值,比对照提高10.4%。等离子体处理显著提高了赣紫种子的活力指数。7 kV 电压下,除了1 min 处理外其他处理时间下种子的活力指数较对照显著提高。而在8 和9 kV 的电压下,赣紫种子的活力指数随处理时间的增加呈先升高后降低的趋势。8 kV 处理5 min 条件下赣紫种子活力指数达到最大,较对照提高22.7%。
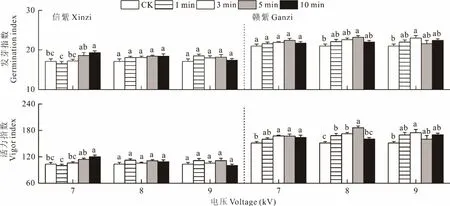
图2 等离子体处理对信紫和赣紫发芽指数和活力指数的影响Fig.2 Effect of plasma treatment on germination index and seed vigor index of Xinzi and Ganzi
2.2 等离子体处理对紫云英幼苗生长的影响
等离子体处理对信紫幼苗的胚根长、胚芽长以及根芽比无显著影响,但显著影响了信紫幼苗的鲜重(表2)。高电压下,等离子体处理时间过长(10 min)会显著抑制信紫幼苗的鲜重;8 和9 kV 电压下信紫鲜重分别比对照降低18.2%和20.5%。

表2 等离子体处理对两个紫云英品种幼苗生长的影响Table 2 Effect of plasma treatment on the growth of two cultivars of A. sinicus
与信紫不同,等离子体处理时间以及电压与时间的交互作用都对赣紫的胚芽长、根芽比以及鲜重产生了显著影响。适宜剂量的等离子体处理可以显著促进赣紫胚芽的生长,除7 和9 kV 处理5 min 外,其他处理条件下赣紫胚芽长度均较对照有了显著提高。其中8 kV 处理5 min 条件下赣紫胚芽长度较对照增加了19.9%。除此之外,等离子体处理也具有一定的提高赣紫幼苗鲜重的作用。在8 kV 电压下,赣紫幼苗鲜重随处理时间的增加呈先升后降的趋势,处理5 min 显著高于对照,比对照增加10.8%。但是在7 和9 kV 电压下,赣紫幼苗鲜重与对照相比差异不显著。等离子体处理下,赣紫幼苗的根芽比均较对照显著降低(7 kV 处理5 min 除外),这主要是由于等离子体处理促进了胚芽长度的增加以及高电压下降低了胚根长度。赣紫幼苗在7 和8 kV 电压下,幼苗胚根长随时间变化与对照差异不显著。在9 kV 电压下,处理1 和10 min 使赣紫胚根长度较对照显著降低,分别比对照降低了9.1%和8.8%。
2.3 等离子体处理对紫云英幼苗抗氧化酶活性的影响
在7 kV 电压下,随处理时间的增加,信紫幼苗SOD 和POD 活性呈上升趋势(图3)。处理10 min 时,信紫幼苗两种抗氧化酶活性最高,分别比对照提高63.3%和42.8%。在8 和9 kV 电压下,信紫幼苗SOD 和POD 活性较对照无显著差异。

图3 等离子体处理对信紫幼苗SOD 和POD 活性的影响Fig.3 Effects of plasma treatment on the activities of SOD and POD in Xinzi seedlings
等离子体处理电压和时间均会对赣紫幼苗SOD 和POD 活性产生显著影响,赣紫幼苗两种抗氧化酶活性随处理电压和时间增加呈单峰曲线变化。对赣紫幼苗SOD(Y1)和POD(Y2)活性与自变量等离子体处理电压(X1)和时间(X2)进行拟合发现,二元二次回归模型能够很好地拟合抗氧化酶活性指标与等离子体处理剂量的关系:
两个拟合模型P值均小于0.001,表明模型统计学显著,可以使用。校正系数分别为0.326 和0.231,则说明分别有32.6%和23.1%的因变量变化与电压和时间有关。影响SOD 和POD 活性的主次顺序分别为时间和电压。等离子体处理的一次项X1、X2和二次项X12、X22对赣紫SOD 和POD 活性的影响均达到显著水平(P<0.05),但互作项X1X2对两种抗氧化酶活性影响不显著(P>0.05)。通过响应面图可以发现(图4),当电压不变时,SOD 和POD 活性随时间的增加先升后降,当时间不变时,SOD 和POD 活性随电压的增加先升后降,电压和时间之间不存在显著的交互作用。由响应面优化的等离子体最佳处理剂量,SOD 和POD 活性分别为7.8 kV 处理3.9 min 和7.9 kV 处理4.4 min。
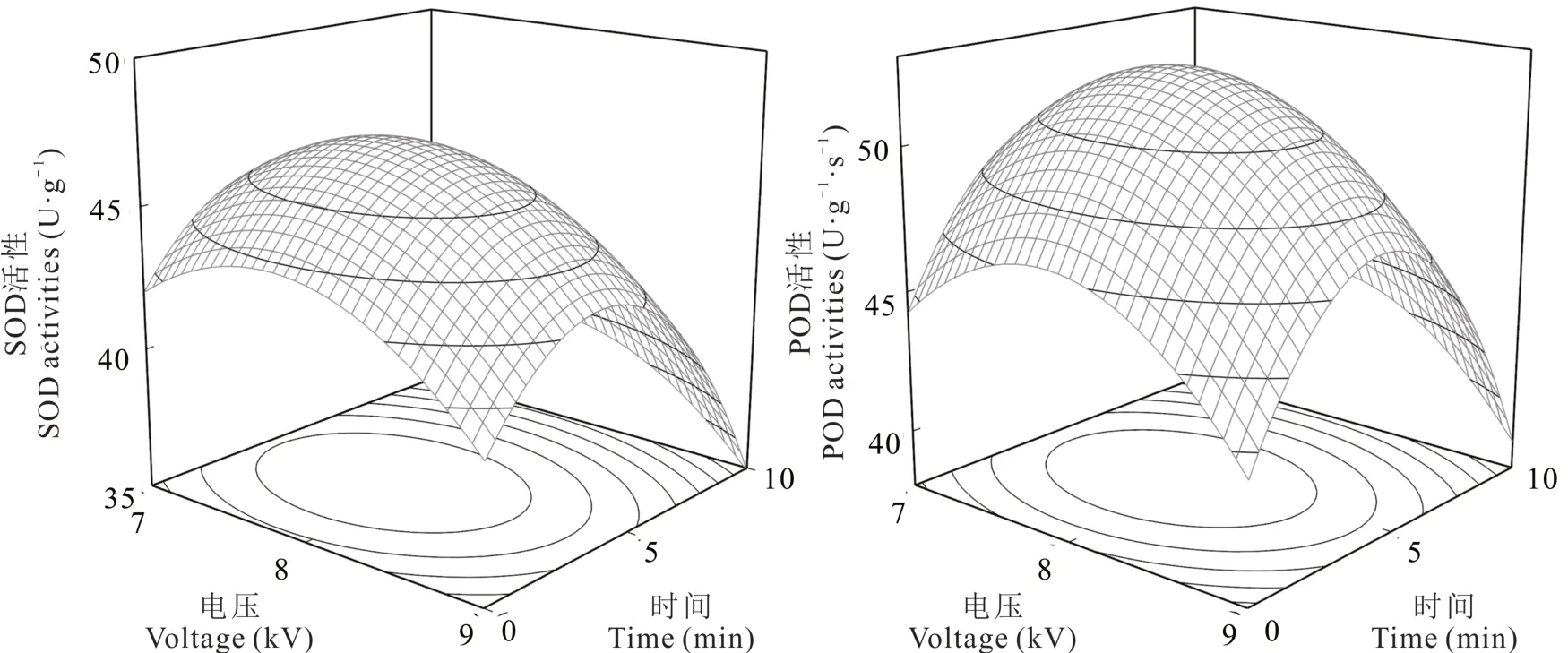
图4 等离子体处理对赣紫幼苗SOD 和POD 活性的影响Fig.4 Effects of plasma treatment on the activities of SOD and POD in Ganzi seedlings
2.4 等离子体处理对紫云英幼苗MDA 含量的影响
如图5 所示,对于信紫,在7 kV 电压下,随处理时间的增加,幼苗MDA 含量呈下降趋势,7 kV 处理10 min 时MDA 含量最低,比对照降低27.2%。在8 kV 电压下,处理1 min 幼苗MDA 含量较对照显著降低19.5%。当处理时间分别为3、5 和10 min 时,随着电压的升高,幼苗MDA 含量呈先降低后升高的趋势。处理时间为10 min,电压为9 kV 时信紫幼苗MDA 含量高于对照,较对照提高20.8%。对于赣紫,在7 kV 电压下,处理组与对照相比差异不显著;在8 kV 电压下,幼苗MDA 含量随处理时间的增加呈先降低后升高的趋势,5 min 时显著低于对照19.7%;高电压下(9 kV),长时间等离子体处理(10 min)显著提高幼苗MDA 含量,较对照增加17.0%。

图5 等离子体处理对信紫和赣紫幼苗MDA 含量的影响Fig.5 Effect of plasma treatment on the MDA contents of Xinzi and Ganzi seedlings
2.5 等离子体处理对紫云英幼苗渗透调节产物的影响
如图6 所示,对于信紫,等离子体处理对幼苗脯氨酸含量有不同程度的降低,但没有观察到明确的变化规律。等离子体处理对幼苗可溶性糖和可溶性蛋白含量的影响有相同的变化趋势,在7 kV 电压下,可溶性糖和可溶性蛋白含量随处理时间的增加呈上升趋势,处理10 min 时显著高于对照,分别比对照增加85.1%和62.6%。在8和9 kV 的电压下,随处理时间的变化,幼苗可溶性糖和可溶性蛋白含量较对照无显著差异。处理时间较长(10 min)时,幼苗可溶性糖和可溶性蛋白含量随电压的升高呈下降趋势,8 和9 kV 处理10 min 时,幼苗可溶性糖和可溶性蛋白含量明显低于7 kV 处理10 min。

图6 等离子体处理对信紫和赣紫脯氨酸、可溶性糖和可溶性蛋白含量的影响Fig.6 Effect of plasma treatment on the content of proline,soluble sugar and soluble protein in Xinzi and Ganzi seedlings
对于赣紫,等离子体处理对幼苗脯氨酸、可溶性糖和可溶性蛋白含量的影响有相同的变化趋势,在7 和9 kV电压下,随处理时间的变化,幼苗脯氨酸、可溶性糖和可溶性蛋白含量与对照相比差异不显著。在8 kV 电压下,随处理时间的增加,幼苗脯氨酸、可溶性糖和可溶性蛋白含量呈先升高后下降的趋势,5 min 时显著高于对照,分别比对照增加84.9%,66.1%和44.3%。
3 讨论
等离子体中含有大量激发态的分子、原子、自由基电子、离子及紫外光等活性粒子,与种子表面互作时可能会改变种子内部的物理形态以及生理生化特征[26]。近年的研究表明,适宜剂量的等离子体处理有助于提高种子活力和建苗能力[27-29]。本研究结果表明,等离子体处理对供试的2 个品种紫云英种子的发芽率和发芽势均无显著影响(表1)。这可能是因为本实验所选紫云英种子在室内培养条件下本身发芽率就很高(>80%),同时验证了种子处理技术效果受物种、品种和种子最初质量影响的观点[30]。但等离子体处理的2 个紫云英品种种子的发芽指数和活力指数较对照提升显著(图2)。适宜剂量的等离子体处理条件下,信紫种子的发芽指数和活力指数分别比对照提高13%和16%,赣紫的发芽指数和活力指数分别比对照提高10%和23%。2 个品种的最佳处理不同,供试的处理中,信紫的最佳处理为7 kV 处理10 min,赣紫的最佳处理为8 kV 处理5 min。说明不同品种紫云英对等离子体处理响应的敏感程度不同。不同品种种子表面化学结构不同,与等离子体产生的活性粒子反应也不同,这可能是不同品种紫云英对等离子体处理响应不同的原因之一[31]。
等离子体处理对2 个品种紫云英幼苗生长的影响也不一样,等离子体处理对信紫幼苗胚根长、胚芽长以及根芽比影响不显著。然而等离子体处理显著增加了赣紫的胚芽长度,降低了其根芽比(表2)。说明适宜剂量的等离子体处理可以显著促进赣紫幼苗的生长。Rasooli 等[32]用等离子体处理孜然(Cuminum cyminum)种子,结果表明5 min 等离子体处理后,幼苗的苗高和根长分别比对照提高27%和37%。除此之外,适宜剂量的等离子体处理(8 kV,5 min)显著增加了赣紫幼苗的鲜重,较对照提升了10.8%。但在较高的处理电压下,长时间的等离子体处理反而抑制了2 种紫云英幼苗的鲜重。Cui 等[33]的研究也呈现了类似的结果,即等离子体处理对作物幼苗生长具有“低促高抑”的现象。短时间等离子体处理可以促进种子萌发和幼苗生长,但长时间等离子体处理则表现出抑制作用。
等离子体作为气体在高电压作用下高度电离的混合物,其中多种活性集团和离子能够与生物体发生反应,其中产生的大量活性氧和活性氮会诱发细胞膜脂质过氧化作用的发生[34]。SOD 和POD 是植物体内两种重要的保护酶,可以防御活性氧或其他过氧化物自由基对细胞膜系统的伤害,保护植株正常生长[35]。本研究结果表明,适宜剂量的等离子体处理可显著提高2 个品种紫云英幼苗SOD 和POD 活性(图3 和图4),信紫在7 kV 处理10 min条件下,SOD 和POD 活性较对照分别提高63.3%和42.8%,赣紫在8 kV 处理5 min 条件下,SOD 和POD 活性较对照分别提高17.6%和27.5%。MDA 是脂质过氧化的最终产物,一般作为膜脂过氧化和膜损伤的指标[36]。在7 kV 电压下,等离子体处理10 min 信紫幼苗MDA 含量较对照降低了27.2%,赣紫中也有类似的结果。这些结果说明适当时间的介质阻挡放电等离子体处理降低了紫云英种子中膜脂的过氧化损伤。Li 等[37]的研究也发现了类似的结果,适宜剂量的等离子体处理可以显著提高小麦幼苗SOD 和POD 活性,降低MDA 含量。种子生物膜的损伤能引起种子内代谢异常,加速其生活力的丧失[38]。Yin 等[39]研究认为西红柿(Solanum lycopersicum)种子受到等离子体刺激后大量产生的保护酶提高了幼苗自由基清除活性,从而显著提高了盆栽实验下发芽率以及西红柿产量。不同品种紫云英对等离子体处理的响应不同,对信紫而言,在较高的处理电压下(8,9 kV),SOD 和POD 活性较对照无显著性差异,说明高电压处理可能超过了信紫的耐受限度;在低电压下(7 kV),幼苗SOD 和POD 活性随处理时间的增加呈上升趋势,继续延长处理时间是否可以进一步提高其SOD 和POD 活性,还需要更加深入的研究。对于赣紫,长时间等离子体处理(10 min)会降低其SOD 和POD 活性,说明赣紫并不能承受长时间等离子体处理。Staric 等[31]的研究也表明,不同小麦品种对等离子体处理的反应机制和耐受性不同。一个植物物种在不同品种之间可能具有较大的遗传变异[40]。本研究选择的2 个紫云英品种对等离子体处理敏感性不同,抗氧化酶活性有显著差异,这可能会影响等离子体处理后紫云英幼苗的抗逆性。在实际生产应用时,应根据不同品种选择合适的处理剂量。
在种子萌发过程中,种子内的大分子贮藏物质不断降解,转化为可供胚代谢和生长发育所能利用的可溶性物质,为种子萌发提供物质和能量。可溶性糖和可溶性蛋白是种子能顺利萌发和生长的重要生理指标[41-43]。本研究结果表明,7 kV 处理10 min 对信紫幼苗脯氨酸含量影响不显著,但幼苗可溶性糖和可溶性蛋白的含量较对照显著提高,同时可以观察到在此条件下,种子的发芽指数和活力指数显著高于对照。在8 kV 处理5 min 条件下,赣紫幼苗可溶性糖和可溶性蛋白含量较对照显著提高,这可能是赣紫种子活力和幼苗生长状况显著高于对照的原因。脯氨酸能够维持植物细胞和组织的持水能力,对种子萌发和幼苗生长有积极影响,能够提高种子发芽率和幼苗芽长[44]。等离子体处理显著降低了信紫幼苗脯氨酸含量,但没有观察到明显的规律。在8 kV 的处理电压下,随处理时间的增加赣紫幼苗脯氨酸含量呈单峰曲线变化。等离子体处理可通过 H2O2-ABA 信号通路增加低温下番茄幼苗可溶性糖以及脯氨酸含量,从而提高番茄植株的抗寒性[45]。适宜剂量的等离子体可以显著提高紫云英幼苗的脯氨酸、可溶性糖和可溶性蛋白含量,这可能有助于提高种子活力,增强紫云英在胁迫条件下的适应能力。
4 结论
等离子体处理对供试紫云英萌发无显著影响。但适宜剂量的等离子体处理可以显著提高种子的发芽指数和活力指数,增加幼苗SOD 和POD 的活性,降低MDA 含量,提高幼苗脯氨酸、可溶性糖和可溶性蛋白含量,这可能有利于紫云英种子建苗以及提高幼苗环境适应能力。不同品种紫云英种子对等离子体的响应不同,最佳处理组合存在区别。等离子体处理具有提高紫云英种子活力的作用,本研究结果可为等离子种子处理技术在紫云英育苗中的应用提供一定的理论基础。

