131I-MIBG SPECT/CT不同时间及本底在嗜铬细胞瘤中的诊断价值比较
左睿, 刘双, 庞华, 许璐, 田方芳
嗜铬细胞瘤(pheochromocytoma,PCC)是来源于肾上腺髓质的产生儿茶酚胺的罕见神经内分泌肿瘤(80%~85%),来自肾上腺外交感神经细胞(15%~20%)则称为副神经节瘤(paraganglioma,PGL)[1,2]。PCC诊断中最需要鉴别的疾病是皮质腺瘤(cortical adenoma,CA)。CA是肾上腺最常见的病变之一,虽高血压、头痛、心悸是PCC常见的临床症状,但以上症状也可出现在CA患者中[3,4],这导致CA和PCC的鉴别诊断难度加大。另一方面,肾上腺结节较小时在CT或MRI上表现并不特异[3,5]。因此,如何尽早将PCC与CA鉴别开来是临床诊疗关键一步[6]。
肾上腺外嗜铬细胞瘤即PGL的诊断中,情况更为复杂,加之其转移的可能性更大,早期诊断有助改善预后[7]。然而,形态学检查基本上不太可能提供准确诊断[8]。患者发现全身其余部位的肿块或结节,且患者有典型的临床症状或儿茶酚胺异常升高时均需要考虑PGL可能,PGL发生远处转移与编码琥珀酸脱氢酶B亚单位(succinate dehydrogenase gene subunit B,SDHB)基因突变有关[1],但其表现是否与PCC相似,是否与儿茶酚胺活性相关,目前尚不明确。
间碘苄胍(metaiodobenzylguanidine,MIBG)是一种结构类似去甲肾上腺素的胍乙啶类似物,可特异性积聚在肾上腺髓质中。131I-MIBG SPECT显像是一种功能显像,可特异性显示分泌儿茶酚胺功能增强的病变(如嗜铬细胞瘤),有助于明确肾上腺结节诊断,比解剖成像更敏感[9]。除了常规的平面成像,MIBG显像还可以进行图像融合,对嗜铬细胞瘤显示出较高的诊断效能[5]。Yoshiyuki等[10]认为半定量分析较定性评估更能有效区分PCC和CA,然而半定量分析受多种因素影响,比如图像采集时间点以及本底的选择,故本研究拟比较在不同时间及不同本底选择下肿瘤MIBG半定量值的诊断效能差异。此外正常肾上腺组织也可摄取MIBG,故本研究比较了所有肾上腺病灶与正常对照的MIBG摄取差异。最后,由于PGL发生远处转移的可能较PCC更大,为探究MIBG是否是重要的影响因素,我们比较了PGL和PCC的MIBG摄取差异。
材料与方法
1.患者特征
本研究回顾性搜集219例患者于2014年3月-2021年11月在本院核医学科行131I-MIBG SPECT/CT显像的相关资料,纳入标准:①患者行131I-MIBG SPECT/CT时未行肾上腺手术治疗;②患者在131I-MIBG SPECT/CT结束后2~5月内行手术治疗;③所有病灶均取得组织病理学结果。分别搜集3组患者的年龄、性别、病程、儿茶酚胺水平、临床症状等基本情况。本研究将儿茶酚胺水平与正常范围的比较进行二值化为阳性和阴性。临床症状包括头痛、大汗、心悸,满足一项即认为患者存在相关临床症状。本研究已获本院伦理委员会批准(2022-K166),并免除知情同意。
2.131I-MIBG SPECT/CT图像采集
所有患者注射131I-MIBG后均采集了全身平面图像和局部(中上腹部或涵括副神经节瘤病灶的相应部位)SPECT/CT融合图像。患者在检查前3 d即停用酚苄明、利血平等干扰肾上腺摄取131I-MIBG的药物(所有患者均经医生评估可短暂停药),并用饱和碘化钾溶液阻断甲状腺(100 mg/d,从注射示踪剂前1 d开始,持续2 d)。检查当天静脉注射131I-MIBG(原子高科股份有限公司提供,放射性化学纯度>95%)74~185 MBq(2~5 mCi)后,采用SPECT/CT(GE Discovery NM/CT 670型或SIEMENS Symbia T2型)设备,用高能高分辨率准直器(矩阵1024×256,能峰364 keV,窗宽20%),以10~15 cm/min的运行速度扫描全身。获得全身平面图像后立即行SPECT/CT显像。SPECT采集参数:矩阵128×128,探头旋转360°,以60秒/帧的速度进行采集。最后在SPECT同一区域内以管电压120 keV,电流30 mA,矩阵512×512,层厚5 mm的采集参数获得低剂量CT图像。经过衰减校正等后期处理获得SPECT/CT融合图像。
3.图像分析
所有图像由两位经验丰富的核医学科医师评估,他们分别对所有平面图像进行视觉定性评估,以肝脏放射性浓度作为参考标准,病灶131I-MIBG摄取高于肝脏为阳性,低于肝脏为阴性[11]。两位医师最终对所有结果达成共识。
由于肝脏放射性分布不均,我们拟采取肝右后叶上段和右后叶下段两个局限区域作为本底;另外,纵隔血池由于放射性分布均匀的特点,也被纳入作为本底之一。采用肿瘤/纵隔血池放射性计数比(tumor/mediastinum,T/M)、肿瘤/肝右后叶上段放射性计数比(tumor/upper segment of right posterior lobe of liver,T/Lu)和肿瘤/肝右后叶下段放射性计数比(tumor/ lower segment of right posterior lobe of liver,T/Ll)对所有SPECT图像(24 h、48 h)进行半定量评价,CT辅助定位。具体方法:①在病灶放射性摄取最明显的区域,以涵括整个病灶的最小圆形区域获得感兴趣区(reign of interest,ROI)的放射性计数值。②再以同一圆形区域分别放置在纵隔血池、肝右后叶上段及肝右后叶下段,获得本底的放射性计数值。③当病灶过大致ROI超过本底最大径线范围时,则以涵括纵隔血池的最小圆形为ROI,获得病灶及本底的放射性计数值。④ROI的选取由两位经验丰富的核医学科医师共同完成,病灶和本底的放射性计数通过两次ROI计数的平均值获得,并计算T/M、T/Lu和T/Ll。⑤同理勾画出正常左侧肾上腺的ROI并获得计数值及半定量指标。右侧正常肾上腺因易受肝脏的生理性摄取干扰而未被选择。
勾画SPECT图像后,由以上两名医师分析所有患者的CT图像,测量每个病灶的最大径、平均密度、最小密度及最大密度值,两次测量取平均值为最终结果。
4.统计学分析
采用SPSS 26.0和MedCalc18.2.1软件进行统计分析。连续性变量以mean±SD表示,两组比较采用独立样本t检验,三组比较采用ANOVA,事后分析采用Dunnet’t检验;分类变量比较采用χ2检验。各数据间的相关性采用Spearman相关性分析。通过受试者工作特征(receiver operating characteristic,ROC)曲线分析,确定摄取131I-MIBG的临界值,计算曲线下面积(95%可信区间),并计算敏感性、特异性、准确性、阳性预测值和阴性预测值等诊断效能。联合诊断通过logistic回归构建多因素分析指标,再绘制多因素ROC曲线。采用Delong检验对不同ROC曲线进行比较,P<0.05为差异有统计学意义。
结 果
219例患者中166例由于不满足纳入标准被排除,本研究共纳入53例被试(男25例,女28例;平均年龄46.85岁,年龄15~78岁),包括36例PPGL(24例PCC,12例PGL),17例CA。患者的性别在PPGL和CA组间存在统计学差异,提示CA在男性患者多见,PPGL则女性患者多见。CA患者的年龄明显小于PCC患者(P<0.01),PCC患者较CA患者有较高的儿茶酚胺水平(P<0.05)。CT及131I-MIBG SPECT相关参数在PPGL与CA间均存在统计学差异(P<0.05,图1,表1)。

表1 患者的临床资料和影像特征(n=53)

图1 患者纳入流程图
PPGL为嗜铬细胞瘤与副神经节瘤,PCC嗜铬细胞瘤,PGL副神经节瘤,CA皮质腺瘤,CT值mean为病灶的平均CT值,CT值min为病灶的最小CT值,CT值max为病灶的最大CT值,T/M为肿瘤与纵隔血池放射性计数之比,T/Lu为肿瘤与肝右后叶上段放射性计数之比,T/Ll为肿瘤与肝右后叶下段放射性计数之比。
1.不同时间(24 h、48 h)131I-MIBG SPECT/CT的比较
本研究共31名(16名PCC,7名PGL,8名CA)先后行24 h和48 h131I-MIBG SPECT/CT(包括22个正常肾上腺);PCC在不同时间(24 h、48 h)的不同参考背景中的半定量值均显著高于CA,而PCC与PGL间的摄取差别不大(图2)。对正常肾上腺(22个)及肾上腺病灶(24个)联合诊断分析(T/M、T/Lu及T/Tl)后发现24 h诊断效能最高,敏感度、特异度及准确度分别为0.84、0.96和0.89,AUC为0.90(P<0.001)。

图2 PCC、PGL、CA在不同时间131I-MIBG SPECT/CT的差异箱式图。a) PCC、PGL、CA在24h 131I-MIBG SPECT/CT的半定量参数差异; b) PCC、PGL 、CA在48h 131I-MIBG SPECT/CT的半定量参数差异。 图3 131I-MIBG SPECT/CT的ROC曲线分析。a) T/M、T/Lu及T/Tl区别病灶(n=41)与正常肾上腺(n=34)的ROC曲线;b) CT值mean、T/Lu及联合指标鉴别嗜铬细胞瘤(n=24)及皮质腺瘤(n=17)的ROC曲线。
我们比较了24名接受24 h和48 h131I-MIBG SPECT/CT的肾上腺肿瘤患者的病灶摄取差异并行联合诊断ROC曲线分析,发现24 h的鉴别诊断价值较高,敏感度、特异度及准确度均分别为0.88、1.00和0.92,AUC为0.90(P<0.001)。
2.肾上腺病灶与正常肾上腺对131I-MIBG的摄取比较
131I-MIBG SPECT/CT的24 h半定量参数值显示相对较高的诊断效能,故在此基础上比较本底选择所致的放射性摄取差异。肾上腺病灶(n=41)与纵隔血池、肝右后叶上段及肝右后叶下段的放射性计数比值均显著高于正常肾上腺(n=34,P<0.001)。分别以2.26、1.15和1.16为临界值,T/M、T/Lu及T/Tl区别病灶与正常肾上腺的ROC曲线及诊断性能如图3a及表2,其中,以纵隔血池为本底的AUC及准确度更高。
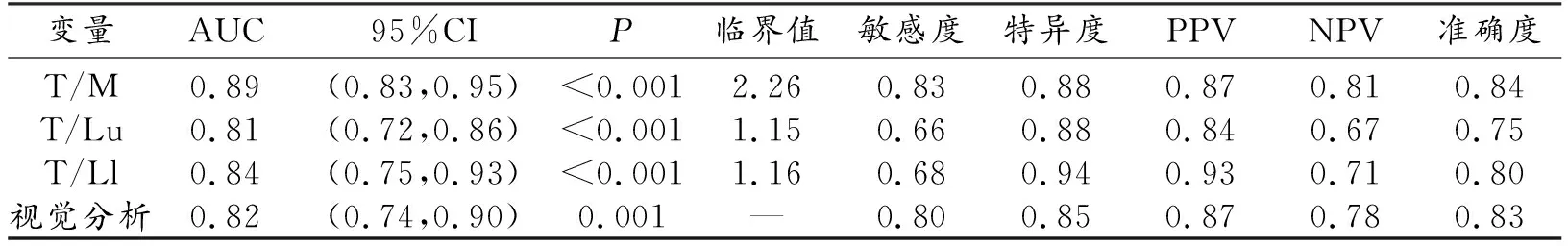
表2 131I-MIBG SPECT/CT (24h)对41例肾上腺病灶的诊断效能
3.疾病组间131I-MIBG摄取半定量指标和其他特征的ROC分析
T/Lu(临界值=1.4)鉴别PCC和CA的效能最高,敏感度、特异度及准确度分别为0.71、0.94和0.80,AUC为0.86;CT参数中以CT值mean的鉴别效能最佳,敏感度、特异度及准确度分别为0.92、0.71和0.83,AUC为0.78(图3b、表3),联合分析发现T/Lu及CT值mean同时运用时的鉴别诊断效能最佳, AUC为0.89。PCC及CA患者的131I-MIBG SPECT/CT如图4。

表3 131I-MIBG SPECT/CT 对PCC(n=24)vs. CA(n=17)的鉴别效能

图4 嗜铬细胞瘤及皮质腺瘤的131I-MIBG SPECT/CT影像表现。a~e)嗜铬细胞瘤患者。a~c) 24h、48h及72h的131I-MIBG平面显像(箭); d) CT平扫示右侧肾上腺占位; e) 131I-MIBG SPECT/CT示病灶放射性浓聚影(箭); f~j) 皮质腺瘤患者; f~h) 24h、48h及72h的131I-MIBG平面显像均未见确切异常放射性摄取灶; i) CT平扫示左侧肾上腺结节; j) 131I-MIBG SPECT/CT示病灶放射性摄取与肝脏相近(箭)。
PCC与PGL间仅T/M的差异有统计学意义,以2.7为临界值时,敏感度、特异度和准确度分别为0.71、0.75和0.72,AUC为0.74。
4.131I-MIBG SPECT指标和形态学及临床特征的相关性分析
131I-MIBG SPECT放射性计数值与病灶最大径显著正相关(r=0.509,P<0.01),与其他影像及临床特征未见明显相关性。
讨 论
不同的肾上腺肿瘤在术前的医疗管理手段不一,早期的诊断十分重要[12]。肾上腺肿瘤一般较小,仅依靠解剖学影像检查特异性低,功能成像已被证明可相对特异地被嗜铬细胞瘤摄取,鉴别效能较高[13]。本研究比较了PCC及CA间的131I-MIBG摄取差异后发现(1)早期显像(24 h)鉴别效能较好,延迟显像(48 h)虽未能显示更佳的诊断能力,但仍能提供部分有效信息;(2)以纵隔血池作为本底时诊断肾上腺病灶的能力更佳,鉴别PCC及CA则选用肝右后段上叶作为本底时的区分度更好;(3)131I-MIBG SPECT/CT的半定量分析较视觉评价诊断及鉴别效能更高,联合SPECT及CT分析时的鉴别效能最佳。
国外一般以123I标记MIBG,123I半衰期仅有13.2 h,不适合延迟采集,故一般仅采集24 h图像[9]。本研究选用更易获得的131I标记MIBG,半衰期达8.04 d,需要延迟成像才能获得最佳的靶本比。研究结果显示48 h延迟显像鉴别PCC及CA的效能较24 h早期显像未见明显差异,区别正常肾上腺和病灶及鉴别PCC和CA以24 h的诊断效能最高,由于72 h的病例数不足,是否能在72 h显像中得到类似结论还需扩大样本量,行进一步研究。
延迟显像并未显示出我们所期待的更高的准确度,这可能与131I-MIBG本身性质有关,其在同时间内能采集的计数值不到123I-MIBG的1/20,低分辨率的图像诊断准确度相对较低[14,15]。但比较123I-MIBG显像不同采集时间的诊断效能的既往研究[16]发现6 h和24 h定量分析的诊断效能未见明显不同,这和我们得出的结论类似,不同扫描时间并未减少假阴性或假阳性的发生。延迟采集虽然未能提高诊断效能,但它可选择性的应用在一些体积较小、实性成分少、出现坏死和出血及某些低分化的肿瘤病灶中,MIBG显像在这些病灶中可能出现假阴性[17]。采集时间延长病灶对MIBG持续累积,而其余组织对MIBG的清除加快,那么延迟显像中病灶和背景可产生更明显的对比,可减少假阴性的发生。本研究中假阳性大部分来源于肝癌等血供丰富的恶性肿瘤,Serena等[17]认为假阳性在具有潜在神经内分泌来源的病灶中也可发现,虽然MIBG的摄取被认为具有较高特异度,但最终的诊断还需在结合临床的基础下判定。
本研究侧重分析的另一问题是本底的选择是否会影响半定量分析。临床工作中一般以肝脏作为参考,视觉评价病灶的性质,当PCC较小且摄取能力较低时,视觉分析很难将其与CA区分开来,故需通过计算靶本比提高鉴别的特异度。Yoshiyuki等[10]选取肌肉和肝右叶作为本底进行研究,发现两者在鉴别PCC和CA的诊断效能无显著差异,这和我们研究的结果略有不同,我们选取纵隔血池和肝右后叶上段或下段作为本底,无论在各时间的各本底选择中,正常肾上腺与病灶间及PCC和CA间的ROC曲线并未有显著差异。但我们结果显示在区分正常肾上腺和病灶时,纵隔血池作为本底有着相对较高的准确度和AUC,纵隔血池作为本底时的计数值较肝脏血池低,可能更利于显示正常与病理性摄取的差异。与纵隔血池和肝右后段下叶相比,肝右后段上叶是鉴别PCC和CA的最优本底选择,其显示出更高的诊断效能。随后,我们结合CT指标联合鉴别诊断PCC和CA,获得更高的鉴别价值,这取决于SPECT/CT融合图像可同时显示代谢及解剖的优势,临床中充分灵活运用影像显得尤为重要。
我们还发现PGL较PCC的半定量值低,T/M有统计学差异,这可能与SDHB突变、预后不良相关[18]。131I-MIBG低摄取意味着更高的转移率,提示阴性摄取的PGL需要更密切的定期随访。但我们并没有大部分患者的基因数据,这个推测需要进一步研究。
本研究存在一些不足:首先,因血清儿茶酚胺结果来自不同实验室,没办法对其进行深入分析;其次,72 h延迟显像的纳入样本量过小,无法进行ROC分析。
131I-MIBG SPECT/CT诊断PCC时选择纵隔血池作为本底的准确度更高,与CA鉴别时则将肝血池作为本底诊断效能更佳。131I-MIBG SPECT/CT在诊断及鉴别肾上腺疾病中有着重要地位,本底及显像时间的选择尤为关键,临床工作中应灵活选用。

