基于MRI预测肿块型肝内胆管细胞癌分化程度的研究价值
陈祥, 朱静芬, 李勇刚
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是一种起源于肝内胆管上皮细胞的原发性肝脏肿瘤,约占所有原发性肝脏恶性肿瘤的10%~20%[1,2]。形态学ICC可分为3个不同的亚型即肿块形成型、导管周围浸润型和导管内生长型[3]。最常见的为肿块形成型[4,5]。完整的病灶和门静脉淋巴结切除是患者长期生存的主要方法。1年和5年总生存率分别约为30%和18%[6]。病理分化程度通常被认为是ICC的预后因素,ICC的高分化通常预示着更长的生存期[7,8]。病理分化程度的评估方法主要依靠穿刺或术后病理检测。然而,对于不适合穿刺和外科手术患者非侵入性的评估病理分化程度有助于选择适当的治疗方法,提高生存率。少有文章报道使用MRI去预测ICC病理分化程度[9]。我们假设MRI对于预测肿块型肝内胆管细胞癌( mass-forming intrahepatic cholangiocarcinoma,MICC)病理分化程度是有用的。基于这个假设,我们试图非侵入的预测MICC的病理分化程度。
材料与方法
1.一般资料
回顾性分析2016年3月-2022年3月经穿刺或手术病理证实为肿块型胆管细胞癌的81例患者。纳入标准:①患者有完整的病理记录;②术前或穿刺活检前1个月内行钆塞酸二钠增强MRI(gadolinium-ethoxybenzyl-diethylenetriamine pentaacetic acid magnetic resonance imaging,Gd-EOB-DTPA-MRI)增强检查。排除标准:有肝脏手术或介入治疗史;MRI检查图像质量差;合并有其他肝脏恶性肿瘤。
2.病理分析
组织病理学检查由两名经验丰富的病理学家进行,他们对放射学和临床结果一无所知。MICC的组织学分级采用既定标准。G1:高分化;G2:中分化;G3:低分化[10]。如果病变包含不同分化程度的区域,则根据较差的分化程度对病变进行分类。
3.检查方法
所有患者采用德国 Siemens Skyra 3.0T MR仪和体部相控阵线圈进行扫描,扫描时使用呼吸门控技术,扫描序列包括:①同/反相位T1WI,重复时间4.11 ms,回波时间1.24 ms,层厚3.6 mm,视野260 mm×320 mm;②脂肪抑制T2WI,重复时间3000 ms,回波时间82 ms,层厚6.5 mm,视野320 mm×320 mm;③T1WI脂肪抑制动态增强序列, 采用高压注射器由肘静脉团注钆塞酸二钠(拜耳医药保健有限公司),剂量为0.025 mmol/kg,注射流率1.0 mL/s,注射对比剂后20 s扫描动脉期(arterial phase,AP)图像,60 s扫描门静脉期(portal phase,PP)图像,120 s扫描过渡期(transitional phase,TP)图像,肝胆期(hepatobiliary phase,HBP)扫描时间为注射对比剂20 min后 ,扫描参数为重复时间4.15 ms,回波时间1.96 ms,层厚3.6 mm,视野260 mm×230 mm。
4.MRI定性分析
2名放射科诊断医师(9年和10年腹部诊断工作经验)独立阅片。分歧时协商达成统一结论。分析过程中对放射科诊断医师隐藏患者的临床表现、相关实验室检查以及病理信息。当肝内存在多个病灶时,则评估最大病灶。主要评估内容包括:
MRI定性特征主要包括T1加权成像(T1-weighted imaging,T1WI)、T2加权成像(T2-weighted imaging,T2WI)、弥散加权成像(diffusion-weighted imaging,DWI)、动脉期增强模式、动态增强模式、肝胆期(hepatobiliary phase,HBP)增强模式、形态学和辅助特征。T1WI和T2WI分为低信号、等信号和高信号(病变的信号强度为病灶的最大层面信号与周围正常肝实质作对比)。DWI包括①弥漫性高信号:高信号区域超过肿瘤的总面积的1/3。②部分高信号:高信号区域小于肿瘤总面积的1/3[11](图1)。动脉期增强模式包括①边缘强化:肿瘤外周高强化区域小于肿瘤总面积10%(图3b)。②部分强化:肿瘤高强化区域占肿瘤总面积的10%~70%(图2b)。③弥漫性强化:肿瘤高强化区域大于肿瘤总面积70%[12,13]。动态增强模式主要包括3种类型。渐进型:动脉期病灶外周部呈环状、花环样强化,随时间延迟逐渐向中央充填样强化;稳定型:动脉期与门脉期强化程度与范围基本保持不变;退出型:病灶整体动脉期强化明显,静脉期强化减退。HBP增强模式分为3种类型。①靶征:病灶外缘呈低信号环,中央呈弥漫性高信号(图2e)。②部分强化:病灶局部呈高信号,其余部分呈低信号(图3e)。③低强化:病灶整体呈低信号。病灶位置:分为肝左叶、肝右叶以及跨叶3种形式。形态学特征:主要为病灶的形态和边界两个方面。形态:圆形或类圆形;分叶状;不规则。边界:边界清楚;边界不清。卫星灶:最大病灶周围2 cm范围内的病灶。肝内转移灶:最大病灶周围2 cm以外与其信号类似的病灶。伴随征象有①胆管扩张:无胆管扩张;有胆管扩张。②肝包膜皱缩:肝包膜局部向内凹陷,凹陷距离在1 cm以内。③腹水:腹膜腔内液体。④晕征:动脉期病灶周围肝实质出现的环形异常高信号。⑤HBP灶周低信号:肝胆期(HBP)病灶周围肝实质出现的低信号。⑥异常灌注:肝动脉期部分肝实质一过性强化(THAE),而门静脉期恢复为等或稍高信号。

图1 DWI图。a) 弥漫性高信号,高信号区域超过肿瘤的总面积的1/3; b) 部分高信号,高信号区域小于肿瘤总面积的1/3。

图2 71岁,女,MICC患者,病理分化程度为中分化,磁共振显示为病变位于肝右叶。a) 肿瘤平扫呈均匀性低信号; b) 动脉期表现为部分强化; c) 门静脉期强化程度和范围增加; d) 过渡期强化程度和范围增加; e) 病灶外缘呈低信号环,中央呈弥漫性高信号; f) 病理表现为外周大量肿瘤细胞,而纤维间质稀少。

图3 71岁,女,MICC患者,病理分化程度为低分化,磁共振显示病变位于肝右叶。a) 肿瘤平扫呈不均匀性低信号; b) 动脉期表现为边缘性强化; c) 门脉期强化程度和范围保持不变; d) 过渡期强化程度和范围保持不变; e) 病灶表现为部分强化;f)病理表现为外周肿瘤细胞较少,而纤维间质较多。
5.MRI定量分析
两名放射科医生使用MicroDicom进行定量分析。MRI定量分析主要包括T2WI上病变的直径、ADC平均值、标准化ADC值和HBP上信号比(SIR-HBP)。每位放射科医生在T2WI轴面图像上测量病灶最大层面直径,然后取平均直径。ADC信号强度(signal intensity,SI)的测量避免最外层以排除相邻病变组织的部分体积效应。正常肝实质中的感兴趣区(region of interest,ROI)约1 cm2的大小。通过使用以下公式来计算病变的ADC平均值:ADC=ln(S2/S1)/(b1-b2),其中S1和S2分别是b值中b1 为0或50而b2为800 s/mm2处的信号强度。标准化ADC(nADC)值被定义为ADC平均值相对于肝实质ADCtumor/ADCliver的比率[14,15]。HBP轴面图像上测量病灶的最大层面以及上、下层面的感兴趣区域(ROI),然后取平均SIR-HBP。同样的方法用于测量正常肝实质信号强度。每个ROI的大小和位置一致,避免胆管、血管、出血、囊肿和坏死。将ROI放置在大小约1 cm2正常肝实质中。基于这些定量测量,HBP上病变的信号相对于肝实质的信号比(SIR-HBP)定义如下:HBP(SIR-HBP)= SIlesion/SIliver。
6.统计学方法
两名放射科医生使用组内相关系数(ICC)评估直径、ADC和肿瘤SIR-HBP的一致性。ICC>0.75表示一致性良好。连续变量采用独立t检验或Mann-WhitneyU检验,分类变量采用χ2检验或Fisher精确检验。单变量分析中的显著性变量(P<0.05)作为协变量用于多变量logistic回归分析,建立MRI模型。通过接收器受试者操作特征(the receiver operating characteristic curve,ROC)曲线分析诊断效能,计算曲线下面积、敏感度、特异度。P<0.05被认为具有统计学意义。
结 果
1.临床和病理特征
人口学和病理学特征如表1。81例MICC患者范围37~85岁(平均年龄61.51±1.20岁)包括49名男性范围39~85岁(平均年龄61.04±11.04岁)和32名女性范围37~80岁(平均年龄62.22±10.58岁)。慢性肝炎、肝硬化、Child-Pugh评分、血吸虫病史、甲胎蛋白(alpha fetoprotein,AFP )、癌胚抗原(carcinoembryonic antigen,CEA)、碳水化合物抗原19-9(CA-19-9 Antigen,CA19-9)无显著性差异(P>0.05,表1)。

表1 肿块型肝内胆管细胞癌分化程度的临床特征
2.MRI定性分析
在肿块型肝内胆管细胞癌分化程度的形态学和辅助体征分析中,肝内转移灶有统计学意义的差异(P=0.032)。MICC肝内转移灶以低分化为主(29/52)。在位置、边缘、轮廓、卫星病变、胆道扩张、包膜回缩和腹水方面没有统计学意义的差异(P>0.05,表2)。
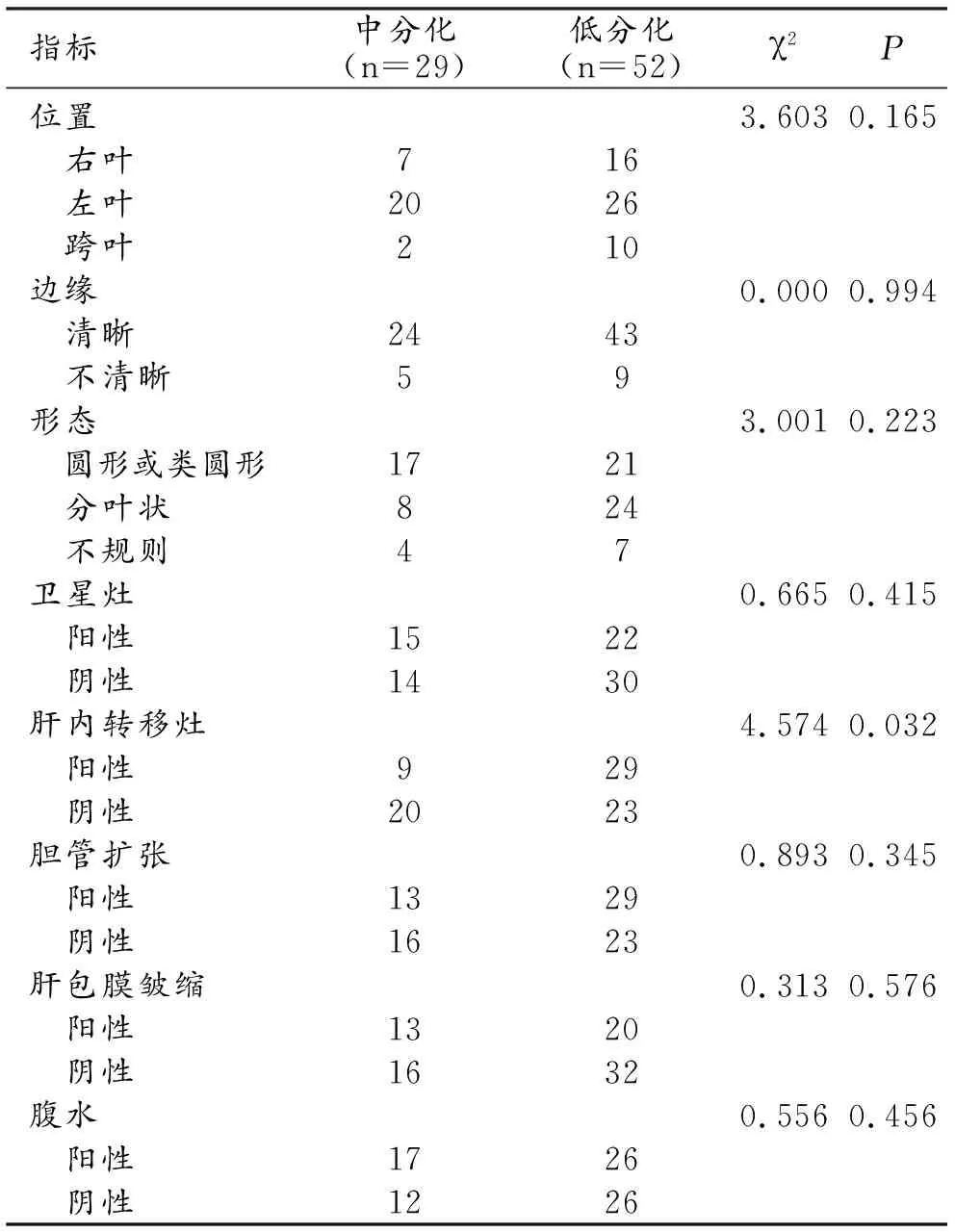
表2 肿块型肝内胆管细胞癌组织分化程度的形态学和辅助体征分析
MRI增强序列中动态增强模式、HBP增强模式对于肿块型肝内胆管细胞癌分化程度有统计学意义的差异(P<0.001,P=0.035,表3)。中分化组的动态增强模式以渐进型为主(22/29)。低分化组为稳定型(35/52)。肿块型肝内胆管细胞癌分化程度中中分化组最常见的HBP增强模式是靶征(18/29),而部分强化主要出现在低分化组(31/52)。
常规MRI序列中中分化组和低分化组的扩散加权成像(DWI)差异具有统计学意义(P=0.017)。中分化组DWI最常见表现为弥漫性高信号(18/29);低分化组为部分高信号(34/52),其他特征差异无统计学意义(P>0.05,图2、3)。
3.MRI定量分析
肿块型肝内胆管细胞癌分化程度MRI定量特征比较如表4。两个影像医师之间的直径、SIR-HBP、ADCmean和nADCmean的一致性极好(ICC>0.75)。81名患者(中位直径为5.89 cm,范围为3.38~8.13 cm);肿块型肝内胆管细胞癌的直径范围为1.54~14.40 cm,包括中分化组(中位直径为3.69 cm;范围1.54~9.83 cm)和低分化组(中位直径为6.12 cm;范围1.99~14.40 cm)。肿块型肝内胆管细胞癌分化程度中中分化组和低分化组之间的直径差异具有统计学意义(P=0.001)。中分化组和低分化组SIR-HBP、ADCmean和nADCmean的分化程度无统计学差异(P>0.05)。

表4 肿块型肝内胆管细胞癌分化程度MRI定量特征比较
4.模型的诊断效能
肿块型肝内胆管细胞癌分化程度的多变量Logistic回归结果如表5。从MRI模型的多变量Logistic回归中获得的独立预测因子是动态增强模式(OR 3.201,95%CI 1.406,7.287,P=0.006)和直径(OR 1.295,95CI 1.020,1.645,P=0.034)。用于预测肿块型肝内胆管细胞癌的MRI模型的AUC为0.806(95%CI:0.703~0.885)。当阈值为0.69时,敏感度和特异度分别为71.2%和79.3%(图4)。
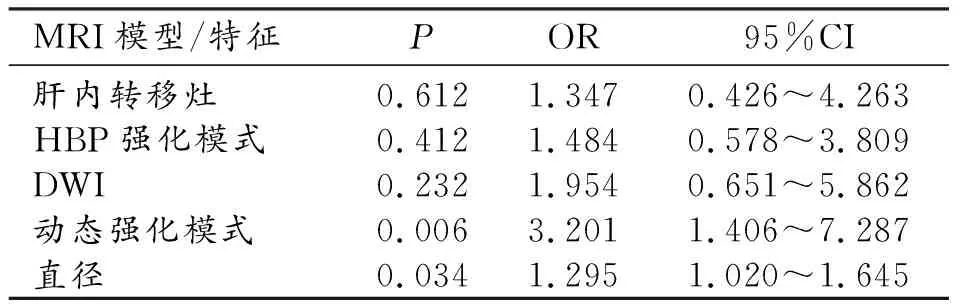
表5 肿块型肝内胆管细胞癌分化程度的多因素logistics回归结果分析

图4 Logistic分析预测MICC分化程度ROC曲线
讨 论
本研究显示MRI定性、定量参数分析可以很好的预测MICC的病理分化程度。本研究病理分化程度不同,影像征象存在明显的不同,其中动态强化模式以及病灶直径是MICC分化程度的独立预测因素。ROC曲线下面积为0.806,敏感度71.2%,特异度79.3%。
病理分化程度是MICC患者的预后重要的生物学指标。然而,MICC的病理分化程度主要通过术后病理或穿刺进行评估,其过程是侵入性的。而对于一些不适合穿刺或外科手术患者来说,如果能够治疗前非侵入性的预测患者的病理分化程度,这对于治疗方式选择和预后都会产生影响。本研究我们开发了MRI模型用于预测病理分化程度。结果表明MRI模型在预测病理分化程度方面具有良好的表现,这将有助于医生制定更合理的治疗策略。
MICC的强化模式是预后的重要影像学特征。MRI定性参数分析中动态强化方式表现出明显的不同,低分化的MICC并没有表现出通常所认为的渐进性强化方式,而是表现为门脉期与动脉期保持一致。我们考虑可能的原因是低分化的肿瘤中央部分由致密的纤维组织结构、凝固性坏死或者玻璃样变成分构成,从而导致对比剂没有向心性填充[14,16]。中分化和低分化组中HBP强化方式尽管不是鉴别的独立预测因素,但是两组之间有统计学差异。中分化组的HBP强化方式主要为靶征,而低分化组为部分强化为主。中分化组靶征的原因考虑为纤维组织间隙被造影剂填充所致[17,18]。低分化组并没有像通常所认为的,而是表现为部分强化,这同样考虑为中央未强化部分为凝固性坏死,玻璃样变或者过度致密的纤维组织所造成[14,16]。DWI是一种基于组织体素内水分子随机布朗运动的MR成像形式,反映了基于细胞密度和结构变化的肿瘤微环境[19,20]。DWI分析中中分化组的DWI主要以弥漫性高信号为主,而低分化组的DWI主要以部分高信号为主。中分化组中弥漫性的高信号考虑主要是周围细胞面积较大,而纤维组织较少导致。如Kim等[21]报告与其显示较少的中央纤维间质,较大的细胞面积,更频繁的胆管细胞成分,坏死部分较少有关。而低分化组的DWI影像表现如Asayama等[22]所报告的同MICC延迟期CT图像上呈明显强化相同,与密集纤维间质中分散的肿瘤细胞区域相关。Lee等[11]研究表明DWI扩散程度<1/3的患者无病及总生存率较扩散程度≥2/3的患者低,DWI可作为术前评估肿块形成ICC患者的预后指标,这与我们的研究结果相一致。对于MRI定量分析来说,两组的直径存在统计学差异。我们的研究表明低分化组的较中分化组的平均直径大。这与以前的研究保持一致。Spolverato等[23]的研究表明肿瘤大小增加与肿瘤分级恶化有关,低分化肿瘤的发生率随着ICC肿瘤大小的增加而增加。中分化组平均直径<5 cm,而低分化组直径>5 cm,这与最新修订的AJCC第8版以5 cm为界作为预后的指标相符[24],有机构研究表明最大肿瘤直径>5 cm是总体生存的独立预后因素[25-27]。这与病理分化程度和预后的关系相符,通常ICC的病理分化程度越低代表预后越差[28]。邓启明等[9]的研究表明ADCmean是预测MICC的独立预测因素,而我们的研究中却不存在统计学差异,我们考虑是由于样本量不同导致的。
我们的研究有3个局限性。①这是一项回顾性研究,限制了患者人群的选择,这可能导致选择的偏差性。②虽然在研究中对选定的ROI形态、大小和位置等因素给予了足够的注意,但仍难免存在操作误差。③本文中样本量偏少,因此结果可能不够稳健。但考虑到本研究选取的病例为肝内胆管细胞癌的一个亚分类且只选取钆塞酸二钠增强扫描的患者,结果具有一定可解释性,仍对其进行展示。该结果的可靠性尚需进一步研究的确证。未来的研究中多中心、更大的样本量以及放射组学方法的引入,对于提高诊断效能以及进一步细化研究可能更有帮助。
综上所述,我们的研究表明MICC的MRI定性、定量分析可以成为预测病理分化程度的一个有效方法。

