子宫内膜-肌层交界区超声多参数对子宫腺肌病的诊断价值
卢佳, 胡兵, 谢敏敏, 杨莹, 丁凌
子宫腺肌病(adenomyosis,AD)是内在性子宫内膜异位症,育龄女性常见,可导致不孕、流产及不良产科结局风险增加,因此其检出对于生育期妇女有重要意义[1]。目前,AD诊断的金标准为病理学活检,但该方法为有创检查,并非适用于育龄女性。而二维常规超声对于AD诊断的准确率较低,近年越来越多的学者运用三维超声技术关注子宫内膜-肌层交界区(endometrial-myometrial interface,EMI)结构与功能的变化特点,以提高AD的检出率[2]。研究[3]表明AD患者子宫内膜及内膜下血流减少,但却鲜少有关于EMI形态与血流的报道。本研究分析在本院超声影像科进行常规性检查的育龄妇女临床资料,通过常规超声及三维能量多普勒超声(three-dimensional power doppler ultrasound,3D-PDUS)技术评估患者EMI形态及其血流,旨在探讨EMI超声多参数诊断AD的价值,为临床提高AD检出率提供新的方法与思路。
材料与方法
1.研究对象及分组
回顾性研究2021年5月至2022年7月于本院超声影像科进行常规性检查的处于排卵前期(月经第11天~排卵,子宫内膜分型为B型)的育龄妇女,其中60例子宫腺肌病患者经临床诊断(符合经阴道超声检查、磁共振检查及临床症状3项中至少两项标准)确诊后纳入AD组,另选取同时期100例健康女性纳入对照组。通过医院电子病历搜集患者完整临床资料,包括年龄、体质指数(body mass index,BMI)、孕产史、CA125水平等。所有患者行二维灰阶超声、二维彩色多普勒超声、三维超声以及3D-PDUS检查,均由高年资超声医师完成。本研究经本院伦理委员会批准(2021YJ24),并获得受试者知情同意。
排除标准:①子宫异常,如先天性发育异常、宫腔粘连、子宫内膜息肉、子宫肌瘤等;②内分泌异常,如多囊卵巢综合征、高催乳素血症和甲状腺功能亢进症;③曾行妇科手术;④宫腔内有避孕装置;⑤影像学资料欠佳。
2.AD诊断标准
经阴道超声诊断:采用2018年国际妇产科协会授权子宫形态超声评价协作组制定的基于TVUS影像诊断子宫腺肌病的标准[4],如超声检查存在2项或2项以上下列征象,则拟诊为子宫腺肌病:①子宫肌层不对称增厚;②子宫肌层囊性灶;③岛状高回声信号;④扇形阴影;⑤子宫内膜下线状或点状回声;⑥病灶内有条状血流信号穿过;⑦结合带形态不规则;⑧结合带不连续(结合带的评价建议结合3D-TVUS检查来确认)。
盆腔MRI诊断:T2WI:子宫肌层内边界欠清的低信号病灶;子宫结合带(junction zone,JZ)呈低信号,表现为边界模糊、增粗或扭曲。当同时合并以下征象时可提高诊断的准确性:①JZ不规则性增厚(JZ局灶或弥漫增厚8~12 mm或JZ≥12 mm并外肌层受累);②JZ厚度差>4~5 mm;③浸润深度增加;④JZ最大厚度与子宫肌壁厚度之比>40%[5]。其中T1WI或T2WI可见病灶内小点状高信号为子宫腺肌病的特征性表现[6]。
临床诊断:患者的病史、临床症状、体征以及相关的辅助检查结果是诊断AD的重要依据。病史:①妊娠及分娩史,宫腔操作史,子宫手术史;②致生殖道梗阻的生殖道畸形史;③子宫腺肌病或子宫内膜异位症家族史;④其他慢性疾病或内分泌疾病史。临床表现:①进行性加重的痛经;②月经量过多和(或)月经周期延长;③妇科检查可触及子宫增大呈球形,或有局限性结节,质硬有压痛,子宫后位活动性差。实验室检查:血CA125水平升高[7]。
3.仪器与方法
首先采用彩超设备GE VOLUSON E8(含内置4D view等专业分析软件)对各组研究对象行经阴道二维灰阶及二维多普勒超声检查,探头频率为4~9 MHz,测量子宫内膜厚度、子宫动脉搏动指数(pulsation index,PI)及阻力指数(resistance index,RI)。接着在三维超声界面下使用体积对比成像(volume contrast imaging,VCI)模式,观察EMI形态。本文将EMI形态分为正常与异常两类,异常包括不规则、中断、不可见或不可评估等特征[8](图1a)。然后测量宫底部、左侧壁及右侧壁EMI厚度,获得EMI平均厚度(图1b)。最后进入3D-PDUS血管显像模式,采集容积数据并存储。应用4Dview分析软件手动勾画子宫内膜轮廓获得子宫内膜容积,并自动计算感兴趣区内的血流参数[血管化指数(vascularization index,VI)、血流指数(flow index,FI)、血管化血流指数(vascularization-flow index,VFI)],如图2a;然后手动勾画子宫内膜外EMI区域,获得EMI容积,并自动计算感兴趣区内的血流参数(EMI-VI、EMI-FI、EMI-VFI),如图2b。每组数据均由两名高年资医师分别测量3次,取平均值。

图1 三维超声VCI模式下EMI形态。a) EMI异常,边界模糊不规则,连续性中断,形如锯齿状,隐约见类似于棒棒糖憩室样通道; b) EMI厚度测量。测得子宫左侧壁、右侧壁、宫底正中部位EMI厚度分别为0.25mm、0.16mm、0.11mm。 图2 3D-PDUS模式下子宫内膜及EMI体积及血流参数的测量。a)内膜容积为6.84cm3,内膜VI为4.135,内膜FI为27.121,内膜VFI为1.138; b) EMI容积为2.13cm3,EMI-VI为6.415,EMI-FI为27.809,EMI-VFI为1.764。
4.观察指标
患者年龄、BMI、孕产史、CA125水平、子宫内膜厚度(cm)、PI、RI、EMI形态、EMI平均厚度(mm)、子宫内膜容积(cm3)、内膜VI、内膜FI、内膜VFI、EMI容积(cm3)、EMI-VI、EMI-FI、EMI-VFI。
5.统计学方法

结 果
1.一般临床资料比较(表1)
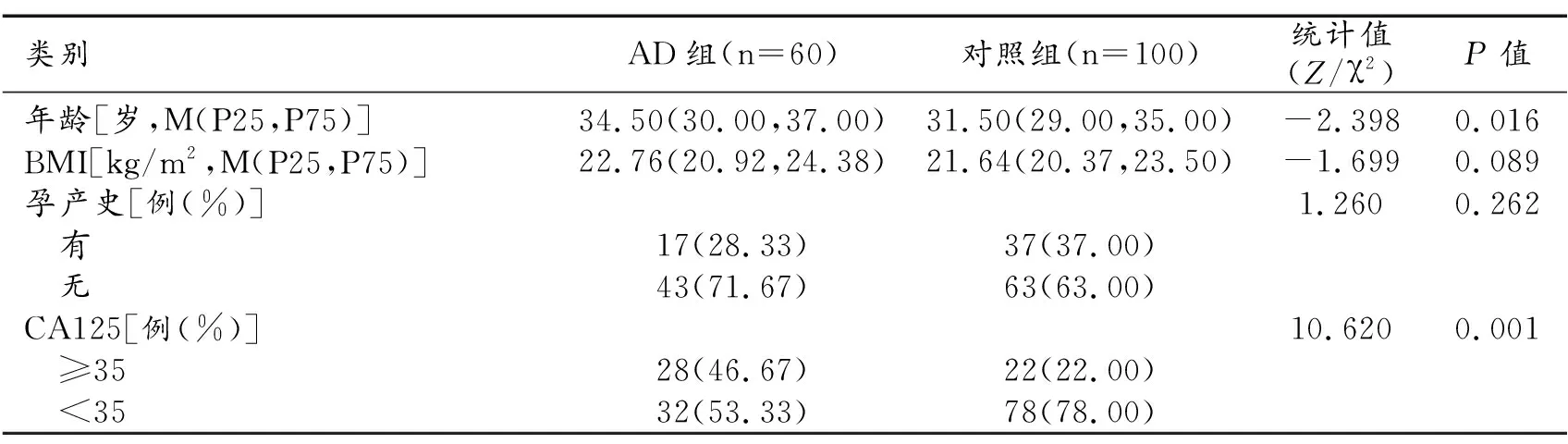
表1 两组患者一般临床资料比较
两组患者BMI、孕产史均无统计学意义(P>0.05)。两组之间年龄、CA125值差异有统计学意义(P<0.05)。
2.AD组与对照组各超声参数比较(表2)
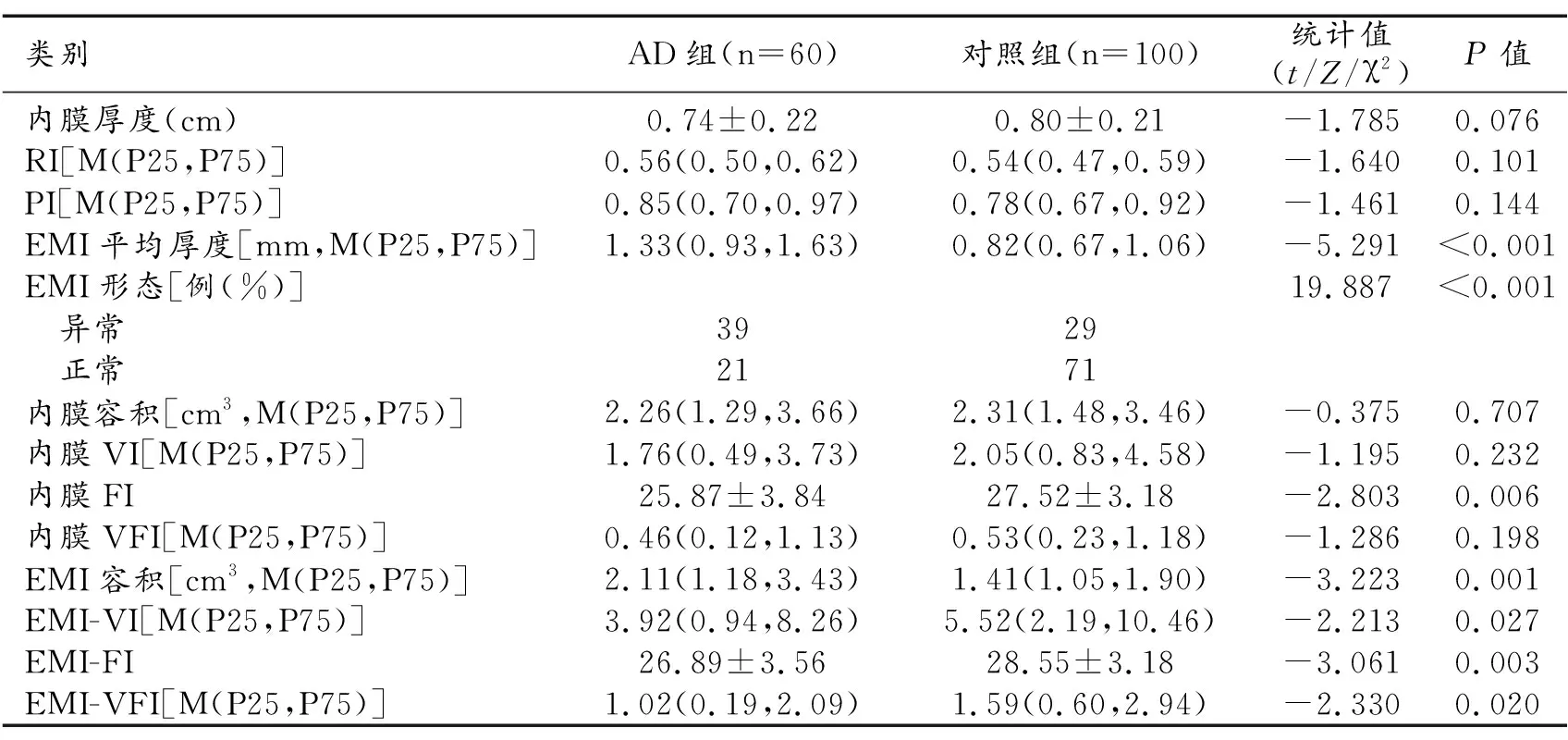
表2 两组患者各超声参数比较
AD组患者EMI平均厚度、EMI容积以及EMI形态异常比例高于对照组患者,差异具有统计学意义(P<0.05)。AD组患者内膜FI、EMI-VI、EMI-FI以及EMI-VFI低于对照组患者,差异具有统计学意义(P<0.05)。两组患者组间内膜厚度、RI、PI、内膜容积、内膜VI以及内膜VFI差异无统计学意义(P>0.05)。
3.AD与各参数的相关性(表3)
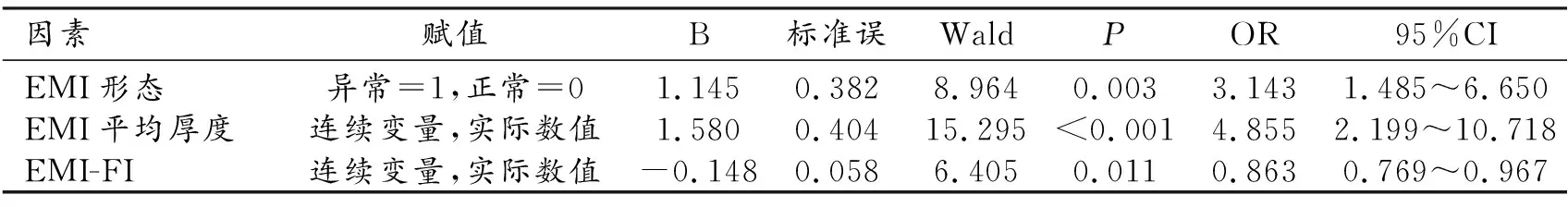
表3 AD与EMI参数的多因素Logistic回归分析
将单因素比较中有统计学意义的超声指标变量如EMI平均厚度、EMI形态、内膜FI、EMI容积、EMI-VI、EMI-FI以及EMI-VFI作为自变量,以分组为因变量(AD组=1、对照组=0)进行多因素Logistic回归分析,最终获得3个有效参数指标,EMI形态异常(OR=3.143,95%CI:1.485~6.650)、EMI平均厚度(OR=4.855,95%CI:2.199~10.718)、EMI-FI(OR=0.863,95%CI:0.769~0.967)均与AD独立相关(P<0.05)。
4.EMI超声参数指标诊断AD的ROC分析
据多因素Logistic回归分析获得的3个超声参数绘制ROC曲线(表4)。将EMI形态异常、EMI平均厚度两个指标联合评估,其敏感度、特异度、约登指数及AUC分别为0.65、0.84、0.49、0.796[95%CI(0.723,0.868)],诊断效能显著提升。

表4 EMI各参数诊断AD的ROC曲线统计值
5.三维超声检查与二维常规超声检查诊断效能对比(表5)

表5 三维超声检查与二维常规超声检查诊断效能比较
与临床确诊相比,三维超声检查中EMI形态联合EMI平均厚度诊断AD例数46例,误诊7例,漏诊14例,准确度86.88%(139/160)、灵敏度76.67%(46/60)、特异度93.00%(93/100)、阳性预测值86.79%(46/53)、阴性预测值86.92%(93/107),采用Kappa检验一致性,Kappa值=0.713,P<0.001,两种检查方法有统计学意义且一致性较高,表明3D-PDUS检查具有良好的诊断效能。不仅如此,三维超声比二维超声检查的诊断效能更高,其中两者准确性之间的差异具有统计学意义(P<0.05)。
讨 论
EMI是子宫内膜下独立的子宫肌层功能单元,在激素调控下发生周期性规律收缩,对胚胎种植和成功妊娠发挥着重要作用[9]。研究[10]表明AD是导致EMI增厚、结构受损最常见的病变,它所致的EMI病理改变有3种表现:肌层内病变、线形交界区和锯齿状交界区,其中锯齿状交界区是AD的前兆(图1a),AD患者EMI边界模糊不规则,连续性中断,形如锯齿状,隐约可见类似于棒棒糖憩室样通道,且本研究发现AD组与对照组EMI形态之间的差异具有显著性(P<0.001),且EMI形态异常与AD独立相关,这表明EMI形态异常在AD患者与正常妇女中差别较大,可作为诊断AD的重要参考依据。
三维超声EMI表现为子宫内膜周围低回声光晕,对于其三维冠状面的测量,我们没有进行一致性研究,因为既往研究已经证实这种方法具有良好的一致性[11]且在本重复性试验中所能测量的EMI最大厚度仅为3 mm,AD组患者在排卵前期EMI平均厚度中位值为1.33 mm。朱博雅[12]试验中AD患者无论是否妊娠其月经期EMI厚度平均值仅为1.40 mm左右,这与本试验结论相似。不仅如此,本研究中AD组EMI平均厚度大于对照组,差异具有显著性(P<0.001),且EMI平均厚度与AD独立相关,这表明EMI平均厚度可作为诊断AD的重要参考依据,与EMI形态异常联合诊断AD具有良好的效能。本研究发现利用三维超声获得的EMI参数指标诊断AD的效能高于二维超声的诊断效能,且两者诊断准确性的差异具有统计学意义(P<0.05)。但EMI容积因测量时受到的影响因素太多,并不能直接反映AD患者与正常妇女的差别。
AD不仅会导致EMI影像结构层面的改变,还会引起动脉血流阻力增加,子宫血流灌注减少,增加分泌期子宫内膜间质血管化[13]。3D-PDUS可以评估子宫内膜及EMI血流参数,其对低速血流较二维能量多普勒更为敏感,能改善微小血管的可视化[14]。迄今为止,对于EMI区域血流并没有明确报道,仅有少数学者将内膜外5 mm作为感兴趣区进行子宫内膜下区血流的探究。但这些研究均采用同一个固定范围对子宫内膜下进行勾画,其中包含了较多子宫肌层结构,并非EMI区域。本研究则是在三维超声图像上量取每个患者的EMI厚度,以此勾画EMI的感兴趣区,这样可以缩小个体差异造成的误差,使获得的数据更加准确。结果显示AD患者EMI的VI、FI、VFI均小于正常妇女,其中EMI-FI为AD的独立相关因素,但EMI-FI诊断AD的效能太低,在ROC曲线中AUC<0.5,可作为AD的排除指标。
本研究通过比较排卵前期女性AD组和对照组子宫内膜及EMI各超声参数差异,选取AD独立相关因素联合诊断,提高临床对AD的检出率,具有一定的临床价值与临床意义。但本试验尚存在一定的局限性,如该研究属于回顾性研究,且纳入样本量较少,对于研究对象的选择可能存在一定的偏倚;AD患者并未取得病理结果作为诊断金标准,易导致轻型、无典型临床症状AD患者漏诊,存在一定误差。希望未来可以有更多多中心、前瞻性研究借助多模态超声获取更全面、更完整的EMI数据信息,为AD的检出提供更详细、更具体的方案。
综上所述,EMI区域功能与血流对AD具有一定的诊断价值,其定性评价指标EMI形态及定量分析参数EMI平均厚度、EMI-FI是AD的独立相关因素,其中EMI形态联合EMI平均厚度的诊断方法与临床具有较高的一致性,可提高AD检出率,为临床提供重要诊断信息。

