乳腺癌患者外周血中循环肿瘤细胞的检测及临床意义
郭毓娟 吴雄 郑舒静 陈雅贞
乳腺癌是女性较为常见的恶性肿瘤之一,其是发生在乳腺腺上皮组织的恶性肿瘤,已成为仅次于子宫颈癌的第一大恶性肿瘤,严重危害女性患者的生命安全[1]。调查统计显示,2020 年估计有230 万新发病例和68.5 万死亡病例,并呈现出上升的态势[2]。乳腺癌临床认为遗传、乳腺良性疾病未经治疗、更年期、过度饮酒等是其诱因,其早期症状不明显,起病隐匿较强,一旦发现通常已属肿瘤的中晚期,导致治疗困难,预后较差[3]。目前,临床治疗乳腺癌有手术,靶向药物治疗,放、化疗等方案,虽然可有效提高患者的生存率,但复发和转移仍是患者死亡的重要原因[4]。循环肿瘤细胞(circulating tumor cells,CTC)由澳大利亚籍医生Ashworth 于1869 年首次提出,其是指进入人体外周血肿瘤细胞的统称[5]。研究显示,CTC 在肿瘤的临床诊断、肿瘤病情转移、疗效评估中发挥着重要的作用,可有效降低患者的病死率[6]。研究报道,早期的乳腺癌患者有20%~30%会出现CTC,并可经过血液扩散至全身,是导致实体瘤远处转移的首要条件[7]。在外周血中检测到CTC 提示肿瘤存在转移情况发生,有进一步发展为远处转移的可能。因此,CTC 在外周血中的含量对乳腺癌的早期发现、治疗和预后具有密切的关系。当前,临床对于分离CTC 多采用密度梯度离心法、免疫磁珠法、微孔滤膜过滤法、双向电泳法等[8]。本研究采用纳米基底富集分离及免疫荧光染色法检测两组CTC 检测阳性率,并就乳腺癌患者外周血中CTC 进行检测,分析其与临床病理特征的关系,为临床提供参考。
1 资料与方法
1.1 一般资料
选取福建省漳州市医院乳腺外科2020 年12 月—2022年12 月收治的200 例乳腺癌患者纳入研究,年龄45 ~60岁,平均(50.22±5.31)岁;全部为女性;其中浸润性导管癌170 例,浸润性小叶癌30 例。并选择同期在福建省漳州市医院乳腺外科接受手术的40 例良性乳腺病进行对照研究,年龄44 ~59 岁,平均(51.34±5.31)岁;全部为女性;乳腺纤维腺瘤25 例,导管内乳头状瘤15 例。两组基线资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)患者均经手术病理证实。(2)就诊前未接受任何辅助性治疗。(3)无其他部位恶性肿瘤病史。(4)本研究患者知情,并签订知情同意书。排除标准:(1)哺乳期乳腺癌者。(2)炎性乳腺癌者。(3)合并严重心肝肾功能不全者。(4)存在其他恶性肿瘤者。(5)处于急性炎症过程中者。(6)合并糖尿病等基础性疾病者。本研究通过福建省漳州市医院伦理委员会批准。
1.2 方法
1.2.1 样本采集
采集患者空腹静脉血3 ~5 mL,防止穿刺部位污染,前3 mL 不用,给予抗凝处理后在血液室温15 ~30℃时保存备用。
1.2.2 CTC 检测纳米基底制备
将培养皿放置于等离子仪(广州善准科技有限公司,型号:VP-R5),用高功率高能氧等离子体轰击聚苯乙烯基板,制备均匀的纳米结构。用3%的APTES 润洗聚苯乙烯基底,使其覆盖上正电荷,避光1 h,培养皿放80℃烘箱烘干1 h 备用。
1.2.3 全血处理
采集的静脉血中注入4 mL 1×的红细胞裂解液中,室温放置10 min,然后离心5 min,以3 000 r/min 去除上清,保留细胞。向离心管中加入2 mL 1%磷酸缓冲盐溶液(phosphate buffered saline,PBS),然后离心5 min,以3 000 r/min 去除上清。放置于培养皿中,停留50 min。然后向培养皿中加入4%甲醛后置于4℃停留10 min。1 mL 封闭液中注入2 μL 抗泛角蛋白和2 μL 抗-人类表皮生长因子受体2(human epidermal growth factor receptor 2,Her2),2 μL 抗-CD11b 荧光标记一抗,混匀注入培养皿中,4℃孵化一晚。清除抗体,使用磷酸缓冲盐溶液清洗3 次,注入4 μL 山羊抗-兔 IgG 二抗,使其充分混匀后注入培养皿中室温孵化1 h。然后再清除抗体,使用磷酸缓冲盐溶液清洗3 次,随后加入1 mL 二脒基苯基吲哚(diamino-2-phenyl indole,DAPI),孵化30 min。清除抗体,使用磷酸缓冲盐溶液清洗3 次,注入DAPI,再用2 mL 磷酸缓冲盐溶液清洗3 次,然后再注入1 mL 酸缓冲盐溶液,放置于4℃保存。
1.2.4 免疫组化及荧光原位杂交检测
使用免疫组化检测雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR),克隆号分别为SP1、SP2,上海雅吉生物科技有限公司生产。ER、PE 呈黄色、棕黄色颗粒,位于细胞核,采用双人盲法观察结果,按照随机数据计数1 000 个细胞,选择10 个高倍视野,计算阳性细胞百分比,<10%确定为(-),≥10%确定为ER、PE(+)。如若结果双人出现5%的偏差则重新评估。采用(益善生物技术股份有限公司,国械注准20163400777)Her2 基因扩增试剂进行检查,检查步骤严格按照说明书进行。按照随机在荧光显微镜下选取20 个浸润性乳腺癌细胞核进行检查,按照2014 版中国乳腺癌Her2 检测指南。Her2 阳性标准:Her2/探 针 拷 贝 数CEP17(17p11.1-q11.1)<2.0 或Her2/CEP17 ≥2.0,平均Her2 拷贝数/细胞≥6,为Her2 阳性。
1.2.5 CTC 的鉴定方法
采用高分辨扫描仪购于(武汉光量科技有限公司,型号:BFI Plus)进行多色成像分析,选择异硫氰酸荧光素酯(fluorescein isothiocyanate isomer,FITC)、磺基菁5(sulfocyanine 5,CY5)、DAPI 通道。绿色为Her2(+)、蓝色为DAPI(+)、橙色为CD11b(+)、红色为CK(+),当DAPI(+)/CK(+)/CD11b(-)且呈现出完整的细胞形态则表示为CTC。若是DAPI(+)/CK(+)/Her2(+)/CD11b(-)则表示是Her2(+) CTC。操作人员观察表面荧光颜色,检测到1 个或以上的CTC 即为阳性。
1.3 观察指标
比较两组CTC 检测阳性率,分析CTC 与年龄、肿瘤大小(T 分期T1、T2、T3)、病理类型(浸润性导管癌、浸润性小叶癌)、血管侵犯、ER 和PR、淋巴结转移等临床病理特征相关性,并分析CTC Her2 表达。
1.4 统计学方法
使用SPSS 22.0 统计学软件分析数据。计量资料以(±s)表示,采用t检验;计数资料以n(%)表示,采用χ2检验,一致性比较采用Kappa 一致性检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组CTC 阳性检测情况比较
200 例 乳 腺 癌 组 织 中,CTC 阳 性130 例, 占 比65.00%;CTC 阴性70 例,占比35.00%;40 例乳腺良性组织未检测到CTC,两组比较差异有统计学意义(χ2=19.765,P<0.05)。
2.2 乳腺癌患者CTC 与临床病理特征的关系
乳腺癌患者阳性检测与血管侵犯有关(P<0.05);而与年龄、肿瘤大小、病理类型、ER、PR、淋巴结转移等均无相关(P>0.05)。见表1。
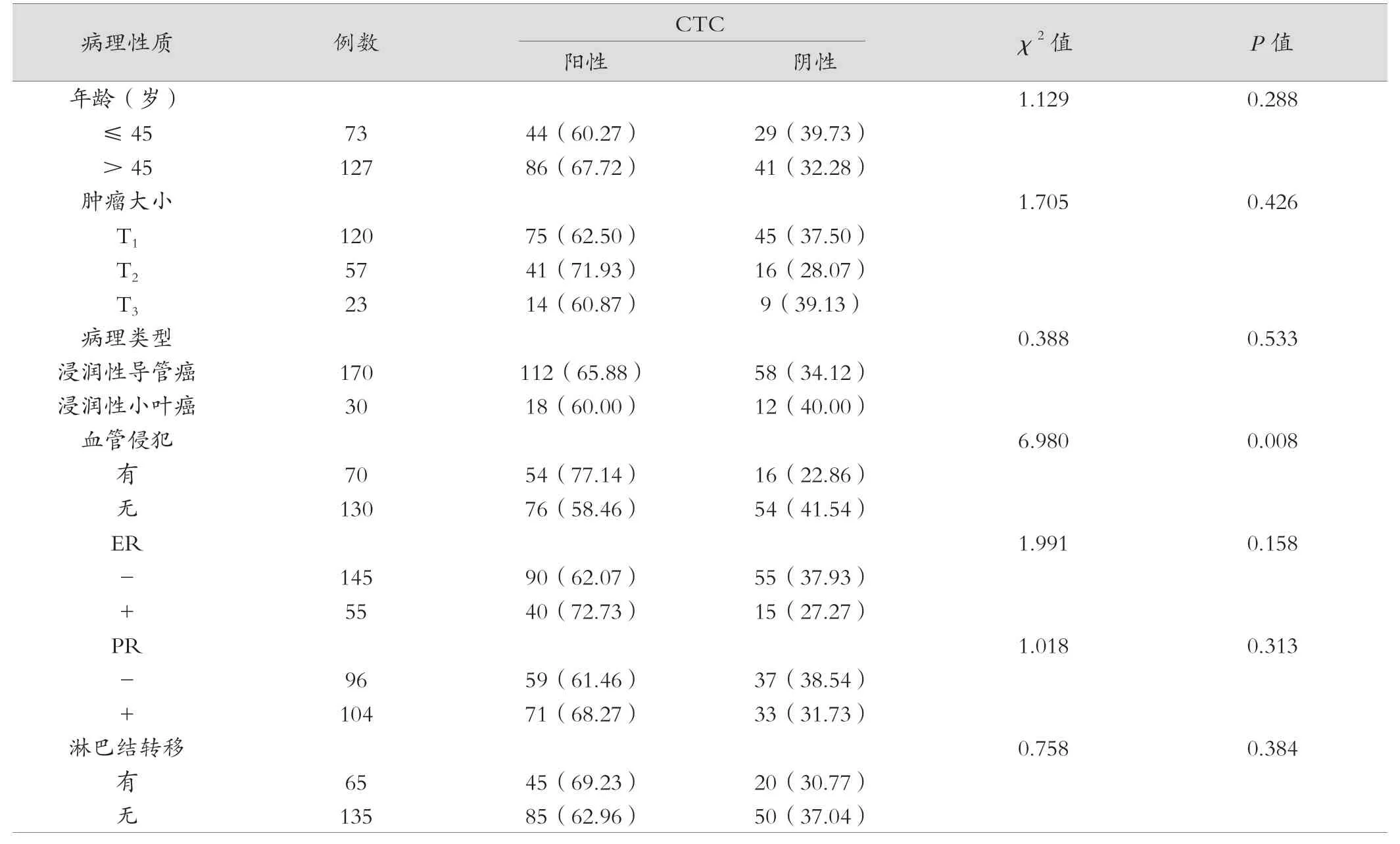
表1 乳腺癌患者CTC 与临床病理特征的关系[例(%)]
2.3 乳腺癌患者外周血CTC Her2 阳性检测率比较
130 例CTC 阳性乳腺癌患者有95 例乳腺癌组织检测到Her2 阳性。本次结果在外周血检查出CTC 存在Her2 阳性有80 例,阴性有15 例,经Kappa 一致性检验发现,Kappa值为0.812(P<0.05)。见表2。

表2 乳腺癌患者外周血CTC Her2 阳性检测率比较[例(%)]
3 讨论
乳腺癌是危害女性身体健康的恶性肿瘤,临床表现为乳房疼痛、肿块。研究显示,我国每年发病率超过50 万例,并呈逐年增长趋势[9]。乳腺癌早期缺乏明显症状,确诊时大多已发生为中晚期,预后较差。在乳腺癌的发生发展过程中,影响肿瘤细胞生物学行为的因素很多[10]。CTC 是指自发或因诊疗操作或肿瘤在形成发展中原发病变部位脱落或转移,从而进入到外周血液循环的肿瘤细胞统称[11]。CTC 作为液体活检的一种生物标志物,其具有反映肿瘤负荷,肿瘤转移病灶的潜力,在临床实践中得到了广泛的应用,是肿瘤转移过程中重要标志物[12]。研究报道,治疗过程中检测CTC 水平,能够为治疗方案提供一定的参考[13]。但CTC 在血液中含量极其稀少,基因表达不稳定的特点,每10 mL 血液中可能只含有几个、几十至上百个CTC,但它有上亿个红细胞与白细胞。因此,寻找有效的检测方法尤为重要。
研究显示,纳米基底富集分离及免疫荧光原位杂交技术的检测能够提高CTC 检测的敏感性和特异性[14]。本研究结果显示,200 例乳腺癌组织中,CTC 阳性130 例,占比65.00%;40 例乳腺良性组织未检测到CTC,两组比较差异有统计学意义(P<0.05);乳腺癌患者阳性检测与血管侵犯有关(P<0.05);而与年龄、肿瘤大小、病理类型、ER、PR、淋巴结转移等均无相关(P>0.05)。分析原因,实体肿瘤的部分肿瘤细胞存在上皮-间充质转化(epithelial-mesenchymal transformation,EMT)和间充质上皮转化(mesenchymal epithelial transformation,MET)功能。肿瘤细胞利用原发部位的EMT 作用侵入附近血管,从而在血液中循环。CTC 在血流的剪切力下死亡,只有少数具有高活性和转移潜力的肿瘤细胞在循环系统中存活[15-16]。本研究结果显示,乳腺癌患者外周血中CTC 阳性与血管侵犯相关。瘤细胞能够分泌血管内皮生长因子,从而促使肿瘤生长,肿瘤细胞本身进入血管与血液成分聚合,从而形成癌栓[17]。研究显示,外周血检出CTC 能够预测乳腺癌早期复发转移,是一种预后的独立预测因素,可为临床治疗提供依据[18]。并发现治疗后CTC 的存在与患者的无进展生存期及总生存期密切相关;CTC 数目越多,表示生存期越短。因此,外周血CTC 检测能够动态地观察乳腺癌患者病情变化,为其转移和复发的概率做出及时判断,也可对治疗方案提供一定的依据。Her2 作为乳腺癌重要的治疗靶点,其表达与乳腺癌的侵袭存在关系,是乳腺癌复发、转移的重要高危因素之一[19]。本研究结果显示,130 例CTC 阳性检查出95 例Her2 阳性。外周血检查出CTC 存在Her2 阳性有80 例,两者比较一致性为84.21%(80/95)。与李刚强等[20]结果相一致。由此表明CTC 表面分子标志物可以反映实体肿瘤细胞的生物学特性,检测CTC 中Her2 能够为靶向药物治疗提供一定的依据。但有相关研究报道认为,CTC 的Her2 表达在细胞分裂过程中是可变的,在Her2 阴性乳腺癌体内也可检出Her2 阳性的CTC,Her2阳性的CTC 可能也会分裂出Her2 阴性的CTC[21]。CTC源于肿瘤的一个亚群,存在较高的恶性潜能,其表型与组织存在差异,这可能是部分Her2 阳性患者对抗肿瘤药物治疗效果不佳的原因之一,可能实时监测CTC 中Her2表达对靶向药治疗具有重要的作用。同时,此文的研究结果为乳腺癌患者诊治标准制定提供了借鉴内容。
综上所述,乳腺癌患者外周血CTC 的表达可用于评估其病情,CTC Her2 检测可能有助实时判断Her2 的状态,对乳腺癌患者的预后有一定价值。

