不同抗病毒治疗方案对HIV病毒库的影响
陈思源 刘奉凤 黄成瑜 白艳 李梅
随着抗逆转录病毒疗法(antiretroviral therapy,ART)的进步,艾滋病(acquired immune deficiency syndrome,AIDS)已经从一种致死性疾病转化为可治疗的慢性感染性疾病。通过不断探索最佳的治疗模型可以实现更好地控制AIDS 的发展。本研究通过前瞻性队列研究方法,招募来自重庆市公共卫生医疗救治中心的人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者,分为四组进行临床观察。通过实时PCR 对外周血单个核细胞中的总HIV-1 DNA 进行定量,掌握不同ART 方案降低患者HIV-1 DNA的速率的特征和结局。从可预期的结果来看,HIV-1 DNA 是患者治疗评估的新指标;整合酶抑制剂(integrase inhibitors,INSTI)对比其他治疗方案有着更好的治疗效果。这一发现对于指导临床使用INSTI 的实践具有重要意义。
1 资料与方法
1.1 一般资料
选取2020 年9 月—2022 年8 月重庆市公共卫生医疗救治中心招募的813 例HIV 感染者,共有69 例被排除,其余的744 例参与者均符合纳入研究的条件。收集入组HIV 感染者的相关数据,并进行统计分析。
纳入标准:确认HIV 阳性、18 岁或以上自愿参加的HIV 感染者;疾病诊断标准参照《艾滋病和艾滋病病毒感染诊断》(WS293-2019)[1]、《中国艾滋病诊疗指南(2018版)》[2]的诊断标准。
排除标准:严重的机会性感染未得到控制者;肿瘤患者及肾衰竭患者;不能按时随访的患者。
1.2 方法
1.2.1 血浆HIV-1 RNA 检测
使用EDTA-K2 真空采血管抽取研究对象的静脉血,先离心分离血浆,然后采用与Cobas AmpliPrep/Cobas TaqMan 仪器配套的HIV 核酸定量试剂盒提取并定量检测样本血浆中HIV-1 RNA。
1.2.2 全血CD4+T 淋巴细胞(CD4+T lymphocyte,CD4+)和CD8+T 淋巴细胞(CD8+T lymphocyte,CD8+)计数
使用EDTA-K2 真空采血管抽取研究对象的静脉血,使用BD流式细胞仪与BD检测试剂盒检测CD4+和CD8+的计数,并计算CD4+/CD8+比值。
1.2.3 外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的提取以及PBMC 内HIV-1 DNA 定量检测
使用人外周血淋巴细胞分离液将PBMC 从抗凝全血中分离出来,使用广州海力特公司生产的HIV-1 DNA 提取试剂盒提取PBMC 中总DNA;之后使用广州海力特公司生产的HIV-1 DNA 定量检测试剂盒检测PBMC 中HIV-1 DNA 水平。
1.3 观察指标
收集所有调查对象的HIV-1 RNA、CD4+、CD8+以及CD4+/CD8+的数据,同时从血液中提取足量的PBMC,进行HIV-1 DNA 检测。
1.4 统计学方法
使用SPSS 26.0 统计学软件进行数据分析。计量资料以[M(P25,P75)]表示,采用Mann-WhitneyU检验;计数资料以n(%)表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 分组情况
区分纳入研究队列中的初治患者与经治患者;所有初治患者均基线期进行了HIV-1 DNA、HIV-1 RNA、CD4+、CD8+检测;在初治患者中,将使用第3 种药物为非核苷类反转录酶抑制剂(non-nucleoside reverse transcriptase inhibitors,NNRTI)分为A 组;使用INSTI 为B 组;经治患者均为经NNRTI 抗病毒治疗1 年及以上且实现病毒学抑制的成人,入组时进行了HIV-1 DNA、HIV-1 RNA、CD4+、CD8+检测;在经治患者中,将第3 种抗逆转录病毒药物为继续使用NNRTI 的患者分为C 组;将第3种抗逆转录病毒药物更换成INSTI 为D 组。分组后同纳入初治的A 组与B 组患者一般资料数据均经过严格的审核和处理,以确保数据的准确性和可靠性。
除了用药方案,患者的性别与年龄总体具有相似性,以确保患者的一般资料具有可比性;同纳入经治患者的C 组与D 组之间患者的一般资料亦具有可比性;各组存在部分检测指标数据缺失,剔除缺失数据患者后,A组183例,B组186例,C 组190 例,D 组185 例;各组情况见表1。其中373 例(A组+C 组)接受了含NNRTI 的方案,371 例(B 组+D 组)接受了INSTI。新发感染患者分为的A 组与B 组,两组性别、年龄差异无统计学意义(P>0.05);NNRTI 治疗1 年以上且实现病毒学抑制的患者分为的C 组与D 组,两组性别、年龄差异无统计学意义(P>0.05)。
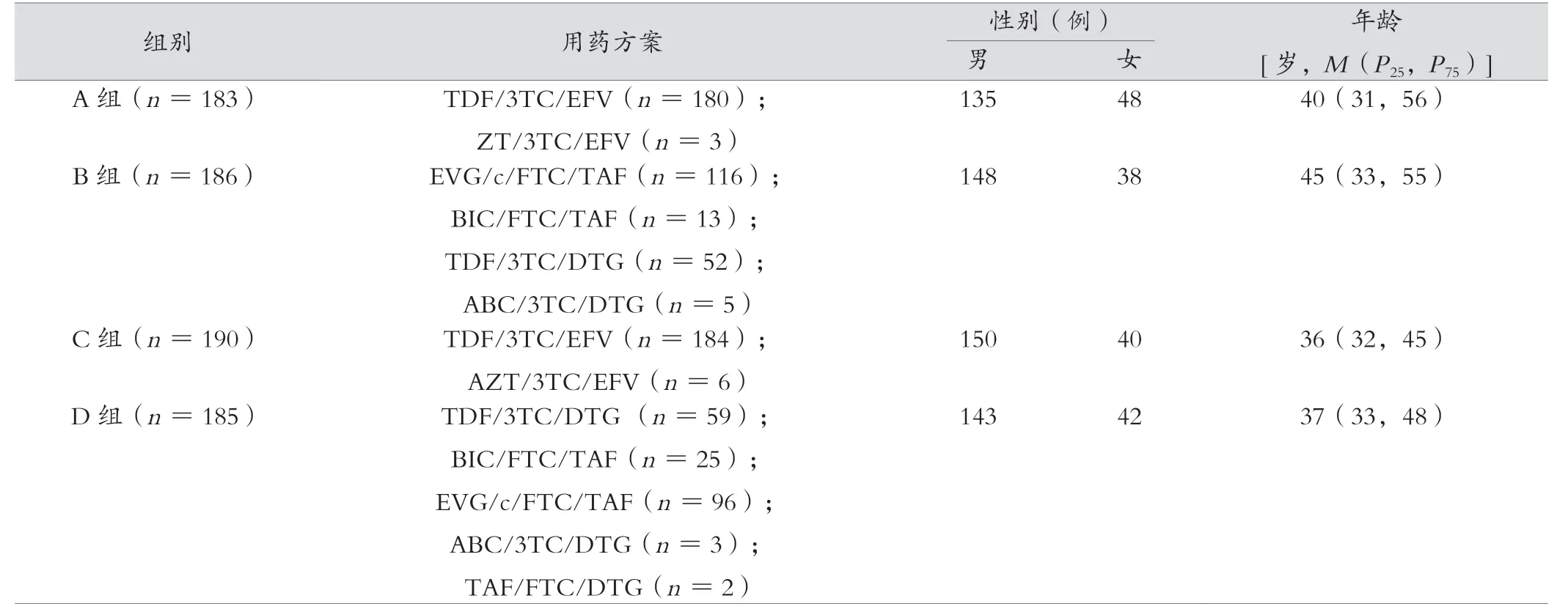
表1 总体分组基础信息汇总
2.2 各指标水平分布以及差异性分析
2.2.1 各指标水平分布情况
新发感染患者:在A 组检测结果中,将基线结果命名为A1 组,随访检测结果命名为A2 组;在B 组(INSTI 治疗方案)检测结果中,将基线结果命名为B1 组,随访检测结果命名为B2 组。NNRTI 治疗1 年以上且实现病毒学抑制的患者:在C 组检测结果中,将入组时检测结果命名为C1 组,随访检测结果命名为C2 组;在D 组(INSTI 治疗方案)检测结果中,将入组时检测结果命名为D1 组,随访检测结果命名为D2 组。各组各指标水平分布情况见表2。其中D2 组的HIV-1 RNA 载量均处于检测下限。

表2 各指标水平分布以及差异性分析[M(P25,P75)]
2.2.2 各指标入组差异性
新发感染患者A 组以及B 组入组时各检测指标差异无统计学意义(P>0.05);NNRTI 治疗1 年以上且实现病毒学抑制的患者入组时,HIV-1 RNA 水平差异有统计学意义(P<0.05);考虑为D1 组存在6 例高病毒载量样本(病毒载量>10 000 copies/mL);其余各检测指标差异无统计学意义(P>0.05)。见表2。
2.2.3 各指标水平统计学差异分析
在新发感染患者中,CD4+水平、CD4+/CD8+比值、HIV-1 RNA 载量、HIV-1 DNA 载量均差异有统计学意义(P<0.05)。在NNRTI 治疗1 年以上且实现病毒学抑制的患者,继续保持NNRTI 治疗或更改INSTI 治疗方案,CD4+水平、CD8+水平、CD4+/CD8+比值、HIV-1 DNA 载量均差异无统计学意义(P>0.05)。见表2。
3 讨论
截至2021 年底,全球有超过3 840 万人感染HIV,其中2 870 万人正在接受ART[3]。截至2020 年底,中国存 活HIV/AIDS 人 数 为105.3 万 人,2020 年 中 国 新 增HIV 感染131 671 例[4]。随着抗逆转录病毒药物的更新迭代,使新一代的治疗方案更加强效、长效,而且副作用更小,甚至对HIV 病毒储存库也有抑制效果。2012 年后全球已经迈入INSTI 时代。INSTI 与核苷类(nucleoside reverse-transcriptase inhibitors,NRTIs)、NNRTI 和蛋白酶(protease inhibitor,PIs)抑制剂相比,毒副作用更低、更高效、更安全。2021 年INSTI 的二联复方单品制剂拉米夫定多替拉韦片(多伟托)和三联复方单品制剂比克恩丙诺片(必妥维)进入我国医保,为AIDS 患者用药选择提供更多便利性和可选择性。
ART 取得的进展使HIV 病毒感染者活得更长、更健康,但长期存在的病毒库仍是根除HIV 感染的主要障碍。HIV-1 DNA 水平作为反映HIV 储存库容量的一个指标,可用于AIDS 患者ART 效果监测及病情预测。2020 年5 月中国发布的《全国艾滋病检测技术规范(2020 年修订版)》[5]中指出,“HIV-1 DNA 定量检测可判定HIV 储存库含量,更准确预测HIV 传播风险和病程进展。HIV-1 DNA 定量测定为进一步疗效评价提供新的技术手段”。
外周血HIV-1 DNA 定量检测作为新的、可重复的、临床可行的检测手段,对新型治疗方案及药物的疗效评估有重要价值。过去30 年,已有大量文献报道HIV-1 DNA 定量检测对HIV-1 筛查/极早期诊断和治疗效果评估有重大意义[6-9]。目前抗病毒治疗效果得到明显的改进,大多数(85%~95%)接受抗病毒治疗的患者血浆HIV-1 病毒载量(HIV-1 RNA)在3 ~6 个月应达到检测水平。但是,HIV-1 病毒储存库未被清除,成为疾病复发的根源。HIV-1 DNA 定量值反映的是HIV-1 病毒储存库的大小。接受抗病毒治疗的患者如果HIV-1 DNA 量值越低,说明病毒抑制的越好,发生AIDS 相关性疾病、免疫重建不良的风险更低,合并感染及死亡率也低,简化治疗成功可能性更高。基于不同治疗方案患者HIV-1 DNA 下降数据的缺乏,分析了初治及经治患者使用不同的第3 种抗逆转录病毒药物HIV-1 DNA 变化。
HIV-1 DNA 在感染开始后就已经存在,并随着时间的推移而持续存在,随时准备产生新的病毒。《中国艾滋病诊疗指南(2021 年版)》[10]中提到,HIV 核酸定量是判断疾病进展、临床用药、疗效和预后的重要指标。因此,本研究对初治及经治患者的细胞前病毒HIV-1 DNA 进行了定量分析,包括4 种不同的抗逆转录病毒治疗方案,初治第3种药物为NNRTI 或INSTI,经治第3 种药物继续NNRTI 或由NNRTI 更换成INSTI。
初治HIV 感染者通过有效的ART 治疗,HIV-1 DNA水平都可以得到有效降低。吴育龙等[11]报道,含依非韦伦的一线方案和含洛匹那韦/利托那韦的二线方案对患者PBMC 中HIV-1 DNA 含量的影响差异无统计学意义(P>0.05)。研究还发现随着ART 延长,PBMC HIV-1 DNA 逐渐消减,这表明PBMC HIV-1 DNA 检测有助于判断ART 疗效。YUE 等[12]报道,一项针对在48 周内成功达成HIV-1 血浆RNA 抑制的慢性HIV-1 感染者,通过有效ART 治疗24周,总HIV-1 DNA 从基线(中位数=3.00 log10 拷贝/106PBMC)迅速降到第24 周(中位数=2.55 log10 拷贝/106PBMC)。MONDI 等[13]报道,开始使用替诺福韦/恩曲他滨/拉替拉韦/利托那韦或替诺福韦/恩曲他滨/多替拉韦进行ART,两个治疗组都显示出相当高的病毒抑制率和达到低水平HIV-1 DNA。
经治HIV 感染者,不管继续原方案或更换成INSTI 方案,HIV-1 DNA 量没有显著改变,这表明大多数HIV-1 DNA 整合在大多数病毒学控制良好的患者中。LIANG 等[14]报道,分别有36.0%(27/75)和52.1%(38/73)的患者在ART 治疗后12 和24 个月的抗艾滋病毒水平下降超过基线水平的75%。然而,在ART 后24 个月后,大部分患者的HIV-1 DNA 水平基本保持稳定。RINALDI 等[15]报道,一项针对接受ART 3 年以上、HIV-1 RNA 低于50 拷贝/mL超过2 年且CD4+细胞计数超过350 个细胞/μL 的患者进行的横断面、多中心研究。HIV-1 DNA 中位数为323 拷贝/10 PBMC(IQR,129 ~717),低、中和高水平分别为28.3%、55.4%和16.3%。长期抑制性ART 的慢性HIV 感染患者总HIV-1 DNA 较低,但尽管长期抑制病毒,但1/6的HIV-1 DNA 仍高于1 000 拷贝/10 PBMC。
本研究存在一些局限性,如:(1)使用基于PCR 的检测方法评估HIV-1 DNA 无法区分具有复制能力的病毒和病毒缺陷形式。(2)PBMC 中HIV-1 DNA 的检测,仅占病毒库的一小部分。(3)患者招募中缺乏随机化。
综上所述,初治HIV 感染者不管采用什么治疗方案,获得了较低量的HIV-1 DNA,显示INSTI 治疗组的HIV-1 DNA 减少较NNRTI 治疗组更明显。说明早治疗能减少病毒库的形成,INSTI 优于NNRTI。经治HIV 感染者,不管继续原方案或者更换成INSTI,HIV-1 DNA量无显著差异。

