伏诺拉生二联和经典四联根除幽门螺杆菌临床研究
李高忠,贾晴,曹京梅
伏诺拉生二联和经典四联根除幽门螺杆菌临床研究
李高忠,贾晴,曹京梅
淄博市中心医院消化内科,山东淄博 255000
比较伏诺拉生联合高剂量阿莫西林(二联方案)与以伏诺拉生为基础四联方案根除幽门螺杆菌的效果及安全性。选取2021年5月11日至2021年10月17日在淄博市中心医院就诊的130例幽门螺杆菌阳性患者,采用随机数字表法分为伏诺拉生二联组(伏诺拉生20mg bid+阿莫西林0.75g q6h,=65)和伏诺拉生四联组(拉生伏诺拉生+阿莫西林1.0 bid+另一种抗生素+铋剂,=65),疗程均为14d,疗程结束至少1个月后复查13C呼气试验,应用意向性分析(intention-to-treat,ITT)和符合方案分析(per-protocol analysis,PP)两种方法比较两组间根除率,并比较不良反应。二联组失访1例,四联组失访2例,按ITT分析,二联组和四联组根除率分别为87.7%(57/65)和89.2%(58/65),两组比较,差异无统计学意义(2=0.075,=0.784)。按PP分析,二联组和四联组根除率分别为89.1%(57/64)和92.1%(58/63),两组比较,差异无统计学意义(2=0.334,=0.563)。四联组整体不良反应发生率(35.9%,23/64)高于二联组(17.5%,11/63),差异有统计学意义(=0.014)。与标准四联方案相比,伏诺拉生二联方案幽门螺杆菌根除率无差异;二联不良反应发生率更低。伏诺拉生二联方案值得临床推广。
幽门螺杆菌;伏诺拉生;二联疗法;根除率;阿莫西林;不良反应
幽门螺杆菌与诸多消化道疾病密切相关。根除幽门螺杆菌可有效预防及治疗诸如消化性溃疡、黏膜相关淋巴组织淋巴瘤等疾病。随着抗生素广泛使用,幽门螺杆菌根除率下降。部分患者难以耐受联合使用抗生素。文献报道质子泵抑制剂(proton pump inhibitor,PPI)联合使用大剂量阿莫西林取得良好的根除效果[1]。伏诺拉生是一种新型抑酸药物,在根除幽门螺杆菌中具有明显优势[2]。本研究比较伏诺拉生二联方案(伏诺拉生20mg bid+阿莫西林0.75g q6h,以下简称伏诺拉生二联方案)和伏诺拉生四联方案(拉生伏诺拉生+阿莫西林1.0 bid+另一种抗生素+铋剂,以下简称伏诺拉生四联方案)初次治疗幽门螺杆菌,并记录相关不良反应、患者依从性等。
1 资料与方法
1.1 一般资料
选取2021年5月11日至2021年10月17日在淄博市中心医院就诊的130例幽门螺杆菌阳性患者,采用随机数字表法分为伏诺拉生二联组和伏诺拉生四联组,每组65例。纳入标准:①年龄18~70岁;②经13C呼气实验证实为幽门螺杆菌感染且愿意进行根除治疗患者;③既往未接受过幽门螺杆菌根除治疗。排除标准:①孕妇、哺乳期妇女、嗜酒及精神失常者;②对所用药物过敏者;③肝肾功能异常者。伏诺拉生二联组男30例,女35例,四联组男33例,女32例,两组患者的性别、年龄分布比较,差异均无统计学意义(>0.05),具有可比性。本研究经淄博市中心医院伦理委员会审批通过(伦理审批号:202105001),患者均签署知情同意书。
1.2 方法
二联方案:伏诺拉生20mg,每天2次;阿莫西林0.75g,每天4次,疗程14d。
四联方案:伏诺拉生20mg,每天2次;阿莫西林1g,每天2次;枸橼酸铋钾220mg,每天2次;另外一种抗生素根据患者既往应用抗生素及过敏史情况选用:如患者既往应用大环内酯药物,应用左氧氟沙星0.5g/d,如应用过喹诺酮类药物,应用克拉霉素0.5 bid,如均使用过以上两种药物,应用甲硝唑0.4 q6h治疗。疗程14d。
1.3 观察指标
停用抗幽门螺杆菌药物4周后,并且在复查4周前停用抗生素/铋剂/抗菌中药,2周前停用PPI或者H2受体拮抗剂,复查13C尿素呼气试验,结果低于参考范围判定为根除成功。
1.4 统计学方法
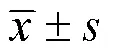
2 结果
2.1 二连组和四联组根除率比较
二联组患者65例,失访或未能完成治疗评估1例,根除成功64例。四联组患者65例,失访或未能完成治疗评估2例。其中四联组中选择左氧氟沙星31例,失访1例,根除成功28例;克拉霉素18例,根除成功16例;选择甲硝唑16例,失访1例,根除成功14例。
按照PP分析,二联组根除率为89.1%(57/64),四联组根除率为92.1%(58/63),两组间根除率差异无统计学意义(2=0.334,=0.563)。按照ITT分析,二联组根除率为87.7%(57/65),四联组根除率为89.2%(58/65),两组间根除率比较,差异无统计学意义(2=0.075,=0.784)。
2.2 二连组和四联组不良反应发生率情况
常见不良反应如腹泻、腹胀、便秘、恶心、皮疹、腹痛、味觉障碍等。二联组服药过程出现1例皮疹,停止治疗后皮疹消失。四联组恶心发生率(20.6%,13/63)显著高于二联组(4.7%,3/64)(=0.007)。四联组味觉障碍发生率为14.3%(9/63),二联组为3.1%(2/64),四联组显著高于二联组(=0.025)。四联组整体不良反应发生率为35.9%(23/64),显著高于二联组17.2%(11/64)(=0.014)。
3 讨论
幽门螺杆菌感染是人类常见的慢性细菌感染,影响全球约50%人口[3]。幽门螺杆菌感染与胃炎、消化性溃疡病和胃癌等疾病有关,因此推荐根除治疗以改善和减少这些疾病。随着抗生素耐药率增加,幽门螺杆菌治疗根除率下降。指南建议联合使用抗生素治疗10~14d以提高根除率[4]。然而,联合使用抗生素存在一些缺点,包括不良反应增加,成本高,依从性低。这些缺点阻碍其在常规临床实践中使用。此外,抗生素联用会增加耐药风险[5]。因此,需要能够最大限度减少抗生素。根除幽门螺杆菌基本原则如下:①选择幽门螺杆菌敏感的抗菌药物;②优化胃内pH值。PPI通过以下机制发挥其作用:①提高胃内PH值,提高抗生素稳定性和生物利用度;②促进幽门螺杆菌复制,对抗生素(例如阿莫西林)更敏感[6];③抑制酸分泌,从而增加胃内抗生素的浓度;④具有抗幽门螺杆菌作用。
PPI主要由细胞色素P450(CYP2C19)代谢。CYP2C19遗传多态性分为快速代谢者、中间代谢者和弱代谢者,这影响PPI抑酸效果和血浆浓度。不同基因型组存在胃酸差异,这被认为是由不同基因型导致的[7]。胃内pH值与幽门螺杆菌根除率密切相关。根除成功组胃pH值中位数为6.4,显著高于未根除组(5.2,=0.013)。不同基因型酸抑制参数显著不同。当胃内pH值<4.0时间百分比达到<10%和24h pH值达到>6.0,无论细菌对克拉霉素敏感度如何,大多数患者获得根除[8]。因此根除幽门螺杆菌时候需要仔细优化使用抑酸药物。
2017年世界卫生组织发布克拉霉素对幽门螺杆菌耐药被归类为高优先级细菌。究其原因,推测与大环内酯类药物频繁使用及该类药物很容易地诱导包括幽门螺杆菌在内细菌耐药性有关。此外,近年来世界许多地区对甲硝唑和左氧氟沙星的耐药率增加了超过15%。目前我国幽门螺杆菌对多种抗生素高耐药,且双重耐药明显增加。但对阿莫西林原发性耐药和继发性耐药非常低[9]。单一抗生素阿莫西林治疗可能不会增加幽门螺杆菌耐药性。
克拉霉素耐药性可通过测量位点突变来估计[10]。通过基因分型确定幽门螺杆菌菌株对抗生素敏感度和CYP2C19基因多态性制定根除幽门螺杆菌的策略[11]。鉴于幽门螺杆菌药物敏感试验、耐药基因费时、费力以及花费问题,不具备普遍可行性。因此根据当地耐药率情况和临床试验结果进行初次经验性治疗是主要治疗方法[12]。国内研究显示,基于抗菌药物使用史选择抗生素有助于提高根除率[13]。基于既往抗生素使用史选择药物,尽管无药敏结果帮助,依然取得理想根除率。
阿莫西林严重依赖抑酸治疗。阿莫西林是一种青霉素衍生物,通过抑制细菌细胞壁的形成发挥杀菌作用。阿莫西林抗菌活性具有pH值依赖性[14]。只有当细菌繁殖活跃时才能有效杀菌。一方面,抑酸药物减少胃液分泌,使胃内阿莫西林浓度明显增加,超过最低抑菌浓度(minimum inhibitory concentration,MIC);另一方面,胃内pH值增加可以降低阿莫西林的MIC[15]。双重治疗方案一个关键参数是维持血浆阿莫西林浓度高于MIC水平,以发挥杀菌作用。当胃内pH值接近中性时,幽门螺杆菌对阿莫西林敏感性明显提高。阿莫西林由肾脏排泄,血浆半衰期约为1h,杀菌作用呈时间依赖性;对幽门螺杆菌等革兰阴性菌几乎没有抗生素后效应。因此,理论上阿莫西林应每天服用3~4次,以最大限度延长其高于MIC的时间。然而,目前大多数方案中,采用阿莫西林每天给药两次的方法,这难以保证根除效果。本研究二联组增加阿莫西林给药频率和总剂量,取得不劣于标准四联药物根除效果。
20世纪90年代年代研究发现二联疗法根除率难以接受[16]。抑酸药物和/或阿莫西林剂量不足是二联疗法低根除率的重要原因。良好抑酸药物+大剂量阿莫西林可获得较高根除率[17]。阿莫西林1g tid+艾司奥美拉唑40mg bid ITT分析根除率达92.5%,PP分析达96.1%[1]。因此,二联方案是可供选择的治疗方案。PPI抑酸作用受CYP2C19基因型的影响。基于CYP2C19基因多态性个性化治疗策略有助于提高根除率。日本按照基因型应用兰索拉唑,根除率可达96%。基于耐药基因检测和药敏实验的烦琐的治疗策略严重影响临床推广使用[11]。
伏诺拉生是一种新型钾竞争性酸阻滞剂,具有很强的抑制胃酸作用,即使单独给药,胃pH值也经常超过7。与其他PPI相比,伏诺拉生具有更强、更持久的抑制胃酸作用[18],并且其药代动力学特征不受CYP2C19多态性的影响[19]。治疗CYP2C19快代谢基因型患者酸相关性疾病更优选择[18]。伏诺拉生强效抑酸作用有助于提高幽门螺杆菌根除率。日本推荐伏诺拉生、阿莫西林和克拉霉素三联作为一线治疗[21]。Meta分析显示伏诺拉生三联首次根除治疗根除率显著高于含PPI三联疗法[2]。按照PP分析,伏诺拉生二联组(伏诺拉生20mg +阿莫西林750mg bid)不劣于伏诺拉生三联组(伏诺拉生20mg +阿莫西林750mg+克拉霉素200mg,bid)。对于克拉霉素耐药组,二联方案根除率高于三联[5]。Furuta等[20]ITT分析:双联疗法的根除率(92.9%)并不逊于三联疗法(91.9%,=0.728)。Xu等[21]比较了高剂量双联疗法、铋剂四联疗法、序贯疗法、伴随疗法和混合疗法等一线疗法的疗效,认为14d疗程的高剂量双联疗法似乎是亚洲人最佳一线治疗。本研究认为14d高剂量阿莫西林联合伏诺拉生双联方案是可推荐的首次根除方案。伏诺拉生二联方案根除率高,安全性和耐受性好,治疗费用低,抗菌素耐药性或引起肠道微生物群失调风险降至最低[22]。本研究中伏诺拉生每天2次,相较于每天4次PPI,可极大提高依从性和满意度。
研究表明,对克拉霉素耐药菌株而言,二联方案(伏诺拉生+阿莫西林)根除率高于三联疗法(伏诺拉生+阿莫西林+克拉霉素)(92.3%76.2%,=0.048)[5],这或许涉及伏诺拉生和克拉霉素相互作用的药代动力学。伏诺拉生和克拉霉素均由相同肝酶代谢,同时使用两种药物可使伏诺拉生最大血浆浓度和血浆浓度–时间曲线下面积增加1.5~1.9倍[23]。这提示对于克拉霉素耐药患者而言,加用克拉霉素治疗,除增加患者费用和不良反应外,或许会增加根除失败率。这需要更多的研究证实。
综上,在抗生素耐药率增加的情况下,14d伏诺拉生加高剂量阿莫西林二联方案根除率不劣于经典四联方案,且不良反应发生率低,值得临床应用,尤其对于那些难以耐受联合使用多种抗生素患者。
[1] YU L, LUO L, LONG X, et al. High-dose ppi-amoxicillin dual therapy with or without bismuth for first-line helicobacter pylori therapy: a randomized trial[J]. Helicobacter, 2019, 24(4): e12596.
[2] SUGIMOTO M, YAMAOKA Y. Role of vonoprazan in helicobacter pylori eradication therapy in Japan[J]. Front Pharmacol, 2019, 9: 1560.
[3] SJOMINA O. Epidemiology of helicobacter pylori infection[J]. Helicobacter, 2018, 23(1): e12514.
[4] 王江滨, 杜奕奇, 吕农华. 第五次全国幽门螺杆菌感染处理共识报告[J]. 中华消化杂志, 2017, 37(6): 15.
[5] SUZUKI S. Seven-day vonoprazan and low-dose amoxicillin dual therapy as first-line Helicobacter pylori treatment: a multicentre randomised trial in Japan[J]. Gut, 2020, 69(6): gutjnl-2019–319954.
[6] SCOTT D R, WEEKS D, HONG C, et al. The role of internal urease in acid resistance of Helicobacter pylori[J]. Gastroenterology, 1998, 114(1): 58–70.
[7] FURUTA T, OHASHI K, TAKASHIMA M, et al. CYP2C19 genotype status and effect of omeprazole on intragastric pH[J]. Gastroenterology, 1998, 114(1): A127.
[8] SUGIMOTO M, FURUTA T, SHIRAI N, et al. Evidence that the degree and duration of acid suppression are related to helicobacter pylori eradication by triple therapy[J]. Helicobacter, 2010, 12(4): 317–323.
[9] Liang C M, Tai W C, Hsu P I, et al. Trend of changes in antibiotic resistance in Helicobacter pylori from 2013 to 2019: a multicentre report from Taiwan:[J]. Therap Advances Gastroenterol, 2020, 13: 409–414.
[10] FRANCAVILLA R, LIONETTI E, CASTELLANETA S, et al. Clarithromycin-resistant genotypes and eradication of Helicobacter pylori[J]. Annals Int Med, 2006, 157(2): 228–232.
[11] FURUTA T, SHIRAI N, KODAIRA M, et al. Pharmacogenomics‐based tailored versus standard therapeutic regimen for eradication of H. pylori[J]. Clin Pharmacol Ther, 2007, 81(4): 521–528.
[12] 陆红. 根除幽门螺杆菌感染的经验性治疗[J]. 中华消化杂志, 2017, 37(3): 4.
[13] 聂尚姝, 宋志强, 索宝军. 抗菌药物用药史对铋剂四联疗法根除率的影响[J]. 中华内科杂志, 2021, 60(11): 5.
[14] GRAHAM D Y, DORE M P. Helicobacter pylori therapy: a paradigm shift[J]. Exp Rev Anti-infect Ther, 2016, 14(6): 577.
[15] 杨桂彬. 阿莫西林用于幽门螺杆菌根除治疗的几点问题[J]. 中华医学杂志, 2020, 100(30): 3.
[16] WONG B, XIAO S, HU F, et al. Comparison of lansoprazole-based triple and dual therapy for treatment of Helicobacter pylori-related duodenal ulcer: an Asian multicentre double-blind randomized placebo controlled study[J]. Aliment Pharmacol Ther, 2000, 14(2): 217–224.
[17] 李彩玲. 质子泵抑制剂和阿莫西林双联方案在幽门螺杆菌感染根除治疗中的应用[J]. 中华医学杂志, 2021, 101(10): 4.
[18] SAKURAI Y, MORI Y, OKAMOTO H, et al. Acid-inhibitory effects of vonoprazan 20 mg compared with esomeprazole 20 mg or rabeprazole 10 mg in healthy adult male subjects--a randomised open-label cross-over study[J]. Aliment Pharmacol Ther, 2015, 42(6): 719–730.
[19] JENKINS H, SAKURAI Y, NISHIMURA A. et al. Randomised clinical trial: safety, tolerability, pharmacokinetics and pharmacodynamics of repeated doses of TAK-438 (vonoprazan), a novel potassium- competitive acid blocker, in healthy male subjects[J]. Aliment Pharmacol Ther, 2015, 41(7): 636.
[20] FURUTA T, YAMADE M, KAGAMI T, et al. Dual therapy with vonoprazan and amoxicillin is as effective as triple therapy with vonoprazan, amoxicillin and clarithromycin for eradication of helicobacter pylori[J]. Digestion, 2020, 101(6): 743–751.
[21] XU H, WANG W, MA X, et al. Comparative efficacy and safety of high-dose dual therapy, bismuth-based quadruple therapy and non-bismuth quadruple therapies for Helicobacter pylori infection: a network meta- analysis[J]. Eur J Gastroenterol Hepatol, 2021, 33.
[22] SUZUKI S, KUSANO C, HORII T, et al. The ideal helicobacter pylori treatment for the present and the future[J]. Digestion, 2022, 103(1): 62–68.
[23] SAKURAI Y, SHIINO M, OKAMOTO H, et al. Pharmacokinetics and safety of triple therapy with vonoprazan, amoxicillin, and clarithromycin or metronidazole: a phase 1, open-label, randomized, crossover study[J]. Advances Ther, 2016, 33(9): 1–17.
Studies on the eradication ofin dual therapy based on vonoprazan and high-dose amoxicillin and classical four-combination
Department of Gastroenterology, Zibo Central Hospital, Zibo 255000, Shandong, China
To compare the eradication rate of helicobacter pylori and safety of vonoprazan and high-dose amoxicillin dual therapy with and vonorasen-based quadruple regimen.A total of 130 patients withwere selected from the outpatient department of Zibo Central Hospital from May 2021 to July 2021. The patients were randomly divided into two groups:dual therapy group (vonoprazan 20mg bid+ amoxicillin 0.75g q6h,=65) and quadruple therapy group (vonoprazan + amoxicillin 1.0 bid + another antibiotic + bismuth agent,=65) for 14 days. The13C breath test was repeated at least 1 month after the treatment. intention-to-treat (ITT) and per-protocol analysis (PP) were used to compare the eradication rate between the two groups. The rate of adverse reactions was recorded.One case was lost to follow-up in the dual therapy group, and two cases were lost to follow-up in the quadruple therapy group. According to ITT analysis, the eradication rates in the dual therapy group and the quadruple therapy group were 87.7% (57/65) and 89.2% (58/65), respectively. There was no difference in the eradication rates between the two groups (2=0.075,=0.784). On analysis by PP ,the eradication rates of the dual therapy group and the quadruple therapy group were 89.1% (57/64) and 92.1% (58/63), respectively, and there was no difference between the two groups (2=0.334,=0.563). The rate of adverse reactions of quadruple therapy group (35.9%, 23/64) was higher than that of dual therapy group (17.5%, 11/63) (=0.014).There was no difference ineradication rates in dual therapy group compared with the standard quadruple regimen, but the incidence of adverse reactions is less. Dual therapy group (vonoprazan 20mg bid+ amoxicillin 0.75g q6h) for eradication ofis worthy of clinical promotion
; Vonoprazan; dual therapy; Eradication rate; Amoxicillin; Adverse reactions
R573.4
A
10.3969/j.issn.1673-9701.2023.26.025
李高忠,电子信箱:ligaozhong05@163.com
(2022–11–07)
(2022–12–30)

