糖尿病性溃疡中核因子κB 通路的作用机制及相关中药干预
于天一,杨春雨,赵 钢
糖尿病性溃疡是糖尿病最常见的并发症之一。据统计,糖尿病患者一生中有15%~25%的概率发生糖尿病性溃疡,溃疡创面难以愈合,经医疗处理后,5 年复发率约为50%~70%,大量患者常由于此类原因最终不得不选择截肢,其发生率比普通人群约高15 倍,该类截肢是目前非创伤性截肢的最主要原因[1-2]。同时有研究表明,糖尿病性溃疡患者截肢术后的死亡率约为70%,仍处于较高水平。目前认为有效治疗糖尿病性溃疡、阻止肢体大面积坏死是降低截肢率、保证患者存活的重要手段[3]。
核因子κB(NF-κB)是一种蛋白质复合物,与人体多种生理病理过程有关,参与细胞对各项刺激的反应,包括应激、细胞因子、氧自由基、重金属、有毒物质、辐照及微生物等。目前普遍认为NF-κB 在应对感染引发的免疫应答过程中起关键作用。
1 NF-κB 在糖尿病性溃疡中的作用
1.1 NF-κB 通路的经典激活过程 NF-κB 通路基本可以被概括为激活前和激活后两个状态,其激活过程见图1[4]。

图1 NF-κB 蛋白激活示意图[4]
激活前状态:在未受刺激状态下,NF-κB 蛋白通常由p65 和p50 形成二聚体,被NF-κB 二聚体抑制蛋白(IκB)包裹形成了三聚体复合物,被其保护在细胞质中,防止其进入细胞核进行转录作用。激活后状态:当受到特定的刺激后,NF-κB 通路会被激活,通过相应的信号转导通路激活IκB 激酶(IKK),IKK 磷酸化IκBα 使其降解,进而使p65 和p50 二聚体从三聚体中解离出来,暴露出核定位序列(NLS),迅速进入细胞核启动转录。
进入细胞核后的NF-κB 家族转录因子结合到特定的DNA 序列上调控多种基因表达,通常导致炎症反应的发生和持续,导致充血、水肿、炎性细胞浸润、结缔组织增生等一系列病理过程。通常情况下,此类反应有助于致炎因子的清除从而消除病灶,但对于糖尿病性溃疡患者,该反应常常是过度的,反应链条的失控加重了组织破坏,使创面恢复面临更大的挑战。
1.2 NF-κB 通路激活导致血管内皮细胞的功能障碍 在生理状态下,NF-κB 通路对内皮细胞中的作用包括:调节炎症反应、调节血管收缩和扩张、调节血小板聚集和血栓形成、参与新生血管形成、调节细胞凋亡等[5]。在病理状态下可出现下列异常情形。
1.2.1 内皮细胞凋亡 当NF-κB 通路被激活时,可以诱导内皮细胞释放多种炎症介质和黏附分子,如白细胞介素(IL)-1β、IL-6、肿瘤坏死因子α(TNF-α)、细胞间黏附因子1(ICAM-1)、血管细胞黏附因子(VCAM-1)等,这些物质除诱导白细胞浸润外,还可对内皮细胞产生直接毒性作用,导致内皮细胞凋亡和组织坏死[6-7]。
1.2.2 血管收缩和扩张的失调 血管内皮细胞通过控制一氧化氮(NO)的合成和释放参与调节血管的收缩和扩张,NF-κB 通路过度激活抑制NO 的合成,从而导致血管收缩,长期的过度血管收缩影响血供,最终引起组织缺血[8]。
1.2.3 血小板聚集和血栓形成的增加 血管内皮细胞通过调节血管性血友病因子(vWF)的表达来控制血小板的聚集,进而调控血栓形成。NF-κB 通路过度激活可增加vWF 的表达水平,从而促进血栓形成过程[9]。
上述3 个过程都会不同程度的引发机体局部的微循环障碍,且存在相互作用关系,共同的影响是导致组织缺血,对糖尿病性溃疡患者而言,这是组织坏死、组织修复困难、创面免疫力低下并反复感染的核心原因。
1.3 NF-κB 通路激活直接诱导组织细胞凋亡 其诱导组织细胞凋亡的机制可能涉及以下几个方面。
1.3.1 调节转录因子的表达 该通路通过控制凋亡相关蛋白的表达,进而控制线粒体外膜通透性,实现对细胞凋亡的调控,最常见的是下调抗凋亡蛋白(Bcl-2 proper、Bcl-xl 和Bcl-w)的表达和上调促凋亡蛋白(Bax、Bad)的表达,从而引起细胞凋亡[9-10]。
1.3.2 激活凋亡信号通路 NF-κB 通路可以直接或间接地调节凋亡信号通路,其中最重要的是活化半胱氨酸天冬氨酸蛋白酶(Caspase),激活后引起凋亡蛋白酶级联反应,细胞内多种酶物质被激活,逐步降解胞内重要蛋白质,导致细胞发生不可逆的凋亡过程[11-12]。
1.3.3 激活氧化应激反应 NF-κB 通路活化会增加细胞内氧化应激水平,导致细胞膜的过氧化和DNA 的损伤,从而诱导细胞凋亡。该通路激活可以下调超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗氧化酶(GPx)等酶物质的表达,降低细胞抗氧化能力;同时还可上调还原型辅酶Ⅱ(NADPH)等氧化酶的表达,影响线粒体膜电位、呼吸链复合体等功能,最终诱导氧自由基(ROS)的产生和线粒体损伤[13-14]。
1.3.4 与其他信号通路相互作用 有研究指出,NF-κB 通路也可与多种其他信号通路产生协同作用,如应激活化蛋白激酶通路(JNK)、丝裂原活化蛋白激酶通路(p38 MAPK)等,共同引起细胞凋亡[15]。
综上所述,在不受控的炎症反应下,NF-κB 通路的过度激活可引起广泛的细胞凋亡,对局部循环、神经系统构成进一步打击,导致糖尿病性溃疡创面难以愈合。
1.4 NF-κB 通路激活引起微循环紊乱 微循环指血液在毛细血管和小血管中的流动和交换过程,该过程的影响因素主要包括微血管内皮细胞、平滑肌细胞、周围神经组织等。微循环紊乱可能导致组织缺氧、代谢物聚集等病理变化,而NF-κB 通路激活则是重要的调节因素,具体表现如下。
1.4.1 促进内皮细胞的黏附分子表达 内皮细胞是微循环系统的关键组成部分,当NF-κB 通路被激活时,可上调内皮细胞表面VCAM-1、ICAM-1 等黏附分子的表达,从而促进血液细胞的黏附和聚集,影响微循环的正常运行[8,16-17]。
1.4.2 引起血管壁的损伤 该通路的激活可以诱导氧化应激和炎症反应,导致血管壁内皮细胞的损伤和凋亡(详见前述1.3.2 及1.3.3 段落),从而影响微循环的通透性、弹性和稳定性。
1.4.3 促进血小板的聚集 血小板的聚集是影响血管通透性和血流动力学稳定性的关键因素[18](详见前述1.2.3 段落)。
1.4.4 影响新生血管的形成 在组织修复和再生过程中,新生血管的形成对于微循环恢复至关重要,NF-κB 通路的激活可以诱导血管内皮生长因子(VEGF)的表达,并促进内皮细胞的增殖和分化,加快新生血管的形成,这一过程有助于恢复组织血供,对患者的恢复产生正面作用[19-21]。
上述四方面作用中的前三者均对肢体微循环产生不利影响,只有第四者具有积极意义,但新生血管因其滞后性,并不能抵消现存血供系统内大范围的微循环紊乱造成的供血供氧障碍。
1.5 NF-κB 通路激活导致胰岛素抵抗和降低岛素分泌 胰岛素抵抗指胰岛素对体细胞作用的降低,该过程导致血糖水平升高,并刺激胰岛素分泌增加;但胰岛β 细胞凋亡则导致分泌源的不足,最终影响胰岛素的分泌能力。现有研究表明NF-κB 通路在这些过程中发挥关键作用,具体如下。
1.5.1 诱导炎症反应 炎症反应是引起胰岛素抵抗和胰岛β 细胞凋亡的重要因素之一,当NF-κB被激活时,会上调多种炎性因子的表达,如TNF-α、IL-1β 等,从而导致炎症反应的发生和加剧,最终诱发目标细胞凋亡[22-23]。
1.5.2 影响胰岛素信号转导 有研究认为,胰岛素信号转导是胰岛素的作用基础,而其异常可能导致胰岛素抵抗的发生,当NF-κB 通路被激活时,可以上调细胞因子信号传导抑制蛋白1(SOCS-1)等抑制因子的表达,从而抑制胰岛素信号转导的正常进行,最终引发胰岛素抵抗[24-25]。
1.5.3 直接引起胰岛β 细胞凋亡 NF-κB 通路被激活会下调Bcl-2 等抗凋亡因子的表达,同时上调Bax、Caspase 等促凋亡因子的表达,从而诱导胰岛β细胞的凋亡(详见前述1.3.2 段落),导致胰岛素分泌不足[26]。
1.5.4 影响胰岛素分泌途径 胰岛素分泌途径包括胰岛素前体的合成、分泌和转化等多个环节。当目标通路被激活时,可以影响这些环节中的多种关键基因和蛋白包括胰岛素表达,如调节因子1(PDX-1)、葡萄糖转运蛋白2(GLUT-2)、胰岛素前体蛋白(Insulin1/2)、热休克蛋白70(Hsp70)等,从而影响胰岛素的分泌和调节[24,27-28]。
由上述内容可知,NF-κB 通路激活引起的血管内皮细胞的功能障碍、组织细胞凋亡、微循环紊乱、胰岛素抵抗和降低岛素分泌,这四大方面问题互相作用,共同导致了糖尿病性溃疡创面难以愈合,逻辑关系见图2。
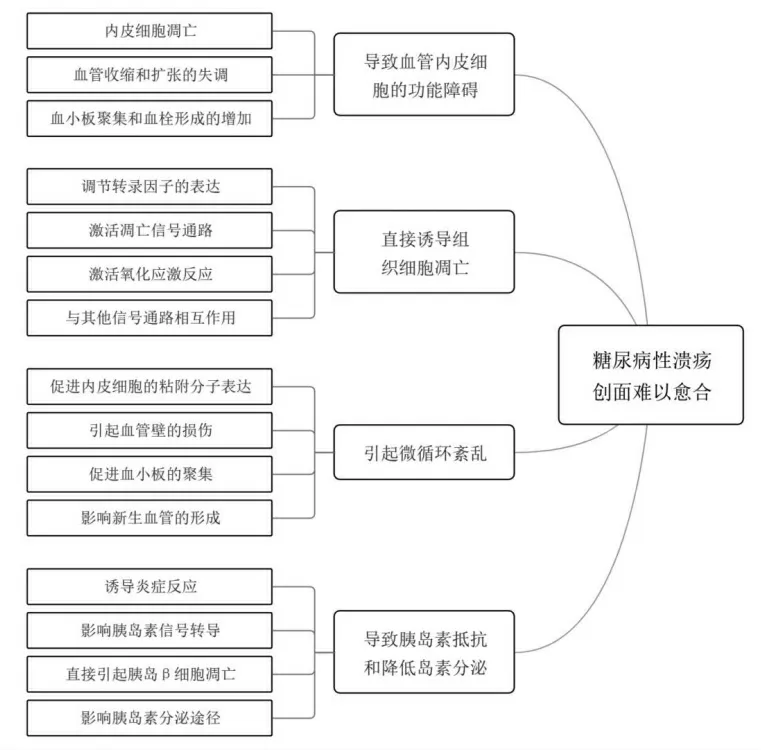
图2 NF-κB 通路激活导致糖尿病性溃疡创面难以愈合的病理过程
2 中医治疗糖尿病性溃疡与NF-κB 通路的相关性研究
现代医学对于该病的治疗主要集中于手术清创及后续创面护理,调节血糖以稳定机体内环境,抗生素控制溃疡局部感染,抗血小板聚集及抗血栓形成保障微循环,各类生长因子应用以促进愈合,对于无法控制的坏死则采取手术切除等办法,但目前来看效果尚不理想。现已有大批学者在临床观察和基础研究中发现中医药对该病有较好的治疗作用。
2.1 传统中医学对于糖尿病性溃疡的认识 传统中医学认为该病是由于多种因素导致的下肢血脉痹阻,不能荣养筋肉导致的,普遍认为其发生常与以下几方面有关:气血不足、阴虚阳亢、瘀血阻络、湿热邪毒。
2.2 现有基于NF-κB 通路的抗糖尿病性溃疡药物研究 通过对近年基于NF-κB 通路的抗糖尿病性溃疡药物研究文献的检索和总结,目前的中药研究热点如下。
2.2.1 紫朱软膏 组方中药包括朱砂、紫草、血竭、黄芪、阿胶和冰片。韩强等[29]认为该类创面愈合受损通常伴随异常的炎症反应、血管生成减少和成纤维细胞增殖不足,在动物实验中发现紫朱软膏可显著抑制糖尿病性溃疡模型中NF-κB 通路的激活,从而抑制炎症反应促进创面愈合,并证明该药可通过抑制以上通路降低IL-1、IL-6、TNF-α 等炎性因子的表达[30]。
2.2.2 疮疡I 号 组方中药为连翘、黄芩、赤芍、当归、苦参。临床研究认为该方在抗微生物、缓解血管收缩、改善凝血等方面有积极意义,可在降低IL-6的同时升高IL-10 水平[31]。梁学威等[32]通过动物实验证实该功效与NF-κB 通路受到抑制有关。
2.2.3 石香膏 组方中药为乳香、没药、赤石脂、栀子、煅龙骨、冰片。凌一鸣等[33]证实石香膏外敷对糖尿病大鼠慢性难愈合创面的糖基化终末产物受体(RAGE)、NF-κB-p65、eNOS 信号通路均具有抑制作用。费冀等[34]在研究中指出,该药可以下调晚期糖基化终末产物(AGEs)、RAGE 表达水平,间接抑制了NF-κB 通路的激活。
2.2.4 湿润烧伤膏 组方中药为黄芩、黄连、黄柏、地龙、罂粟壳。李杰辉等[35]通过糖尿病性溃疡大鼠创面治疗实验证明该药能够能通过调控AGEs-RAGE信号转导通路中NF-κB 表达水平影响创面愈合,认为AGEs 与RAGE 结合后,可引起氧化应激并通过激活p38 ras 蛋白及MAP 途径激活NF-κB,目标药物抑制了这一过程并显著促进了成纤维细胞及新生毛细血管的生长,同时减少炎性细胞浸润。
2.2.5 芪蛭降糖片 组方中药为黄芪、水蛭、黄精、生地。张舒慧等[36]采用芪蛭降糖片灌胃治疗糖尿病足部溃疡大鼠模型,认为NF-κB 信号通路激活能够造成β 细胞功能障碍和胰岛损伤,其特点是大鼠胰腺组织损伤明显,表现为细胞水肿变形、胰岛细胞数目减少、弥散,而目标药物能够促进胰腺组织损伤修复,降低胰腺组织TGF-β 和NF-κB 表达。
2.2.6 复方足疡平 组方中药为黄连、当归、北刘寄奴、炉甘石、煅石膏、乳香、冰片。张宏等[37]认为,糖尿病性溃疡难以愈合与AGEs-RAGE 信号转导通路有关,糖尿病大鼠处于高血糖状态下,易产生AGEs,其逐渐积存溃疡创面,激活NF-κB 信号通路,而该药可以抑制这一过程。
2.2.7 生肌象皮膏 组方中药当归、生血余、象皮粉、生地黄、龟甲、生石膏、炉甘石。温莹莹[38]在研究中指出该药在治疗糖尿病大鼠难愈性溃疡过程中可抑制NF-κB 通路激活,在减少炎症反应导致的凋亡增加同时,减轻炎症及高糖环境对HIF1 表达的抑制,加速糖尿病难愈创面的愈合进程。
2.2.8 黄芪多糖 为中药黄芪的有效成分。大量研究指出其疗效可能源于其对NF-κB 的拮抗作用,如吴朝妍等[39-40]通过大鼠模型灌胃治疗,印证了黄芪多糖可抑制肾阳虚型糖尿病大鼠肾脏中NF-κB的过度表达。张正军等[41]则直接将其应用于糖尿病足部溃疡渗出液成纤维细胞实验,认为该药可以抑制IL-1β 所致的金属蛋白酶(MMP)-2、MMP-9 高活性及其蛋白高表达,且作用效果与给药浓度存在相关性。
2.2.9 雷公藤甲素 为中药雷公藤的常见提取物,临床常用的免疫抑制类药物。应用本品干预糖尿病NF-κB 通路的研究较多,但直接用于治疗糖尿病性溃疡的文献较少,通常认为其可以抑制TLR/NF-κB信号通路相关因子表达,减轻糖尿病模型小鼠细胞损伤,保护靶细胞功能,起到治疗作用[42-43]。
2.2.10 伤科黄水 以黄连、栀子为组方。吴英等[44]应用其对消肿祛腐期糖尿病足患者进行治疗,结果显示其可抑制创面局部组织NF-κB 的表达,降低细胞因子IL-1β、TNF-α 水平,且具有抗氧化作用。此外也有研究证实该药对糖尿病足患者炎性因子有抑制作用,但并未直接观测NF-κB 通路表达水平,如刘倩等[45]认为伤科黄水可以降低糖尿病足部溃疡患者的血清TNF-α、IL-6 水平。
2.2.11 积雪草苷 为天胡荽属伞形科植物中药材积雪草的有效成分,用其治疗糖尿病性溃疡的研究和观察其对NF-κB 通路影响的研究较多,但尚无用其治疗糖尿病足并同时观察NF-κB 通路的研究。孙玉红等[46]在应用该品治疗糖尿病大鼠的实验中证明,该药抑制糖尿病血管平滑肌细胞增殖可能与降低NF-κB 表达有关。
3 小结与展望
糖尿病性溃疡迁延不愈与NF-κB 通路介导的过度炎症反应密切相关,许多有效中药制剂的研究聚焦于对该通路的抑制作用。但炎症反应本身是一个复杂的过程,多种因子在疾病过程中相互作用形成庞大的信号网络[47]。因此对碎片化的信号通路研究进行整合十分必要,未来的研究重点将一方面集中于通过实验研究进一步发掘NF-κB 通路对各炎性因子产生的影响上;另一方面通过整合,整理交互作用机制,形成系统理论。

