HtrA1 在溃疡性结肠炎患者肠黏膜和外周血中的表达及临床意义
陈智成,苏丽婷,李义诺
(1.武警河南省总队医院消化内科,河南 郑州 450052;2.河南省第三人民医院综合内科,河南 郑州 450052)
溃疡性结肠炎(UC)是炎症性肠病的主要类型,其特征是反复发作的慢性非特异性胃肠道炎症[1]。研究发现血小板炎症反应参与了UC 的病理生理过程[2-3],UC 患者具有显著的血小板活化,可能需要高温需求丝氨酸蛋白酶A(High temperature requirementprotein A,HtrA)活化,然后分泌炎症因子IL-1β,参与炎症过程。HtrA1 是一种热诱导基因,对于细菌在高温下的生存必不可少,HtrA1 可以在高温下降解周质中错误折叠的蛋白质[4]。HtrA1 参与了多种炎症性疾病,如自身免疫性疾病、感染和败血症。在硫酸葡聚糖诱导的结肠炎小鼠模型中,HtrA 表达在第5 天增加并在2 周内保持在高水平[5-6]。与野生型小鼠相比,表达HtrA1 过表达突变体的转基因小鼠表现出STAT3 的磷酸化增加,且遭受的结肠炎更严重。在2,4,6-三硝基苯磺酸诱导的结肠炎小鼠模型中,HtrA1 在肠粘膜淋巴细胞中高表达,HtrA1 低表达小鼠随着年龄的增长而自发发展为结肠炎[7-8]。本研究旨在研究HtrA1 在UC 患者肠黏膜和外周血中的表达及临床意义,为UC 的诊断及治疗提供依据。
1 资料与方法
1.1 临床资料 选取2018 年1 月至2020 年12 月武警河南总队医院收治的溃疡性结肠炎患者130例为病例组,所有病例组的病理诊断由本院病理学家确诊。病例组全结肠病变33 例,左侧结肠病变68 例,乙状结肠病变15 例,直肠病变病14 例。依据改良的Mayo 评分系统对疾病进行分期:活动期轻度(排便次数<4 次/d,无明显临床症状,ESR低于20 mm·h-1)45 例,活动期重度(腹泻次数≥6次/d,明显血便,体温高于37.8℃、脉搏>90 次/min,Hb 小于75%正常值,ESR 大于30 mm·min-1)25例,活动度中度(上述症状或体征介于轻度和重度之间)60 例。依据预后情况分为预后良好组(黏膜愈良好、无复发、无并发症)(101 例),预后不良组(黏膜愈合欠佳、复发、合并并发症或接受结肠切除术治疗)(29 例)。纳入标准:(1)年龄≥18 岁;(2)符合 《炎症性肠病诊断与治疗的共识意见(2012,广州)》以及的《中国炎症性肠病标准诊治共识分析》;(3)患者与家属知情同意。排除标准:(1)肠结核;(2)癌症史;(3)妊娠期妇女。选择同期非溃疡性结肠炎患者(结肠镜检查正常结肠组织)130 例为对照组。
1.2 方法
1.2.1 肠黏膜和外周血中HtrA1 mRNA 测定 常规获取血清;组织样本在结肠镜检查或手术时获得,对直肠乙状结肠(肛门近端10~20 cm)进行活检。在结肠镜检查时获得的组织用镊子收集,并立即置于RNAlater 或快速冷冻中。手术样本由人体组织研究中心通过在结肠切除术后不久对粘膜进行剥离并置于RNAlater 或快速冷冻中获得。在4℃下2 至4 周后,去除多余的RNAlater,并将组织储存在-80℃。使用带有无RNAase 珠子的BulletBlender(NextAdvance,AverillPark,NewYork)将组织匀浆,并使用QiagenAllprepDNA/RNA/miRNA 提取试剂盒(Hilden,德国)提取总RNA。使用Agilent2100 生物分析仪测量RNA 完整性。分析中使用的所有样品的RNA 完整性值为0.6。对于HtrA1 mRNA PCR,使用通用cDNA 合成试剂盒(Exiqon)从250 ng 总RNA 制备cDNA。HtrA1、GAPDH 的引物由Exiqon 设计和合成。使用ExiLENTSYBRGreenmastermix (Exiqon) 使用Roche Light Cycler480(Roche Indianapolis IN)进行定量实时逆转录PCR。HtrA1、GAPDH 序列如下:HtrA1(F:TCGTCGATGCTAGTCGATCGATCGTAGCTAGCTAGCTGATCGATCGTAGCTAGC,R:TTGCGATCGATGCTAGCTAGCTAGTCGATCGATCGATCGATCGATCGATCGATGC),GAPDH (F:TCGAGCGATCGTACGTAGCTAGCTGACTGATCGATCGTAGCTAGCTAGC,R:TGTCGTAGCTAGTCGATCGTAGCTAGCTAGTCGATCGTAGCTAGCTAGCTAGCTAGTC)。使用2-DDCt方法进行HtrA1 水平定量。
1.2.2 AST、ALT、TBIL、ALB、ESR、PT、PTA 指标测定 贝克曼AU-680 全自动生化分析仪(美国库尔特公司)以及CA-7000 全自动凝血分析仪(希森美康)测定白蛋白(Albumin,ALB)、谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartateamino transferase,AST)、总胆红素(Total bilirubin,TBil)、总胆固醇(Total cholesterol,TC)、甘油三脂(Triglyceride,TG)、凝血酶原时间(Prothrombintime,PT)、凝血酶原活动度(Prothrombin activityprothrombin time activity,PTA);血沉(Erythrocyte sedimentation rate,ESR)。
1.3 统计分析 采用SPSS 25.0 对数据分析,计量资料以均数±标准差表示,采用t 检验或单因素方差分析比较,相关分析采用Pearson 分析,多因素Logistic 回归分析探讨溃疡性结肠炎预后的相关因素,P<0.05 为差异有统计学意义。
2 结果
2.1 对照组、病例组一般临床资料比较 表1 可见,与对照组比较,病例组ALB、TBIL、PT、PTA、MELD 水平升高(P<0.05);而两组性别、年龄、ALT、AST、TC、TG 等比较差异无统计学意义(P>0.05)。

表1 对照组、病例组一般临床资料情况比较
2.2 对照组、病例组肠黏膜、外周血HtrA1 表达水平比较 表2 可见,与对照组比较,病例组肠黏膜、外周血HtrA1mRNA 表达水平升高(P<0.05)。
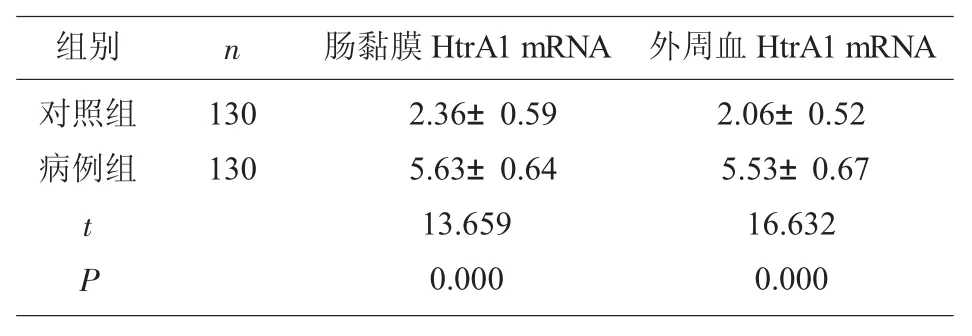
表2 对照组、病例组肠黏膜、外周血HtrA1 表达水平比较
2.3 轻度组、中度组、重度组肠黏膜、外周血HtrA1表达水平比较 表3 可见,与轻度组比较,中度组、重度组肠黏膜、外周血HtrA1 表达水平升高,随着溃疡性结肠炎患者病情严重程度的增加,肠黏膜、外周血HtrA1 表达水平逐渐升高(P<0.05)。
2.4 不同预后组HtrA1 表达水平比较 表4 可见,与预后良好组比较,预后不良组肠黏膜、外周血HtrA1 表达水平升高(P<0.05)。

表4 不同预后组HtrA1 表达水平比较
2.5 HtrA1 与各指标的相关性分析 表5 可见,肠黏膜、外周血HtrA1 mRNA 与TBIL、PT、PTA 正相关,与PTA、ALB、ESR 负相关(P<0.05)。
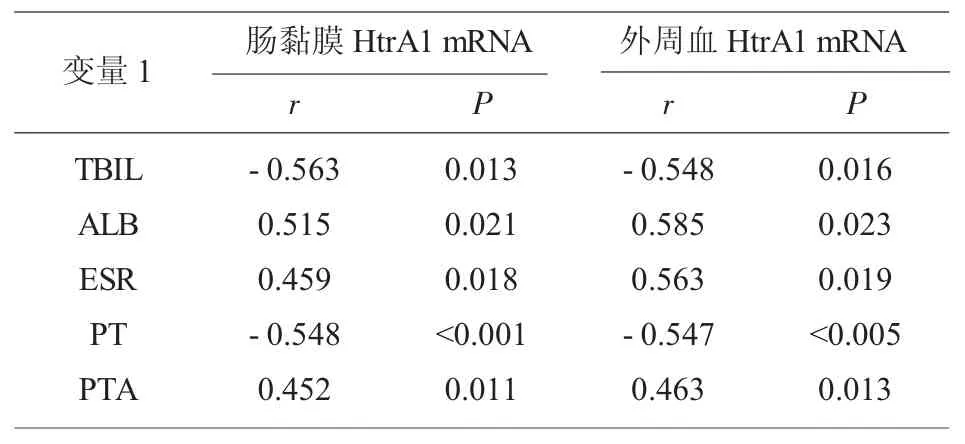
表5 HtrA1 与各指标的相关性分析
2.6 溃疡性结肠炎患者预后多因素Logistic 回归分析 表6 可见,以溃疡性结肠炎预后为应变量(预后不良=1,预后良好=0),单因素分析有意义的因素为自变量进行多因素Logistic 逐步回归分析,结果发现高水平肠黏膜HtrA1 mRNA、外周HtrA1 mRNA 均为溃疡性结肠炎预后的危险因素(P<0.05)。

表6 溃疡性结肠炎患者预后多因素Logistic 回归分析
3 讨论
UC 的病因和发病机制非常复杂,由环境、免疫和遗传等多种因素引起的黏膜免疫系统异常引起的炎症过程在UC 的发病中发挥着重要作用。近年来,UC 的发病率呈上升趋势,重症患者的报告病例也较多。临床研究表明,UC 是一种慢性炎症性肠病,其特征是黏膜免疫反应失调,微血管炎症引起的肠道多灶性梗死已成为UC 发病的重要机制。持续的高凝状态可能与UC 的临床进展有关并具有促进炎症发生发展的作用。本研究通过检测UC 组织中分子生物标志物HtrA1 的表达,为阐明UC 的发病机制提供进一步的信息。
HtrA1 是一种具有236 个氨基酸的蛋白质,包含一个胞外域、一个跨膜域和一个胞质域。细胞外结构域对于与FVII 的结合和外源性凝血途径的启动至关重要,并且具有促凝血活性和蛋白水解功能[9-10]。胞质结构域末端3 个丝氨酸残基的磷酸化可介导细胞内信号转导,促进血管内皮生长因子(VEGF)的转录和合成[13]。HtrA1 引发的凝血过程是通过外源性凝血途径,这是凝血的启动阶段,HtrA1 在生理止血和病理性血栓形成中具有重要意义,并参与炎症反应。跨膜结构域也可能在信号转导中发挥作用,但胞内结构域的功能是近年来HtrA1 研究的热点[11-12]。在人肺成纤维细胞中,HtrA1依赖的VEGF 表达需要FVII 与HtrA 结合,而FVII 与失活的活性位点和HtrA1 结合可抑制VEGF 的产生,VEGF 参与了UC 的发病机制,并与疾病的严重程度有关[14]。HtrA1 与其受体FVIIa 结合触发细胞内信号转导机制并诱导基质金属蛋白酶(MMPs)的上调,其参与组织修复并且在炎症性疾病中具有非常重要的意义[15]。大量研究证实,MMPs 参与UC 患者的基底炎症组织修复、血管生成和白细胞趋化,且MMPs 在UC 组织中高表达,并随着炎症的加重而增强。本研究结果显示,与对照组比较,病例组肠黏膜、外周血HtrA1 mRNA 表达降低(P<0.05)。随着溃疡性结肠炎患者病情严重程度的增加,肠黏膜、外周血HtrA1 表达逐渐降低(P<0.05)。这表明UC 组织和正常结肠组织之间HtrA1 的表达水平不同,提示HtrA1 可能与UC 的发生有关,高凝状态和肠道微血栓形成可能介导了HtrA 在UC 中的作用。
近期研究发现,HtrA1 主要由TH2 细胞表达,HtrA1 负向调节IL-12 到STAT4Th1 通路,是介导TH2 反应所必需的。HtrA1 表达与哮喘和特应性皮炎、众所周知的TH2 型疾病的病理以及过敏人类患者血清IgE 水平之间的强相关性;HtrA1 转基因小鼠在气道高反应模型系统中增加了TH2 反应。因此,HtrA1 在调节TH2 介导的免疫疾病的发生和维持中具有重要作用[16]。最近有报道通过腺病毒HtrA1 基因转移在肺中过表达HtrA1 增强了IgG免疫复合物诱导的肺损伤。因此,在有炎症的粘膜中高水平表达的HtrA1 可能在UC 中具有病理作用[17-18]。此外,肠黏膜、外周血HtrA1 mRNA 与TBIL、PT、PTA 正相关,与PTA、ALB、ESR 负相关(P<0.05)。这说明HtrA1 作为间接炎症介质刺激其他炎症介质释放并诱发炎症反应,可能参与了这一过程,表明HtrA1 与UC 疾病炎症特征相关。在小鼠模型中,HtrA1 mRNA 主要在DSS 处理的结肠炎的增生上皮细胞和固有层单核细胞中表达,同时,HtrA1 蛋白增加并主要定位于固有层淋巴细胞,在结肠炎小鼠模型的隐窝上皮细胞中表达水平较高。本实验研究数据显示,HtrA1 mRNA 的表达与组织学炎症的程度密切相关。因此,炎性固有层免疫细胞的积累可能是HtrA1 mRNA 增加的主要来源之一。HtrA 表达与UC 严重程度之间的相关性提出了一种可能性,即患者中HtrA1 高表达可能归因于TH2 细胞在固有层中的积累,导致粘膜炎症的恶化,这需要进一步研究HtrA1 在细胞中的定位。
此外,本研究也发现,预后不良组肠黏膜、外周血中HtrA1 表达水平升高(P<0.05);高水平肠黏膜HtrA1 mRNA、外周HtrA1 mRNA 均为溃疡性结肠炎预后的危险因素(P<0.05),这说明HtrA1 是影响UC 预后的因素。
综上所述,HtrA1 在溃疡性结肠炎患者肠黏膜和外周血中的表达升高,HtrA1 是影响UC 病情及预后不良的影响因素之一。

