胀果甘草花粉生活力测定及甘草的杂交育种
谢姿雁, Botir Khaitov, 杨天顺, 李重, 李勇青,6*, 王瑛,6*
胀果甘草花粉生活力测定及甘草的杂交育种
谢姿雁1,2,3, Botir Khaitov4, 杨天顺1,2, 李重5, 李勇青1,2,3,6*, 王瑛1,2,3,6*
(1. 中国科学院华南植物园, 中国科学院华南农业植物分子分析与遗传改良重点实验室, 广东省应用植物学重点实验室, 广州 510650;2. 华南国家植物园, 广州 510650;3. 中国科学院大学, 北京 100049; 4., Tashkent 100084, Uzbekistan;5. 百瑞源枸杞股份有限公司,银川 750200;6. 中国科学院核心植物园, 广州 510650)
杂交育种是最为传统的选育新品种的方式之一,花粉生活力能够影响其中遗传物质的传递。胀果甘草是3种药典收录的甘草之一,具有许多特殊活性成分。通过TTC法和离体萌发法对2个胀果甘草()种质资源GJJ-7和GJJ-9花朵开放5个时期(a~e)的花粉生活力进行测定。结果表明,GJJ-7花粉生活力趋势在5个时期呈现波浪型,在a、d时期达到最高;GJJ-9花粉生活力会随着花瓣展开度的变大而升高,在e时期达到最高。离体萌发结果表明GJJ-7和GJJ-9花粉生活力随花朵开放程度增大呈先升高后降低的趋势,萌发力均在c时期最高。杂交结荚率则与离体萌发结果一致,说明离体萌发法测定花粉生活力比TTC法更可靠。以光果甘草() S-7和S-12为母本的杂交组合结荚率低,但能够获得发芽率高的种子;以乌拉尔甘草() GDN-16为母本的杂交组合结荚率高,但种子发芽率低,说明在甘草杂交中父母本的选择对结荚率有重要影响。
甘草;花粉生活力;杂交育种
甘草是多年生草本植物,为豆科(Leguminosae)甘草属()植物,在我国药用历史悠久。《中华人民共和国药典》规定,光果甘草()、乌拉尔甘草()和胀果甘草()等3种甘草的干燥根和根茎可入药[1]。野生甘草往往比栽培甘草品质更好,药用价值更高,但是人们的过度采挖已经严重地破坏了野生甘草原本的生长环境, 因此野生甘草资源面临枯竭的困境。人工培育并种植是保护甘草野生种质资源的有效途径,目前已有多种药用植物通过选择育种、杂交育种等方式获得了优质的药用植物新品种[2–5]。通过培育、筛选出高产高品质的甘草新品种,不仅能缓解野生资源匮乏的问题,而且有助于增加甘草产量,满足市场需求的同时保护生态环境[6]。
本团队广泛收集了野生甘草资源,并从中选育了5份优良的种质资源:乌拉尔甘草GDN-16、胀果甘草GJJ-7和GJJ-9、光果甘草S-7和S-12。前期研究表明不同物种根茎中的代谢物具有差异累积的现象,胀果甘草GJJ-7和GJJ-9根中含有特征性化合物甘草查尔酮A,且生物量较大;光果甘草S-7和S-12根中能够积累含量较高的光甘草定,生物量也较大;而乌拉尔甘草GDN-16根中甘草酸含量更高,但生物量较小。甘草酸具有抗癌[7]、抗炎[8]和抗病毒[9]等药理活性,是甘草的特殊甜味来源[10],且药典中规定,甘草干燥品中甘草酸的含量不得低于2%[1]。如果能够通过杂交获得生物量大,且富含甘草酸以及其他次生代谢物的甘草新品种, 将有助于满足市场的多样化需求。
杂交是传统的培育作物新品种的方式之一,其中花粉生活力指数是影响杂交成功率的关键因素之一。测定甘草的花粉生活力,有助于提高杂交结荚率,获得更多的杂交后代[11]。本研究基于从野生资源中选育出的5份优良甘草种质资源,对两个胀果甘草品种GJJ-7和GJJ-9不同开放程度的花朵进行花粉生活力的测定,同时进行甘草杂交,旨在探索提高杂交效率的方法,并培育集合亲本优良性状的甘草新品种。
1 材料和方法
1.1 试验区域和材料选择
供试材料胀果甘草()品种GJJ-7和GJJ-9均来自宁夏回族自治区银川市西夏区平吉堡西北农业生物中心。
GJJ-7和GJJ-9的花粉生活力测定实验于2020年6月—7月进行。选择当天采摘的新鲜花朵,将开花状态分为a~e时期(图1)。a时期雄蕊低于雌蕊, 花药微微裂开散出少量花粉;b时期雄蕊与雌蕊继续生长,但二者相对距离增大,此外花药裂开程度加大,能够观察到有少量花粉附着在柱头上;c时期花药几乎完全裂开,雌蕊继续生长,与雄蕊间距离继续拉大,此时能够观察到花粉大量附着在柱头上;d时期翼瓣展开,龙骨瓣微微裂开,此时的花粉已经能从花朵中由虫媒散布;e时期的花朵完全打开,花药开始萎缩变黑。从a时期到e时期约需要3 d。

图1 胀果甘草开花过程的5个时期。a: 花药开始散粉; b: 旗瓣白色部分露出2 mm; c: 旗瓣开缝2 mm; d: 翼瓣展开; e: 龙骨瓣展开。
杂交试验材料有乌拉尔甘草GDN-16、胀果甘草GJJ-7和GJJ-9、光果甘草S-7和S-12等5个种质资源。
1.2 方法
1.2.1 TTC法测定花粉生活力
TTC是脂溶性光敏感复合物,能够与活细胞线粒体内的琥珀酸脱氢酶反应,生成红色的甲臜,以显示细胞的生活力[12–13]。利用0.5%的TTC溶液对花粉进行染色,根据显色的程度不同可以判断花粉的生活力,红色越深表示花粉生活力越强。在载玻片上滴1~2滴0.5%的TTC溶液,把花粉轻轻撒入载玻片上的溶液中,轻轻晃匀。盖上盖玻片,在30 ℃培养箱中染色20 min。显色后即可观察计数。显色程度分为无色、粉色和红色。每个样本观察3个视野,每个视野有20粒以上的花粉,计数并统计各颜色花粉的数量及比例。花粉生活力=(染色花粉数/花粉总数)×100%
1.2.2 花粉萌发力测定
花粉萌发力测定通过人为创造适合花粉萌发的培养基条件,以花粉管的萌发情况来判定花粉管萌发力的强弱。花粉的萌发力受到硼酸、蔗糖等因素的影响,因此通过单因素试验设计分别对培养基蔗糖和硼酸(H3BO3)进行最适浓度筛选。以MS培养基为基础培养基,调节pH为5.8,最适蔗糖浓度筛选以含100 mg/L H3BO3的MS培养基为基底,并分别添加0、20、40、60、80和100 g/L蔗糖;最适硼酸浓度筛选以20 g/L蔗糖的MS培养基为基底,并分别添加0、50、100、150、200、250 mg/L H3BO3。
将采集的新鲜花粉均匀撒在MS培养基上,每处理设置3个重复。将培养基置于28 ℃培养箱中,暗培养4 h以上,直至花粉管长度稳定。使用光学显微镜观察计算花粉萌发数量,每组随机观察5个视野,计算萌发花粉数,统计花粉萌发力。花粉萌发力=(萌发花粉数/花粉总数)×100%。
1.2.3 甘草杂交方法
试验时间为2020年和2021年的6月—7月, 在无风无雨的天气下进行杂交。选择花朵未开放,雄蕊未成熟的花朵去雄,进行授粉、套袋,5 d后去袋,1个月后统计结荚量。试验材料为乌拉尔甘草(GDN-16)、胀果甘草(GJJ-7、GJJ-9)、光果甘草(S-7、S-12)。
2 结果和分析
2.1 胀果甘草GJJ-7、GJJ-9花粉生活力测定
2.1.1 花粉生活力
从图2可见,2个品种几乎所有的花粉都能被TTC染色,无色花粉粒多为发育不良的花粉,无生活力的花粉占比非常低,约为2.08%,说明这2个品种花粉的生活力都比较高,其中GJJ-7花粉生活力的变化趋势不稳定,在a~e时期呈现波浪型,以a、d时期最高;GJJ-9花粉生活力随着花瓣的展开而升高,在e时期达到最高。

图2 TTC法测定GJJ-7、GJJ-9的花粉生活力(A)和花粉颜色(B)。a~e为开花的5个时期。下同
2.1.2花粉萌发力
随着蔗糖浓度的升高,花粉萌发力越来越高,在100 g/L蔗糖时达到最高(图3: A),因此培养基最适蔗糖浓度为100 g/L。随着硼酸浓度的升高,花粉萌发力呈先升高后下降的变化趋势,GJJ-7花粉在硼酸浓度为200 mg/L时达到最高,但与150 mg/L硼酸时的萌发力差异不显著,而GJJ-9花粉在硼酸浓度为150 mg/L时达到最高(图3: B),因此将150 mg/L定为最适硼酸浓度,进行后续实验。
在含100 g/L蔗糖和150 mg/L硼酸的培养基中, GJJ-7和GJJ-9的花粉萌发力均在c时期最高,且花粉生活力随花朵开放程度增大呈先升高后下降的变化趋势,两种花粉在a~e时期的萌发力变化趋势一致,且GJJ-7的花粉萌发力比GJJ-9高(图3: C),这与TTC法测定结果不一致。
综合两种方法,认为c、d时期的花粉生活力较适合作为父本进行授粉,为甘草杂交时父本的选择提供参考。
2.2 杂交结荚率
由表1可见,同一物种分别作为父母本时,结荚率有明显差异。当GDN-16作为母本时,结荚率在30%以上;当其作为父本时,♀GJJ-7×♂GDN-16的结荚率最高,仅为16.67%;♀S-7×♂GDN16的结荚率为1.80%,♀S-12×♂GDN-16为6.91%;反交组合♀GDN16×♂S-7、♀GDN16×♂S-12结荚率最高, 分别达52.50%和47.58%,说明GDN-16更适合做母本,S-7和S-12则更适合作父本。但♀GJJ-9×♂S-7的结荚率为0,♀GJJ-9× ♂S-12为18.87%,这些组合的结荚率不高,说明不同种间的杂交亲和性也会影响结荚率。
我们还观察到,将GDN-16、GJJ-7、GJJ-9、S-12等进行套袋自交,自交花朵都无法结出果荚,少量结荚也是发育不良的果荚,无法收获种子。将S-7和S-12进行种内杂交的结荚率仅为11.86%,并且无法获得种子。而对GDN-16进行同株异花及异株异花自交均能正常结果,结荚率分别为46.67%和13.89%,但种子发育不良,无法收获正常的种子,说明甘草存在自交不亲和的现象,并且荚果的发育可能不需经过授精作用。
当杂交选用的父本均为c、d时期的花朵,杂交组合♀S-12×♂GJJ-7和♀GDN-16×♂GJJ-7的结荚率分别为23.53%和30.25%;杂交组合♀S-12×♂GJJ-9和♀S-7×♂GJJ-9的结荚率分别为36.78%和29.77%, 这与离体萌发法测定的GJJ-7和GJJ-9花粉生活力更为接近,因此离体萌发法测定的花粉生活力结果更为可靠。
2.3 杂交种子活力
对2020和2021年收获的杂交种子进行播种和发芽率测定,播种数为各杂交组合收获的种子数(表2)。组合♀S-12×♂GDN-16、♀S-7×♂GJJ-9和♀S- 7×♂S-12的种子发芽率最高,均达100%,组合♀S- 12×♂GJJ-9的发芽率也高达91.15%,说明这两种甘草的杂交种子活力较高,杂交亲和性也更高,且种间隔离机制不完善。但这3组杂交组合的结荚率均较低,说明S-12和S-7不仅适合作父本也适合作为母本,作母本时虽然结荚率低,但是种子饱满,发芽率高。而♀GDN-16×♂S-7的种子发芽率仅为1.89%,但杂交结荚率为52.50%;相似的,♀GDN- 16×♂S-12的种子发芽率仅为4.3%,但杂交结荚率高达47.58%,说明GDN-16作母本时虽然结荚率较高,但是种子发芽率低。因此母本的选择对于杂交种子的收获更为重要,选择合适的母本能够提高杂交种子产量和质量。此外,组合♀S-7×♂S-12能够收获饱满且正常发芽的种子,但是套袋自交却无法结实,说明光果甘草S-12和S-7能够进行种内杂交,但有自交不亲和的现象。

图3 离体萌发法测定GJJ-7、GJJ-9花粉生活力(A~C)和花粉在MS培养基上的萌发情况(D)
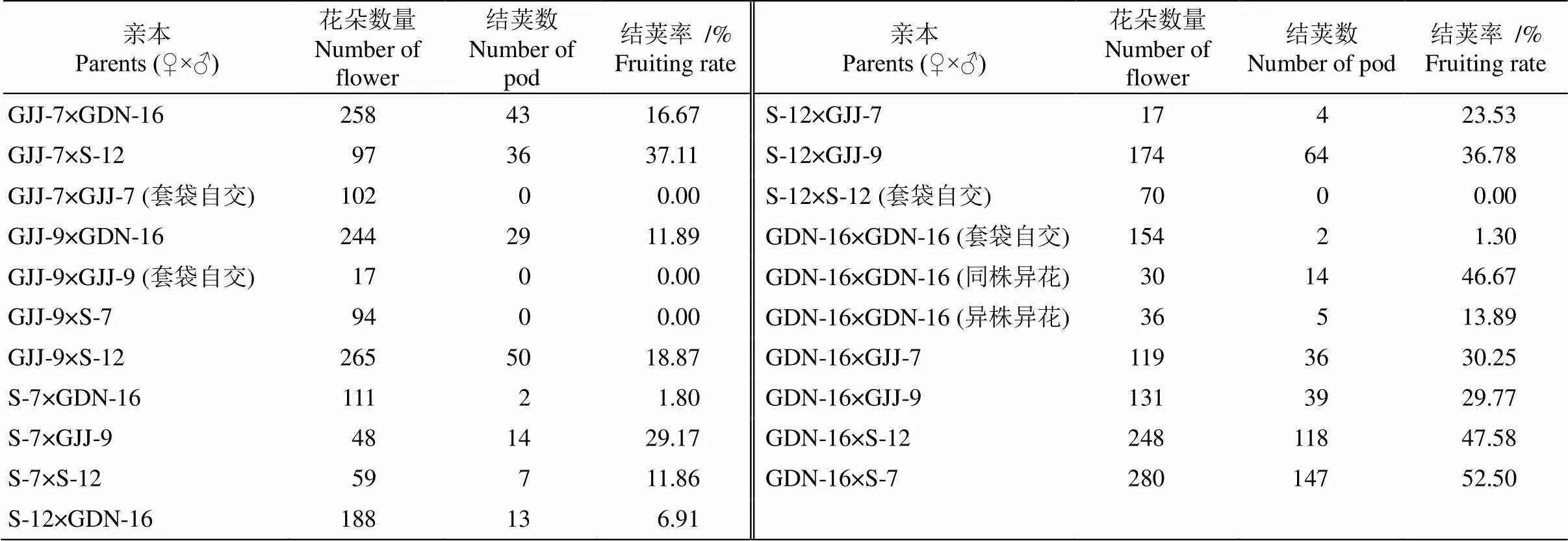
表1 甘草的杂交结果率
3 结论和讨论
采用TTC法与离体萌发法对GJJ-7、GJJ-9花粉生活力的测定结果不一致,离体萌发法表明a~e时期的花粉生活力呈先升高后下降的变化趋势,与乌拉尔甘草不同开放阶段的花粉生活力较为一致[14],也与本研究中的甘草杂交结荚率较为一致。TTC法有操作简单,成本低,能够大批量检测的优点,但其染色程度不易分辨,容易导致测定值偏高[15]。蔗糖和硼酸是影响花粉萌发力的重要因素,蔗糖能提供营养和所需碳源,硼酸能增加花粉管的萌发力,通过培养基模拟柱头环境能够更加准确的检测花粉的生活力,此外Ca2+、Mg2+、pH值、温度、水分、光照等都会影响到花粉管的萌发[16–21]。本研究中只筛选了蔗糖和硼酸的浓度,并且当蔗糖浓度超过100 g/L时,花粉萌发力仍有提高的可能,对于其他会影响到花粉管萌发的因素没有做深入的研究,因此本试验中离体萌发法测定的结果可能会偏低,但与后期杂交实验的结荚率相近且变化趋势一致,因此可认为离体萌发法对胀果甘草花粉活力的检测结果比TTC法更加可靠。
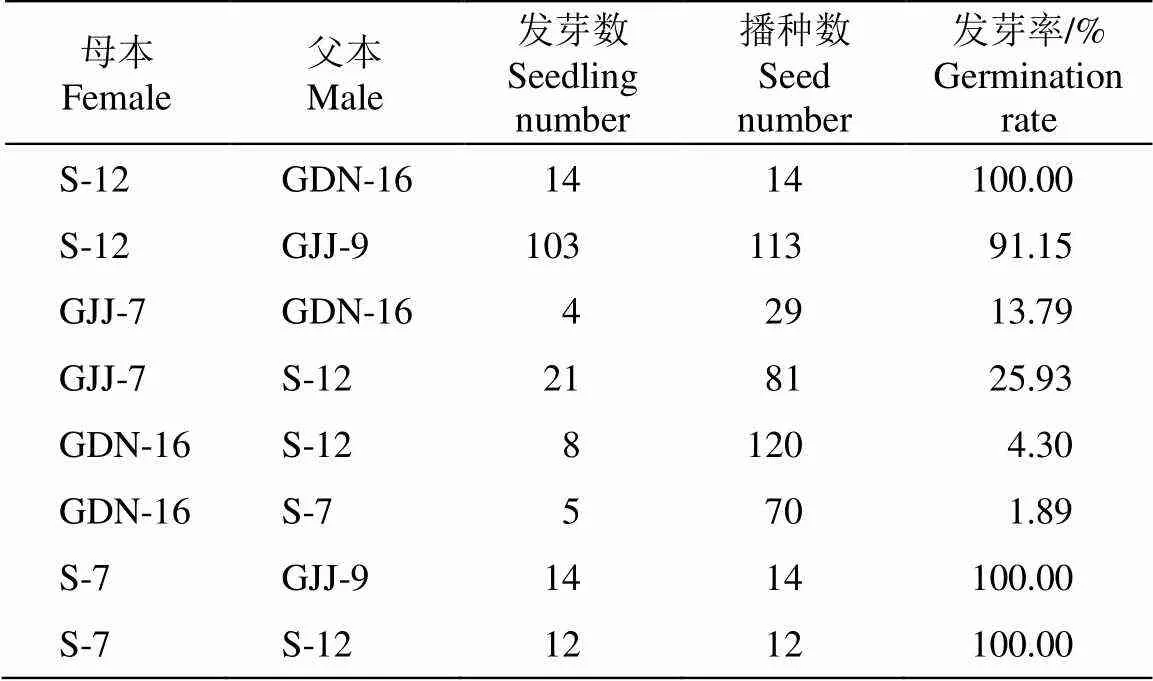
表2 杂交种子的发芽率
GDN-16作为母本的杂交结荚率最高,在田间自然结荚率也比较高,而且其花大,去雄时较为简单也是其较适宜作为母本的重要原因,但其种子的发芽率在本研究收获种子中最低,且多数发霉,这可能与其植株形态有重要的关系,GDN-16匍匐生长,果荚容易接触地面,而甘草地采取漫灌方式, 在浇水时果荚容易长时间浸泡在水中,进而易引起霉菌感染。而GJJ-7、GJJ-9、S-7、S-12直立生长, 能够避免果荚遭受水浸的情况,后续研究可通过抬高植株避免果荚浸水,减少种子的损失。S-7、S-12等的田间自然结荚率较高,但花小,杂交时作为母本的去雄操作较为困难,在去雄、授粉、套袋时也容易造成机械损伤,进而影响结荚率,但收获的种子较为饱满,且发芽率高,因此在能够避免机械损伤的情况下,S-7、S-12适合作为母本进行杂交。GJJ-7、GJJ-9的田间自然结荚率较低,且从自然结荚的果荚中收获的种子多数发育不良,仅有少数饱满的种子;而GDN-16经同株异花杂交和异株异花杂交均无法收获种子,但果荚仍能够发育,说明甘草果荚的发育可能不需要经过受精作用。
甘草具有虫媒传粉特性,传粉者多为蜂类,当传粉者的足部停在翼瓣和龙骨瓣上时,利用自身重量使得龙骨瓣打开,暴露出雌雄蕊后再由昆虫授粉[22]。然而,在花未开放时(b、c时期)花粉便已经附着在柱头上,这种行为模式更适合自交。但我们多次在GDN-16、GJJ-7、GJJ-9、S-7、S-12花开前套袋,1个月后无种子生成,可能存在自交不亲和现象,因此猜测在胀果甘草花柱中可能存在某种预防自交机制。组合♀S-7×♂S-12能够收获饱满种子并且正常发芽,但是各自套袋自交却无法结实,说明光果甘草S-12和S-7能够进行种内杂交,但同时有自交不亲和的现象。已有研究报道在显微镜下观察到乌拉尔甘草花柱头的可授性,在无外来花粉的情况下,自身雄蕊上的花粉能够萌发花粉管并进入胚珠中完成受精,证明其授粉方式属于闭花受精[23],但本研究中的乌拉尔甘草GDN-16品种并不能自交结实,说明授粉方式可能存在品种差异。而在田间试验中,张新玲等[24]报道乌拉尔甘草自交不亲和,本研究中除乌拉尔甘草GDN-16自交不亲和外,胀果甘草GJJ-7和GJJ-9、光果甘草S-7和S-12同样自交不亲和。异种花粉也能在柱头上萌发并且到达子房完成受精,但不同杂交组合的花粉管生长速度不一致,说明甘草属种间杂合亲和性较高,种间隔离机制不完全[25],这也与本研究中不同杂交组合的结荚率差异一致。
综上所述,TTC法和花粉离体萌发法对胀果甘草GJJ-7、GJJ-9花朵5个开放时期花粉生活力的测定结果存在差异,以花粉离体萌发法更加可靠。甘草种间正交和反交的结荚率存在明显差异,说明在甘草杂交中父母本的选择有助于提高结荚率。
通过测定甘草花朵不同开放程度时的花粉生活力,能够辅助杂交育种对于父本花朵的选择,提高杂交成功率。后续研究可通过杂交育种构建遗传群体后代,培育甘草新品种以及构建甘草遗传图谱,有助于甘草的遗传学研究、品种改良以及甘草资源的可持续利用。
[1] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China [M]. Beijing: China Medical Science Press, 2020. [国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020.]
[2] LI X J, XU W, SHAN W, et al. Breeding and demonstration promotion of ginseng new cultivar ‘Xinkaihe 1’ [J]. Ginseng Res, 2015, 27(4): 60–61. [李学军, 许伟, 单巍. 人参新品种‘新开河1号’选育及示范推广 [J]. 人参研究, 2015, 27(4): 60–61. doi: 10.19403/j.cnki.1671- 1521.2015.04.020.]
[3] WEI J H, YANG C M, SUI C, et al. New Chinese bellflower cultivars ‘Zhonggeng 1’, ‘Zhonggeng 2’ and ‘Zhonggeng 3’ developed by using the male sterile line [J]. Acta Hort Sin, 2011, 38(6): 1217–1218. [魏建和, 杨成民, 隋春, 等. 利用雄性不育系育成桔梗新品种‘中梗1号’、‘中梗2号’和‘中梗3号’ [J]. 园艺学报, 2011, 38(6): 1217– 1218. doi: 10.16420/j.issn.0513-353x.2011.06.003.]
[4] LIU J F, GAO S L, HUANG H P, et al. Allotetraploid induction and identification ofBunge and its hybridization breeding [J]. Pharm Biotechnol, 2009, 16(3): 260–264. [刘竟飞, 高山林, 黄和平, 等. 丹参杂交育种及其异源四倍体的诱导与鉴定 [J]. 药物生物技术, 2009, 16(3): 260–264. doi: 10.19526/j.cnki.1005-8915. 2009.03.018.]
[5] ZHENG T T, SUI C, WEI J H, et al. Breeding of new varieties ‘Zhong- chai No. 2’ and ‘Zhongchai No. 3’ of[J]. China J Chin Mat Med, 2010, 35(15): 1931–1934. [郑亭亭, 隋春, 魏建和, 等.北柴胡二代新品种“中柴2号”和“中柴3号”的选育研究 [J]. 中国中药杂志, 2010, 35(15): 1931–1934. doi: 10.4268/cjcmm20101503.]
[6] QU X J, WANG C, LIU C L. Research progress ofcultivation technology in recent ten years [J]. J Tianjin Univ Trad Chin Med, 2021, 40(1): 5–14. [曲雪洁, 王晨, 刘长利. 近十年甘草栽培研究进展 [J]. 天津中医药大学学报, 2021, 40(1): 5–14. doi: 10.11656/j.issn.1673-9043.2021.01.02.]
[7] FAROOQUI A, KHAN F, KHAN I, et al. Glycyrrhizin induces reactive oxygen species-dependent apoptosis and cell cycle arrest at G0/G1in HPV18+human cervical cancer HeLa cell line [J]. Biomed Pharma- cother, 2018, 97: 752–764. doi: 10.1016/j.biopha.2017.10.147.
[8] FUJISAWA Y, SAKAMOTO M, MATSUSHITA M, et al. Glycyrrhizin inhibits the lytic pathway of complement: Possible mechanism of its anti-inflammatory effect on liver cells in viral hepatitis [J]. Microbiol Immunol, 2000, 44(9): 799–804. doi: 10.1111/j.1348-0421.2000.tb02 566.x.
[9] GOWDA P, PATRICK S, JOSHI S D, et al. Glycyrrhizin prevents SARS-CoV-2 S1 and Orf3a induced high mobility group box 1 (HMGB1) release and inhibits viral replication [J]. Cytokine, 2021, 142: 155496. doi: 10.1016/j.cyto.2021.155496.
[10] SHEN B R. Clinical application of glycyrrhizin and its pharmaco- logical effect [J]. Occup Health, 2008, 24(16): 1697–1698. [沈宝荣. 甘草酸临床应用及药理作用 [J]. 职业与健康, 2008, 24(16): 1697– 1698. doi: 10.3969/j.issn.1004-1257.2008.16.053.]
[11] PENG L, AN Y R, HUANG T, et al. Pollen viability and stigma receptivity of[J]. Chin J Exp Trad Med Form, 2018, 24(13): 37–41. [彭亮, 安衍茹, 黄涛, 等. 黄芩花粉活力及柱头可授性分析 [J]. 中国实验方剂学杂志, 2018, 24(13): 37–41. doi: 10.13422/j.cnki.syfjx.20181045.]
[12] HUANG Z H, ZHU J M, MU X J, et al. Pollen dispersion, pollen viability and pistil receptivity in[J]. Ann Bot, 2004, 93(3): 295–301. doi: 10.1093/aob/mch044.
[13] KELEN M, DEMIRTAS I. Pollen viability, germination capability and pollen production level of some grape varieties (L.) [J]. Acta Physiol Plant, 2003, 25(3): 229–233. doi: 10.1007/s11738-003-0002-7.
[14] GAO S F, ZHANG Y H, CHEN H G, et al. Study on the flowering characteristics of[J]. China Pharm, 2016, 27(13): 1775–1777. [高素芳, 张延红, 陈红刚, 等. 乌拉尔甘草开花特性研究 [J]. 中国药房, 2016, 27(13): 1775–1777. doi: 10.6039/j.issn.1001- 0408.2016.13.13.]
[15] LI X F, LIN X C, SHI Y, et al. Flowering biological characteristics and pollen viability of[J]. China For Sci Technol, 2009, 23(6): 64–67. [李晓芬, 林新春, 时燕, 等. 紫竹开花生物学特性观察及花粉生活力测定 [J]. 林业科技开发, 2009, 23(6): 64–67. doi: 10.3969/j.issn.1000-8101.2009.06.017.]
[16] TANG Y W, LONG L Y, HUANG Q W, et al. Pollen germinationand cryopreservation reserch of[J]. Chin J Trop Crops, 2020, 41(7): 1380–1386. [唐毓玮, 龙凌云, 黄秋伟, 等. 澳系睡莲花粉离体萌发及低温保存研究 [J]. 热带作物学报, 2020, 41(7): 1380–1386. doi: 10.3969/j.issn.1000-2561.2020.07.013.]
[17] WU Y L, ZHAO C T, YI W Z, et al. Effect of pollen viability ofunder different culture media and storage conditions [J]. N Hort, 2015(5): 64–67. [吴月亮, 赵传统, 伊文芝, 等.不同培养基及贮藏条件对文冠果花粉生活力的影响 [J]. 北方园艺, 2015(5): 64–67. doi: 10.11937/bfyy.201505022.]
[18] YI S S, TAN C L, YANG G S, et al. Study on different varieties of pollen viability of[J]. Mol Plant Breed, 2016, 14(10): 2837– 2843. [易双双, 谭春丽, 杨光穗, 等. 朱槿不同品种花粉生活力的测定 [J]. 分子植物育种, 2016, 14(10): 2837–2843. doi: 10.13271/j. mpb.014.002837.]
[19] ZHANG L J, GUO C, QIN B T, et al. Phonological characteristics of flowering and pollen viability of[J]. J NE For Univ, 2019, 47(5): 4–8. [张丽杰, 果冲, 秦柏婷, 等. 胡桃楸开花物候特性及花粉生活力 [J]. 东北林业大学学报, 2019, 47(5): 4–8. doi: 10.3969/j.issn.1000-5382.2019.05.002.]
[20] ZHOU Q, YU G B, ZHU R, et al. Observation ofpollen morphology and determination of viability [J]. Mol Plant Breed, 2019, 17(19): 6506–6510. [周强, 于国斌, 朱瑞, 等. 樟子松花粉形态观察及生活力测定 [J]. 分子植物育种, 2019, 17(19): 6506–6510. doi: 10.13271/j.mpb.017.006506.]
[21] YAO W J, JIANG M Y, WANG X, et al. Biological analysis of flowering and pollen germination in‘Aureo- striatus’ [J]. J NE For Univ, 2020, 48(3): 13–18. [姚文静, 姜明云, 王星, 等. 黄条金刚竹开花生物学特性及花粉萌发力 [J]. 东北林业大学学报, 2020, 48(3): 13–18. doi: 10.3969/j.issn.1000-5382.2020.03. 003.]
[22] HAN C, LU J H, CHEN X C, et al. Preliminary study on position effect of inflorescence and seed production, and reproductive resource allo- cation model of five species inLinn. [J]. J Plant Resour Environ, 2016, 25(3): 72–79. [韩春, 陆嘉惠, 陈晓翠, 等. 5种甘草属植物花序和种子生产的位置效应及繁殖资源分配模式初步研究 [J]. 植物资源与环境学报, 2016, 25(3): 72–79. doi: 10.3969/j.issn.1674- 7895.2016.03.09.]
[23] MA C Y, QU P, WANG W Q. Identification of pollen ultrastructure and fluorescence microscope observation of pollen viability and stigma activity of liquorice [J]. J Plant Genet Resour, 2011, 12(3): 396–401. [马春英, 屈平, 王文全. 甘草花粉超微鉴定及花粉活力、柱头可受性荧光显微镜观察 [J]. 植物遗传资源学报, 2011, 12(3): 396–401. doi: 10.13430/j.cnki.jpgr.2011.03.015.]
[24] ZHANG X L, LI X Y, WEI L J, et al. The interspecific hybridization ofin Xinjiang [J]. Acta Bot Boreali-Occid Sin, 1998, 18(1): 135–139. [张新玲, 李学禹, 魏灵基, 等. 新疆甘草属的种间杂交 [J]. 西北植物学报, 1998, 18(1): 135–139.]
[25] XIE L B, LU J H, LI X L, et al. The cross compatibility and hybrid seed vigor among threespecies [J]. Plant Diver Resour, 2014, 36(3): 342–348. [谢良碧, 陆嘉惠, 李晓岚, 等. 三种甘草属植物的种间杂交亲和性及杂交种子活力 [J]. 植物分类与资源学报, 2014, 36(3): 342–348. doi: 10.7677/ynzwyj201413203.
Determination of Pollen Viability ofand Hybridization Study of Licorice
XIE Ziyan1,2,3, Botir Khaitov4, YANG Tianshun1,2, LI Zhong5, LI Yongqing1,2,3,6*, WANG Ying1,2,3,6*
(1. Key Laboratory of South China Agricultural Plant Molecular Analysis and Genetic Improvement & Guangdong Provincial Key Laboratory of Applied Botany, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China; 2. South China National Botanical Garden, Guangzhou 510650, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4. International Center for Biosaline Agriculture, Regional office for Central Asia and the Caucasus, Tashkent 100084, Uzbekistan; 5. Beryl Wolfberry Limited by Share Ltd., Yinchuan 750200, China; 6. Center of Economic Botany, Core Botanical Gardens, Chinese Academy of Sciences,Guangzhou 510650, China)
Hybridization is one of the traditional methods to breed new cultivars, pollen viability is important for the successful transmission of genetic material to generations.is one of the three licorice species recorded in Chinese Pharmacopoeia, with many specialized active compounds. In order to determine the optimal pollen development periods for licorice hybridization, the pollen viability of five bloom stages (a, b, c, d, and e) of twocultivars (GJJ-7 and GJJ-9) were measured by TTC staining andpollen germination methods. The result of TTC staining method showed that the pollen viability of GJJ-7 trended in a wave pattern and peaked at a and d stages. The pollen viability of GJJ-9 increased with the opening process of petals, and peaked at e stage. But the result ofpollen germination method showed that the pollen viability of both GJJ-7 and GJJ-9 was highest at c stage, which was consistent with fruiting rate in the hybridization, and further indicating the higher reliability of thegermination method compared with the TTC staining. Hybridization results of the three medicinal licorice species showed that a low fruiting rate but highest seed germination rate was obtained whencultivars S-7 and S-12 were used as the female parents. High fruiting rate but low seed germination rate was observed whencultivar GDN-16 was used as the female parent, indicating the importance of parent selection during licorice hybridization. These provides an important reference for improving the field hybridization efficiency of licorice.
Licorice, Pollen viability, Hybridization
10.11926/jtsb.4659
2022-04-22
2022-04-25
广州市科技计划项目(202002030442);广东省科技厅产业技术体系创新团队项目(2020KJ148)资助
This work was supported by the Project for Science and Technology Planning in Guangzhou (Grant No. 202002030442), and the Project for Modern Agriculture Industry Technology Innovation Teams of Department of Science and Technology of Guangdong (Grant No. 2020KJ148).
谢姿雁(1996年生), 女, 硕士研究生, 研究方向为药用植物分子遗传。E-mail: yan.574554015@qq.com
. E-mail: liyongqing@scbg.ac.cn; yingwang@scbg.ac.cn

