ZnFe2O4/TiO2纳米棒光催化剂的制备及其对甲基橙废水的脱色研究
王宇航
(陕西学前师范学院化学化工学院,陕西 西安 710100)
目前,光催化技术依赖于可见光或太阳能,且无二次污染,是降解有机染料的首选。相较于光催化剂P25,纳米尺度的TiO2具有较高的电子捕获能力,因而具有更高的光催化性能[1-4]。通过控制晶型、掺杂等手段可以提高 TiO2的光催化性能,但并不能从根本上有效抑制光生电子空穴复合,从而限制了其应用。
ZnFe2O4是一种常见的软磁体,具有较大的粒径和比表面积,作为光催化剂时吸附能力较强[5-7]。此外,ZnFe2O4的带隙为1.9 eV,可直接吸收可见光, 与TiO2复合后可在一定程度上抑制光生电子空穴复合,并赋予其磁性可回收能力[8-10]。鉴于此,作者采用水热法制备ZnFe2O4纳米粒子,在碱性条件下水解钛酸丁酯组装得到ZnFe2O4/TiO2纳米棒光催化剂,研究其对甲基橙废水的脱色效果。
1 实验
1.1 试剂与仪器
氨水、氯化铁(FeCl3·6H2O)、氯化锌(ZnCl2)、尿素、聚丙烯酰胺(PAM)、乙醇、柠檬酸钠、钛酸丁酯(TBOT)、聚乙烯吡咯烷酮(PVP)、P25(商品TiO2)、甲基橙,均为分析纯。
KQ-300DE型数控超声仪;DEF-6053型真空干燥箱;DHG-9140型电热恒温鼓风干燥箱;DK-98-1型电恒温水浴锅;YH-1型控温控速箱,实验室定制;PW3040/60型 X-射线衍射仪,荷兰Philips;JSM-6700F型扫描电子显微镜,日本电子株式会社;7307型振动样品磁强计,美国湖滨;UV-2501PC/2550型紫外可见分光光度计,日本岛津;TriStar Ⅱ 3020型N2吸附-脱附仪,美国迈克公司;PARSTAT 4000型电化学工作站。
1.2 ZnFe2O4 纳米粒子的制备
分别称取0.03 g FeCl3·6H2O、0.11 g ZnCl2和10.00 mmol柠檬酸钠溶解于适量蒸馏水中,在1.00 g尿素、0.60 g PAM作用下搅拌形成黏度较高的透明混合物;在200 ℃下进行水热反应,分离,洗涤,干燥,得到 ZnFe2O4纳米粒子。
1.3 ZnFe2O4/TiO2纳米棒光催化剂的制备
将ZnFe2O4纳米粒子、0.02 g PVP溶解于200 mL乙醇中,超声60 min;在氨水环境下将适量TBOT溶于乙醇中,于15 min内逐滴加入到上述混合液中,水解3 h,得到ZnFe2O4/TiO2前驱体;加入76 mL蒸馏水和4 mL氨水,置于聚四氟乙烯内衬中160 ℃反应24 h,即可组装得到ZnFe2O4/TiO2纳米棒光催化剂。
1.4 光催化活性的测定
分别称取 50 mg P25、ZnFe2O4/TiO2纳米棒,加入到100 mL初始浓度为50 mg·L-1的甲基橙溶液中,在黑暗环境中用紫外光照射;每隔一定时间取5 mL 溶液,离心后取上清液,采用紫外可见分光光度计测定吸光度;根据朗伯比尔定律A=abc(A为吸光度,a为吸光系数,b为比色皿厚度,c为溶液浓度)计算甲基橙浓度。 按式(1)计算吸附t时刻的甲基橙吸附量(qt,mg·g-1):
(1)
式中:c0为甲基橙的初始浓度,mg·L-1;ct为吸附t时刻溶液中甲基橙浓度,mg·L-1;V为甲基橙溶液的体积,L;m为吸附剂质量,g。
P25、ZnFe2O4/TiO2纳米棒在黑暗环境中吸附平衡后开始光降解反应,每隔一定时间从上口取上清液10 mL,离心;取上清液5 mL,摇匀,用紫外可见分光光度计测定505 nm处吸光度A(初始吸光度用A0表示)。 按式(2)计算脱色率(D):
(2)
2 结果与讨论
2.1 XRD分析(图 1)
由图1可知,与标准晶格参数理论值对比发现,ZnFe2O4纳米粒子的(220)、(311)、(400)、(511)和(204)晶面衍射峰与尖晶石型 ZnFe2O4(JCPDS No.01-1109)衍射峰完全一致,说明制得的ZnFe2O4晶型为尖晶石型[11]。ZnFe2O4/TiO2纳米棒的 (101)、(200)、(105)、(204)、(220)和(215)晶面衍射峰与锐钛矿型 TiO2(JCPDS No.21-1272) 衍射峰吻合[12],但部分特征峰不明显,可能是由于 TiO2包覆量较少,结晶度较低,晶相不完整。与 ZnFe2O4纳米粒子相比,ZnFe2O4/TiO2纳米棒的各个晶面的衍射峰强度降低, 证实TiO2的存在抑制了尖晶石型ZnFe2O4晶体的生长。此外,在ZnFe2O4/TiO2纳米粒子取向生长为棒状结构的过程中ZnFe2O4保持了尖晶石结构,而TiO2保持了锐钛矿结构,其晶型并未受到影响。
2.2 SEM 分析(图2)

图2 ZnFe2O4/TiO2纳米棒的低倍(a)和高倍(b)SEM照片
由图2可知,ZnFe2O4/TiO2取向生长为棒状结构,每条棒状结构由约5~6个ZnFe2O4/TiO2单一粒子组成。 ZnFe2O4/TiO2纳米棒的生长可归因于ZnFe2O4/TiO2纳米粒子本身的磁性,由于ZnFe2O4的磁性较强,在外层水解TBOT的过程中,其依靠自身磁性彼此靠近, 有助于形成棒状结构;此外,TBOT在氨水环境下可快速水解与沉积,加速TiO2晶体的成核[13-14],最终导致其组装生长为棒状结构。
2.3 VSM 分析(图3)
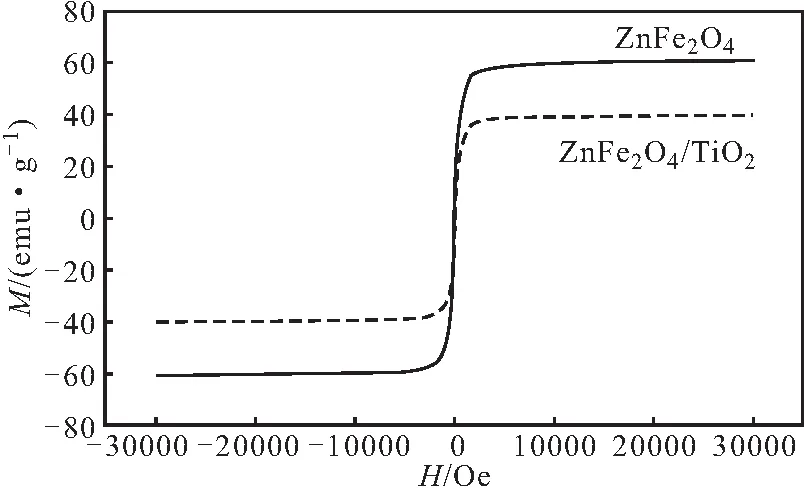
图3 ZnFe2O4 纳米粒子和ZnFe2O4/TiO2纳米棒的磁滞回线
由图3可知,ZnFe2O4经过初级粒子的堆积, 具有较高的比饱和磁化强度,达60.0 emu·g-1;ZnFe2O4纳米粒子经TiO2包覆并组装生长为棒状结构后,ZnFe2O4/TiO2纳米棒的比饱和磁化强度为40.0 emu·g-1。在-1 000~1 000 Oe的磁滞回线范围内,ZnFe2O4纳米粒子和ZnFe2O4/TiO2纳米棒两条曲线对应的磁矫顽力几乎都可以忽略,表明ZnFe2O4纳米粒子和ZnFe2O4/TiO2纳米棒都具备超顺磁特性。ZnFe2O4作为一种软磁体,包覆TiO2形成棒状结构后仍然可在外界磁场诱导环境下快速响应,使其作为光催化剂时,具有良好的可回收性[15]。
2.4 N2 吸附-脱附分析(图4)

图4 ZnFe2O4/TiO2纳米棒的N2吸附-脱附曲线
由图4可知,ZnFe2O4/TiO2纳米棒的等温曲线为 Langmuir Ⅳ型,即开始发生毛细凝结时是在孔壁上的环状吸附膜液面上进行,而脱附是从孔口的球形弯月液面开始,吸附与脱附等温线不重合,在相对压力为 0.5~0.9 之间形成滞后环。说明 ZnFe2O4/TiO2纳米棒的内部孔道为介孔结构,在作为光催化剂使用时,对有机污染物具有明显的吸附效果[16]。
2.5 电化学阻抗测试
以Fe(CN)6为电解液,对ZnFe2O4纳米粒子和ZnFe2O4/TiO2纳米棒进行电化学阻抗测试,结果如图5所示。

图5 ZnFe2O4纳米粒子和ZnFe2O4/TiO2纳米棒的电化学阻抗谱
由图5可知,与 ZnFe2O4纳米粒子相比,ZnFe2O4/TiO2纳米棒具有较小的电弧半径,导电性较好,电荷传导阻力小[17-18]。此外,ZnFe2O4/TiO2纳米棒能显著抑制光生电子空穴复合。以ZnFe2O4/TiO2纳米棒作为光催化剂,可很大程度改善ZnFe2O4单一光催化剂光生电子穴穴易复合的问题。
2.6 ZnFe2O4/TiO2纳米棒的光催化活性
ZnFe2O4/TiO2纳米棒具有介孔结构,因此在光催化降解前,首先在黑暗环境下进行吸附实验,结果如图 6 所示。
由图6可知,P25和ZnFe2O4/TiO2纳米棒在黑暗环境下,60 min均达到了吸附平衡,但两者对甲基橙的吸附能力不同;由于ZnFe2O4/TiO2纳米棒具有介孔结构,展现出更高的吸附能力,平衡吸附量可达15 mg·g-1。

图6 P25和 ZnFe2O4/TiO2纳米棒对甲基橙的吸附曲线
P25和ZnFe2O4/TiO2纳米棒对甲基橙废水的脱色率随光照时间的变化曲线如图7所示。

图7 脱色率随光照时间的变化曲线
由图7可知,紫外光照射120 min,P25对甲基橙废水的脱色率达到 92%,而ZnFe2O4/TiO2纳米棒对甲基橙废水的脱色率达到 99%。
2.7 ZnFe2O4/TiO2纳米棒的重复使用性能(图 8)
由图8可知,重复使用10 次后,ZnFe2O4/TiO2纳米棒对甲基橙废水的脱色率依然保持在 85%以上。说明 ZnFe2O4/TiO2纳米棒的结构稳定,在外界磁场的诱导下回收率高, 重复使用性能良好[19-20]。

图8 ZnFe2O4/TiO2纳米棒的重复使用性能
3 结论
采用水热法制备了ZnFe2O4纳米粒子,在碱性条件下水解钛酸丁酯组装得到 具有介孔结构的ZnFe2O4/TiO2纳米棒光催化剂, 具有电化学阻抗小、比饱和磁化强度高等优势。紫外光照射 120 min 后,ZnFe2O4/TiO2纳米棒对甲基橙废水的脱色率高达 99%;且重复使用10次后,脱色率依然保持在 85%以上。表明该复合材料具有良好的磁响应性,是一种可高效回收且重复使用的新型光催化剂。
——潘桂棠光生的地质情怀

