缢蛏(Sinonovacula constricta)耐氨氮关联SNP 验证及相关基因NKA 在氨氮胁迫下的表达特征分析*
胡晨馨 吕丽媛 孙改改,3 姚韩韩 林志华,① 董迎辉①
(1.浙江万里学院生物与环境学院 浙江省水产种质资源高效利用技术研究重点实验室 浙江宁波 315100; 2.浙江万里学院宁海海洋生物种业研究院 浙江宁波 315604; 3.宁波大学海洋学院 浙江宁波 315832)
氨氮是水环境中常见的非生物胁迫因子之一,当水生动物体内氨氮积累到一定程度时会导致组织受损和退化、离子调节失衡、氧化应激、炎症反应、生长减缓和高死亡率(Renet al, 2014; Chenget al,2015; Zhanget al, 2018)。水环境中的氨氮主要有离子态氨(N)和非离子态氨(NH3)两种形式, 二者可以相互转化, 并处于动态平衡, 机体内的氨氮大多以N的形式存在(付莹等, 2018)。由于NH+4脂溶性极低且可与水结合形成水合离子, 不易透过细胞膜, 因此水生动物机体内的大多数氨氮的跨膜运输是通过各种转运蛋白来实现的(Weineret al, 2019)。细胞外的氨氮主要通过铵转运体(AMT)和Rhesus (Rh)糖蛋白促进扩散, 也可由 K+转运蛋白如 Na+/K+-ATP 酶(NKA)、Na+-K+-2Cl 共转运蛋白(NKCC)和K+通道蛋白(KCN)等进行跨膜运输(Tresguerreset al, 2020)。有研究表明, 钠氢交换蛋白(NHE)、囊泡相关蛋白(VAMP)以及水通道蛋白(AQP)家族的某些成员也可能参与氨的跨膜转运(Walker, 2014)。总之, 水生动物具有非常复杂的氨氮运输调控网络, 而NKA 是参与氨排泄的重要通道之一。
NKA 是一种重要的阳离子泵蛋白, 由α 亚基、β亚基及调节亚基组成, 其中α 亚基包含阳离子、核苷酸以及配体结合位点(Caoet al, 2021)。NKA 可以在ATP 和Mg2+的催化下转运Na+和K+, 从而控制细胞质膜上的Na+、K+浓度梯度, 维持细胞内外液的渗透压(Čechováet al, 2016)。此外, 由于NH4+在水溶液中具有与K+几乎相同的物理特性, 因此NH4+可以取代K+通过NKA 进行跨膜运输(Tresguerreset al, 2020)。目前, 在印度囊鳃鲇(Heteropneustes fossilis) (Chewet al, 2020)、龟壳攀鲈(Anabas testudineus) (Ipet al,2012)、首长黄道蟹(Metacarcinus magister) (Martinet al, 2011)、岸蟹(Carcinus maenas) (Fehsenfeldet al,2016)、克氏原螯虾(Procambarus clarkii) (Shenet al,2021)、鳞砗磲(Tridacna squamosa) (Ipet al, 2015)和秀丽隐杆线虫(Caenorhabditis elegans) (Adlimoghaddamet al, 2015)等多种动物中已证明NKA 参与氨氮的排泄过程。
近年来, 随着贝类基因组信息的丰富、高通量单核苷酸多态性(SNP)芯片的开发以及基因分型技术的快速发展, 全基因组关联分析(genome-wide association study, GWAS)已广泛应用于贝类生长、抗逆和品质等重要经济性状的遗传位点鉴定。例如, 利用GWAS 技术, 在虾夷扇贝(Patinopecten yessoensis)中筛选出了2 个与生长显著关联的SNP 位点(Ninget al, 2019), 在皱纹盘鲍(Haliotis discus hannai)中发掘了27 个与耐高温性状相关的遗传标记(Menget al,2020), 在长牡蛎(Crassostrea gigas)中定位了一批与脂肪酸、糖原、锌等营养性状相关的SNP(Shiet al,2020)。在耐氨氮关联SNP 研究方面, Xu 等(2019)已用GWAS 分析在斜带石斑鱼(Epinephelus coioides)中鉴定出25 个与耐氨氮性状相关的SNP 及7 个候选基因; Lv 等(2023)利用GWAS 分析在缢蛏(Sinonovacula constricta)中鉴定出11 个与耐氨氮性状显著相关的SNP 位点, 并进一步发掘了5 个关联候选基因, 包括NKA、β-半乳糖苷酶(GLB1)、四肽重复蛋白 28(TTC28)、微管蛋白β (TUBB)和真核翻译延伸因子1a(eEF1A)。GWAS 关联的SNP 位点和候选基因作为重要的遗传标记, 对进一步研究氨氮耐受的分子调控机制和基因组选择育种具有重要意义。
缢蛏是我国重要的海水养殖贝类, 是虾(蟹)-贝混养模式的主要养殖种类, 该养殖系统中的大量残饵、粪便等有机废物会增加底泥中的氨氮含量, 而缢蛏是一种典型的底栖穴居双壳贝类, 其面临的氨氮环境尤为严峻(Conget al, 2021; 柴欣如等, 2022)。已有大量研究表明, 缢蛏机体对于过量的氨存在特定的解毒方式和代谢途径(陈凯锋等, 2020; 张欢等,2020; Sunet al, 2021; Lvet al, 2022)。本研究对课题组前期通过全基因组关联分析获得的与氨氮耐受性状显著关联的SNP 位点(g.21062868T>A)进行了验证,并开展了位点关联基因NKA的时间表达谱和蛋白组织定位分析, 探究氨氮胁迫下NKA基因在缢蛏鳃中的表达特征, 同时通过检测NKA基因干扰后NKCC1基因的mRNA 表达量及血淋巴氨浓度, 探讨NKA 在缢蛏氨氮排泄中发挥的作用, 为深入研究NKA 在贝类氨氮解毒过程中的功能及调控机制奠定理论基础。
1 材料与方法
1.1 实验材料
从宁波市海洋与渔业科技创新基地采集健康的1龄缢蛏[湿重(15.38±1.84) g, 壳长(59.36±2.52) mm],实验前暂养7 d, 海水盐度为20±1, pH 值为8.1±0.1,温度为(19.4±0.4) °C。每12 h 更换1/2 海水, 每天08:00 和18:00 投喂小球藻(Chlorella vulgaris)。
1.2 氨氮胁迫实验
在进行氨氮胁迫实验前, 先随机取6 颗缢蛏的鳃、肝胰腺、肠、足、外套膜、水管和闭壳肌, 液氮速冻后保存于–80 °C 超低温冰箱中, 用于组织表达分析。参考Zhang 等(2020)缢蛏氨氮急性胁迫96 h 的半致死浓度(LC50-96 h), 以氨氮浓度180 mg/L 作为实验组, 并设置对照组(正常海水)。每组120 颗缢蛏, 设置三个平行, 即每个平行40 颗。分别在实验开始后0、3、6、12、24、48、72 和96 h 随机采集6 颗缢蛏, 取其鳃, 液氮速冻完全后, 保存于–80 °C 超低温冰箱中,用于实时荧光定量PCR (qRT-PCR)和蛋白免疫印迹(western blotting, WB)检测。在胁迫96 h 时, 分别从两组中取6 颗缢蛏, 剪取鳃组织进行常规石蜡切片和NKA 蛋白组织定位研究。
1.3 耐氨氮性状关联SNP 位点的验证
选取180 mg/L 作为缢蛏氨氮胁迫实验的浓度,每2 h 对死亡个体进行采样, 实验共持续180 h, 取150 颗最早死亡的个体(氨氮敏感组, SG, 18~96 h)和死亡率到达约80%时剩余的150 颗存活个体(氨氮耐受组, TG, 180 h)的足经液氮速冻后储存在-80 °C 超低温冰箱中。使用海洋动物组织基因组DNA 提取试剂盒(TIANGEN, 北京)提取总DNA, 通过1%琼脂糖凝胶电泳检测DNA 的完整性, 并使用Nano Drop2000分光光度计(Thermo Fisher Scientific, 美国)检测DNA 浓度。
利用竞争性等位基因特异性PCR (KASP)分析技术进行基因分型。使用PolyMarker 设计SNP 位点(g.21062868T>A) 的 KASP 引 物 (http://www.polymarker.info/)并由生工生物工程(上海)股份有限公司合成(表1)。使用384 孔板进行KASP 测定, 反应体系为10 μL, 包括5 μL FLu-Arms 2×PCR 混合物、0.5 μL KASP 引物混合物、1 μL 基因组DNA (浓度为20 ng/μL)和3.5 μL 去离子水。PCR 程序在LightCycler®480II PCR 仪(Roche, 瑞士)中进行, 每次运行均包括非模板对照(NTC)。反应程序为: 94 °C, 15 min; 94 °C,20 s, 61 °C, 1 min, 共10 个循环; 94 °C, 20 s, 55 °C,1 min, 共26 个循环。PCR 扩增后使用Intellics 软件(LGC Douglas Scientific, 美国)读取每个样本的基因型。

表1 本实验所用引物及其序列Tab.1 Primers and their sequences used in this study
1.4 qRT-PCR 分析
使用Trizol 法提取总RNA, 1%琼脂糖电泳检测其完整性, 使用Nano Drop2000 分光光度计(Thermo Fisher Scientific, 美国)检测 RNA 浓度。使用PrimeScript®RT reagent kit with gDNA eraser (TaKaRa,日本)合成cDNA。根据本实验室缢蛏基因组数据库中的NKA(GenBank 登录号: MN052993.1)、NKCC1(GenBank 登录号: OQ244851)以及 18S ribosomal RNA (18S) (GenBank 登录号: AY695800.2)基因序列(Donget al, 2020), 通过Primer Premier 5.0 软件设计PCR 引物(表1), 并由生工生物工程(上海)股份有限公司合成。每对引物在进行荧光定量前都通过普通PCR 验证。使用LightCycler®480II PCR 仪(Roche, 瑞士)进行qRT-PCR 反应, 总体系为20 μL, 包括cDNA和ddH2O 共8 μL, 10 µmol/L 上下游引物各1 μL,2×ChamQ Universal SYBR qPCR Master Mix (Vazyme,南京) 10 μL。反应程序为: 95 °C 预变性10 min, 95 °C 10 s, 60 °C 退火1 min, 循环40 次, 72 °C 延伸7 min,运行结束后对PCR 产物进行溶解曲线分析, 确保只有单一的PCR 产物得到扩增。选择18S基因作为内参基因(表1), 用2–ΔΔCt法计算缢蛏NKA 基因(Sc-NKA)的相对表达量(Sunet al, 2022)。
1.5 Sc-NKA 多克隆抗体制备及氨氮胁迫后Sc-NKA蛋白免疫印迹检测
根据Sc-NKA基因序列设计引物(表1), 扩增开放阅读框(ORF)区域。将获得的 PCR 产物连接到pET-32A(+)质粒(TaKaRa, 日本), 构建含有His-tag 的融合蛋白表达重组质粒 pET-32A-Sc-NKA。将阴性pET-32A 质粒和阳性重组质粒分别转化到大肠杆菌(Escherichia coli) Rosetta (DE3)进行原核蛋白表达,挑选阳性菌体接种至含抗生素的LB 液体培养基中,37 °C 振荡培养过夜。使用1 mmol/L IPTG 在37 °C下诱导4 h, 收集诱导表达后的菌体重悬并超声, 利用Ni-NTA 树脂对蛋白进行纯化。随后将抗原与等体积的佐剂完全乳化后对新西兰白兔进行多点皮下注射。采集全血后进行抗体纯化和ELISA 测定效价, 并将制备好的抗体保存于–20 °C 冰箱中。
利用RIPA 裂解液(碧云天, 上海)裂解缢蛏鳃组织, 通过总蛋白定量测定试剂盒(南京建成)测定各样品的蛋白浓度, 并用裂解液稀释到同样浓度, 加入5×loading buffer 沸水煮沸10 min。配置合适浓度的凝胶(12%分离胶和 5%浓缩胶), 等量上样后进行SDS-PAGE 电泳, 将凝胶中含有的目标蛋白转移到PVDF 膜上(60 mA, 3 h), 利用TBST 溶解的10%脱脂奶粉室温下封闭1 h。然后分别利用兔抗Sc-NKA 多克隆抗体(HuaBio, 杭州, 1︰500 比例稀释)和兔抗GAPDH 多克隆抗体(上海生工, 1︰3 000 比例稀释)在4 °C 下孵育过夜, 再用HRP 标记的驴抗兔IgG 在室温下进行二抗孵育(上海生工, 1︰2 000 比例稀释)1 h。最后, 将增强化学发光液(ECL)滴加至PVDF 膜上, 在凝胶成像系统(Bio-Rad, 美国)下观察和拍摄图像。以GAPDH 作为内参蛋白, 利用ImageJ2 软件对结果进行灰度值计算(Sunet al, 2022)。
1.6 Sc-NKA 蛋白免疫荧光检测
鳃样品用 4%多聚甲醛固定, 然后在梯度乙醇(50%、70%、80%、90%、100%)中脱水, 置于二甲苯中透明, 石蜡包埋切片(厚度为4 µm)。将烤片后的组织切片用二甲苯脱蜡, 梯度乙醇复水, 置于0.01 mol/L 柠檬酸钠溶液中进行抗原修复; 用5%牛血清白蛋白(BSA,生工生物工程, 上海)室温封闭1 h, 甩干后滴加兔抗Sc-NKA 多克隆抗体(HuaBio, 杭州, 1︰400 比例稀释)于4 °C 湿盒中孵育过夜; 滴加FITC 标记的驴抗兔IgG二抗(1︰150 比例稀释)室温避光孵育1 h; 滴加DAPI染色液(碧云天, 上海)对细胞核进行染色, 在Eclipse 80i 荧光显微镜(Nikon, 日本)下观察并拍摄鳃组织。
1.7 RNA 干扰实验
Sc-NKA和阴性对照(NC, 非特异性的siRNA 对照)的siRNA 序列由生工生物工程(上海)股份有限公司制备(表1, 利用无 RNase 水将干扰链配制成0.22 μg/μL。将240 颗缢蛏随机分为氨氮胁迫组(AG,180 mg/L)和对照组(CG, 正常海水), 使用50 μL 微量进样器将siRNA-NKA干扰链、NC 链及无RNase 水(空白对照) 18.45 μL 分别注射到两组40 颗缢蛏的闭壳肌中。在注射后0、6、12、24 和48 h 随机收集各缸中6 颗缢蛏, 采集其鳃和血淋巴用于qRT-PCR 检测和血氨浓度测定。
1.8 血氨浓度测定
依据血氨测定试剂盒(A086-1-1, 南京建成)说明书检测样品反应后的吸光值。其原理主要是用蛋白质沉淀剂将血清中的蛋白沉淀以抑制酶活性, 防止游离氨产生, 并去除大部分干扰呈色的物质。通过Berthelot 反应在630 nm 处测定吸光值, 与标准溶液比较计算血淋巴中的氨浓度。根据公式计算样品中的血氨浓度:
1.9 数据分析
使用SPSS 26.0 软件进行单因素方差分析(ANOVA),P<0.05 表示差异显著,P<0.01 表示差异极显著,所有实验数据均以平均值±标准差(SD)表示。用卡方(χ2)检验计算SNP 位点在SG 组和TG 组间基因型频率的差异。使用GraphPad Prism 8.0 软件进行绘图。
2 结果
2.1 耐氨氮性状关联SNP 位点的验证与分析
应用KASP 分析方法在验证群体中对SNP 位点(g.21062868T>A)进行基因分型, 并与缢蛏耐氨氮性状进行关联分析, 分别在TG 组和SG 组中检测到148和150 个荧光信号。分析结果表明, 该SNP 位点存在3 种基因型, 其中纯合子TT 为优势基因型, 在TG 组有92 个个体, SG 组有74 个个体, 在两组中的基因型频率分别为62.16%和49.33%; 杂合子TA 在TG 组有18 个个体, SG 组有37 个个体, 在两组中的基因型频率分别为12.16%和24.67%; 纯合子AA 在TG 组有38 个个体, SG 组有39 个个体, 在两组中的基因型频率分别为25.68%和26.00%。对TG 组和SG 组的基因型频率进行卡方检验后发现, 该SNP 位点在两组间差异显著(P<0.05) (表2)。

表2 TG 和SG 组SNP 基因型频率的比较Tab.2 Comparison in genotype frequency of the SNP between the TG and SG groups
2.2 Sc-NKA 基因对氨氮胁迫的响应
利用qRT-PCR 和WB 技术检测了Sc-NKA基因在缢蛏不同组织中的表达量以及在氨氮胁迫下鳃中mRNA 和蛋白的表达水平。结果显示,Sc-NKA基因在鳃、肝胰腺、肠、足、外套膜、水管和闭壳肌中均有表达, 且在鳃组织中的表达量最高(P<0.05), 其次是肠和肝胰腺, 在外套膜、闭壳肌和足中的表达量最低(图1a)。在180 mg/L 的高氨胁迫后, 鳃中Sc-NKA基因mRNA 表达水平在6~48 h 相比0 h 显著升高(P<0.05), 总体呈现先升高后降低的趋势, 且在24 h达到最大值, 约为0 h 的2 倍(图1b)。通过对Sc-NKA蛋白印迹灰度值分析发现, WB 的结果与qRT-PCR 基本一致(图1c)。

图1 缢蛏Sc-NKA 基因的组织表达分析及在氨氮胁迫下鳃中mRNA 和蛋白的表达变化Fig.1 Expression of Sc-NKA in different tissues and the mRNA and protein expression in the gill of S. constricta under ammonia stress
2.3 Sc-NKA 蛋白的组织细胞定位
缢蛏的鳃丝由单层上皮细胞(柱状细胞和扁平细胞)以及其围绕的血腔组成。DAPI 染色显示, 鳃组织纤毛处含有大量排列整齐的单层柱状细胞, 而靠近鳃内腔的约一半区域为扁平细胞。免疫荧光结果显示,Sc-NKA 在鳃组织的柱状细胞和扁平细胞中均有表达(FITC 绿色荧光信号), 且其在柱状细胞中的荧光信号强于其他部位。同时, 与CG 组相比, TG 组表现出更强烈的阳性信号(图2)。
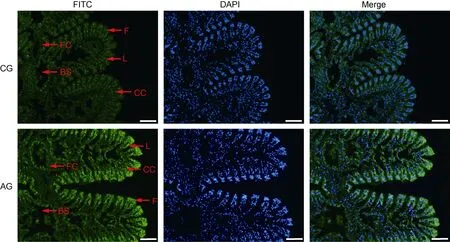
图2 缢蛏鳃组织Sc-NKA 蛋白的免疫荧光分析Fig.2 Immunofluorescence of Sc-NKA in the gill
2.4 Sc-NKA 基因RNA 干扰对NKCC1 基因表达和血氨含量的影响
利用RNAi 技术检测了Sc-NKA基因表达受到抑制后对NKCC1基因表达和血氨含量的影响。qRT-PCR 结果表明, 注射siRNA-NKA干扰链6、12、24 和48 h 后, AG 组和CG 组Sc-NKA的mRNA 表达水平显著下调(P<0.05), 其中AG 组干扰效率分别为23%、84%、83%和80%, CG 组分别为33%、78%、85%和79% (图3a, 3b)。对Sc-NKA基因的干扰影响了Sc-NKCC1的mRNA 表达水平。在12~48 h, AG 和CG 两组中siRNA-NKA实验组的Sc-NKCC1表达量相较阴性和空白对照组均显著降低(P<0.05), 其中AG组在12、24 和48 h 分别下降37%、99%和99%, CG组分别下降44%、80%和95%。同时, 整个干扰实验期间siRNA-NKA实验组的Sc-NKCC1mRNA 表达水平总体呈现下降趋势, 与Sc-NKA的表达量变化趋势一致(图3c, 3d)。

图3 RNAi 后鳃组织中Sc-NKA 和Sc-NKCC1 基因mRNA 相对表达量和血氨浓度的变化Fig.3 Relative expression of Sc-NKA and Sc-NKCC1 gene in the gill and ammonia concentration in the hemolymph after RNAi
使用血氨测定试剂盒测定Sc-NKA基因RNAi后缢蛏血淋巴中的氨浓度。结果表明, AG 组和CG组的siRNA-NKA实验组中血氨浓度在6~48 h 均显著高于阴性和空白对照组(P<0.05), 其中 AG 组血氨浓度在48 h 达到最大值(5 163.16 μmol/L), 约为对照组的2.32 倍; CG 组血氨浓度在6 h 达到最大值(161.03 μmol/L), 约为对照组的1.23 倍(图3e, 3f)。此外, 在实验期间, 阴性和空白对照组的上述指标之间均没有显著差异(P>0.05) (图3a~3f)。
3 讨论
氨氮是水产养殖环境中最常见的胁迫因子之一,氨氮水平的升高是水生动物健康和生命的主要威胁(Zhaoet al, 1997; Harriset al, 2001)。氨氮浓度过高会对机体产生多种危害, 因此需要将其转化成毒性较小的分子或迅速排出, 以避免有害物质在体内积聚(Larsenet al, 2014)。缢蛏作为一种底栖滤食性贝类,经常面临高浓度的氨氮环境, 是研究氨氮解毒分子机制的重要模式物种(Penget al, 2016)。本课题组Lv等(2023)对缢蛏耐氨氮性状进行了GWAS 分析, 发现了一个位于NKA基因(Chr8: 21038162-21054270)下游8.6 kb 基因间区内的显著性SNP 位点(g.21062868T>A)(P<0.05), 本实验通过KASP 技术验证了其与缢蛏氨氮耐受性状之间存在显著关联(P<0.05), 推测该SNP可能通过影响与其相邻的NKA基因的表达参与氨氮胁迫下的调控过程。近年来, 许多研究表明, 基因间区包含非编码RNA 如miRNA、rRNA、snRNA 和tRNA等尚未鉴定的重要功能元件(Hesset al, 2007; Zhonget al, 2014; Caiet al, 2016; Kanwalet al, 2019)。基因间区含有的增强子DNA 序列可以控制相距几千个碱基对以上的离散基因的表达(Ingvarssonet al, 2016;Bakhtiarizadehet al, 2018)。这一发现也在水产动物中得到广泛验证, 如在对刺参(Apostichopus japonicus)疣足数量进行GWAS 分析中, 筛选并验证了与PATS1基因相邻的位于基因间区的显著性SNP 位点, 证明其在细胞生长和增殖中的重要作用(Zhuet al, 2022);在对长牡蛎脂肪酸品质性状的GWAS 分析中, 选取了7个与不饱和脂肪酸含量显著相关的SNP 位点, 这些位点均位于基因间区, 最后通过分析与这些SNP 相邻的NFYA基因的mRNA 表达水平等方式证明该基因可能参与调控牡蛎饱和脂肪酸代谢(史瑞辉, 2020)。
研究表明, 绝大多数水生生物, 包括两栖动物、硬骨鱼和大多数无脊椎动物的大部分含氮废物都是直接以NH4+的形式排出, 这是因为NH3在水环境中很容易转化为NH4+并通过离子转运系统由鳃排泄到体外(Cragget al, 1961; Woodet al, 1989; Wright, 1995;Weihrauchet al, 2009; Wrightet al, 2009)。水生动物的鳃是一个多功能器官, 是进行多种生理过程的场所,包括氨排泄、离子转运、酸碱平衡和气体交换等(涂翰卿等, 2019)。作为离子调节系统中的重要成员,NKA 通常在鳃中发挥作用(Henryet al, 2012)。在对遮目鱼(Chanos chanos)鳃中的NKA 蛋白进行免疫荧光检测后发现, NKA 位于鳃上皮细胞的基底外侧膜上(Tanget al, 2011)。同样, 在黑小鲵(Hynobius nigrescens)的鳃扁平细胞和富含线粒体的细胞基底外侧膜上观察到了NKA 的免疫阳性反应(Uchiyamaet al, 2011)。本研究发现, NKA 定位于缢蛏鳃的扁平细胞与柱状细胞中, 与参与渗透调节的水通道蛋白(AQP)在鳃中的定位结果较为一致(Ruanet al, 2022)。此外, 氨氮胁迫后的NKA 阳性信号较未胁迫的对照组明显更强, 且高氨胁迫下鳃中NKA基因的mRNA和蛋白表达水平均有显著上调(P<0.05), 这一现象在印度囊鳃鲇(Chewet al, 2020)和龟壳攀鲈(Ipet al,2012)中也有发现, 表明NKA对氨氮刺激具有明显的响应。在亚致死氨氮浓度(1.5 mg/L 和3 mg/L)胁迫下菲律宾蛤仔(Tapes philippinarum)鳃中的NKA 酶活性明显增强(P<0.05), 且用相同浓度的K+或NH+4进行体外实验时, NKA 均受到最大程度的激活, 表明NH+4可以替代K+从而被NKA 运输(Pagliaraniet al,2008)。暴露于高氨下,NKA基因的高表达可能是调节机体对氨氮应激的适应性反应: NKA 可以像结合K+一样结合NH+4, 然后直接将其从细胞中转运出来(Tresguerreset al, 2020)。在本研究中, 高氨胁迫6~48 h,NKA基因的持续高表达表明, 短期氨氮胁迫下缢蛏可通过诱导NKA基因mRNA 的转录水平和蛋白丰度上调, 来促进鳃中NH+4的跨膜转运。
NH+4在水溶液中不能通过自由扩散的方式穿过细胞膜, 而需要转运蛋白参与(Henryet al, 2012)。由于NH+4与K+的离子半径、迁移率等物理特性相似,NH+4可以竞争性结合K+转运蛋白, 如NKA、NKCC和KCN (Kinneet al, 1986; Choeet al, 2000; Weineret al, 2007)。研究发现, 红鳍东方 鲀(Takifugu rubripes)、热带雀鳝(Atractosteus tropiccus)、许氏齿弹涂鱼(Periophthalmodon schlosseri)在氨氮胁迫下鳃中NKA和NKCC1的mRNA 表达水平均上调, 表明二者在氨排泄过程中均发挥作用(Nawataet al, 2010; Chewet al, 2015; Aranda-Moraleset al, 2021)。本实验通过对Sc-NKA基因进行RNAi 后发现, 缢蛏血淋巴氨浓度在干扰后显著升高, 证实了NKA 在氨氮转运中的重要作用。同时, qRT-PCR 检测Sc-NKA基因干扰后Sc-NKCC1的mRNA 表达量发现, 对NKA基因的抑制会下调NKCC1基因的转录水平, 表明两者之间可能存在着协同作用。水生生物通过鳃细胞基底外侧膜上的NKCC1替代K+运输NH+4的生理活动将导致流入上皮细胞的Na+增加, 因此, 增强NKA 酶的活性对于维持Na+电化学梯度至关重要(Chewet al, 2020)。也有研究推测,NKA 能够维持Na+梯度进而驱动NKCC1 (任琴, 2015)。结合本研究的实验结果, 当NKA表达水平降低时, 细胞内的Na+浓度将增加, 影响细胞内外的Na+浓度梯度,进而使NKCC1的表达受到抑制。
4 结论
本研究在缢蛏氨氮耐受和敏感群体中验证了位于NKA基因下游的SNP 位点(g.21062868T>A)与氨氮耐受性状存在显著关联性(P<0.05), 分析了该基因在高氨胁迫下的时空表达规律, 发现氨氮刺激可以诱导Sc-NKA的高表达。Sc-NKA 蛋白定位于缢蛏鳃的柱状细胞和扁平细胞中, 并且在氨氮胁迫后蛋白丰度增加。此外, 干扰Sc-NKA使血淋巴中的氨浓度升高, 并下调了同为K+转运蛋白的Sc-NKCC1基因的转录水平, 这表明Sc-NKA 在氨运输过程中具有重要作用。后续将深入探究NKA 与其他转运蛋白在氨氮排泄中的互作关系, 为进一步阐明缢蛏氨氮胁迫响应分子机制奠定理论基础, 也为耐氨氮新品种的分子标记辅助选育工作提供候选基因。

