后生元调节肥胖的研究进展
汪玲娥,庞立冬,李 誉,李鸿萱,丁弋芯,黄 燕,祁雪鹤,叶亚明,满朝新,姜毓君,*
(1.东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030;2.湖北均瑶大健康饮品股份有限公司,湖北 宜昌 443000)
肥胖概念首次被提出是在1620年,来自英国的医生Venner认为肥胖是上层人士的一种“职业病”[1]。19世纪美国营养学家Ancel Keys提出的体质量指数(body mass index,BMI)被用作衡量肥胖的指标并沿用至今[1]。如今全球超重(BMI≥25 kg/m2)和肥胖(BMI≥30 kg/m2)人群比例成倍增加,主要原因是高能量低营养的饮食习惯以及锻炼的减少[2]。肥胖可导致人体多个系统发生病变,许多研究已证实心脏病、糖尿病和中风等各种慢性疾病均与肥胖有着密切关联[3-7]。
2013年,西班牙学者Katerina正式提出“后生元(postbiotics)”概念[8-9]。2021年国际益生菌和益生元科学学会(International Scientific Association for Probiotics and Prebiotics,ISAPP)发布后生元共识声明,将其定义为“对宿主健康有益的无生命微生物和/或其成分的制剂”[10]。后生元通过特定的灭活方式,使原本具有活性的微生物丧失活性和生长繁殖能力,但同时一定程度上保留其结构、特性和功效。一般来说后生元可分为菌体成分和菌代谢产物,这些成分包括肽聚糖衍生的胞肽、胞外多糖(exopolysaccharides,EPS)、磷壁酸和构成细胞壁成分的表面突出分子(如菌毛、性菌毛或鞭毛)、分泌的蛋白质/肽、细菌素(如嗜酸蛋白、罗伊氏菌素等)、细胞-游离上清液、有机酸(如乳酸和乙酸)、维生素、短链脂肪酸(short chain fatty acids,SCFAs)(如丁酸和丙酸盐)、神经递质、生物表面活性剂等[11]。
近年来已经有不少学者研究了后生元可能具有的健康益处[12-15],目前后生元已经被应用于普通食品、营养保健品、特殊医学食品、婴幼儿食品等中,随着后生元研究的不断深入,其逐渐开始被应用于预防或治疗疾病。临床研究表明,后生元可有效缓解急/慢性腹泻(Crohn’s disease,CD)、调节免疫功能、改善过敏反应[16],同时其在预防肥胖及改善与之相关代谢紊乱方面的研究报道也越来越多[17-19]。后生元已成为一种潜在的新兴治疗肥胖手段,部分有关后生元健康作用的临床研究汇总如表1所示。因此,本文对肥胖的危害和形成机制进行介绍,讨论后生元对人体发挥有益作用的潜在机制,综述后生元改善肥胖作用的研究进展,为推动临床治疗肥胖的研究及相关后生元药物或制剂的开发提供参考。

表1 有关后生元健康作用的临床研究Table 1 Clinical studies on the health promoting effects of postbiotics
1 肥胖的危害作用及其形成机制
1.1 危害作用
肥胖被世界卫生组织(World Health Organization,WHO)认定为一种慢性疾病,患有肥胖的同时常伴随多种代谢疾病的发生[27],近年来有关肥胖危害的研究数量较多,表2总结了2017—2022年有关肥胖危害的研究。根据《中国居民营养与慢性病状况报告(2020年)》显示,我国已有超过一半的成年人处于超重或肥胖状态[28]。肥胖不仅会增加2型糖尿病(type 2 diabetes mellitus,T2DM)、心血管疾病、慢性肾病等一系列代谢疾病发生[3,29-31],还会对大脑小胶质细胞造成损伤,加快大脑老化[32]。最新研究发现肥胖可显著增加抑郁和焦虑的风险[33]。

表2 2017—2022年关于肥胖的危害研究Table 2 Studies on the dangers of obesity in 2017–2022
1.2 形成机制
1.2.1 能量失衡
根据能量守恒定律的普遍解释,摄入能量超过消耗能量会导致身体脂肪增加[54],这也就是传统的能量平衡模型(conventional model,CM)[55]。过量进食会对胰岛素分泌产生作用,机体将葡萄糖转化为脂肪组织,影响脂肪细胞中的热量沉积,这一过程通过对脂肪细胞的直接影响和削弱食物摄入的循环代谢从而导致肥胖。这一观点将肥胖主要归因于食物的过量摄入,认为所有能量对身体来说都是一样的,没有考虑神经内分泌等生理过程机制[56]。实验性过度喂食动物和人类增加体质量可诱导肥胖[57-58]为这一观点提供了有力证据。
1.2.2 选择性代谢
能量守恒定律的第2种解释是身体脂肪质量的增加推动正能量平衡[54]。有别于传统的CM,碳水化合物-胰岛素模型(carbohydrate-insulin model,CIM)[55]提出了饮食与肥胖因果方向的反转,即饮食的关键作用是代谢,能量对慢性脂质储存或有独立效应,碳水化合物的摄入是导致肥胖的主要原因。高碳水化合物饮食会导致餐后血糖升高,刺激胰岛素分泌,促进脂肪储存,导致血液中糖、脂等供能分子不足,这一过程改变能量物质分配,致使饥饿感和能量摄入增加、降低代谢率,从而导致肥胖。这一观点认为碳水化合物和/或某些特定食物成分的摄入是肥胖的主要原因,胰岛素和脂肪细胞在肥胖形成中发挥着核心作用[56]。相比于传统模型,CIM纳入了人体生理过程和神经内分泌机制等因素。
CIM假设了双向因果关系(推-拉模型)[54]。在这样的综合模型中,人类天生对高能量和高适口性食物的偏好共同促进了正能量平衡。在过度进食后的前几个小时,机体会将多余能量推入脂肪组织,在进食后期,饮食对激素的影响(选择性代谢)会引发一种拉动机制,身体会增加胰岛素分泌量,并抑制胰高血糖素的分泌,同时机体向脂肪细胞发出信号,让其储存更多的能量,从而减少肌肉和其他代谢活跃组织所需的能量,当大脑感知到身体没有获得足够能量时,会导致机体饥饿感的产生;同时,新陈代谢也可能会在身体试图保存能量的过程中减慢。基于这一假设,上述两种机制共同促进了脂质储存。
2 后生元的潜在作用机制
后生元可通过体内系统反应与肠腔原位反应调节机体代谢。体内系统反应指后生元经过热灭活处理,由于其具有小分子的特性,可以通过肠道屏障更快、更直接地作用于人体,增强人体免疫力、平衡肠道菌群、调节生理功能[59]。肠腔原位反应指脂壁酸等化合物可以干扰有害菌在肠腔中的生长,减少有害菌彼此间的联系,并平衡肠道有益菌和有害菌比例,进而维持人体肠道健康[59]。因此,后生元具有的健康益处可能是由许多不同机制所驱动的(图1)。目前,科学家们已经发现了各种形式的后生元,经过研究,由益生菌细胞产生的各种后生元成分可以通过不同途径对机体代谢进行有益调节,并且有的后生元和益生菌的益生作用相似,在某些情况下,其作用机制也可能与已知的益生菌作用机制类似,但后生元不依赖于细菌的活性,同时这些后生元的益生机制也可以独立或联合发挥作用[9]。到目前为止,后生元在人类或动物体内发挥益生功效的作用机制尚未完全阐明。
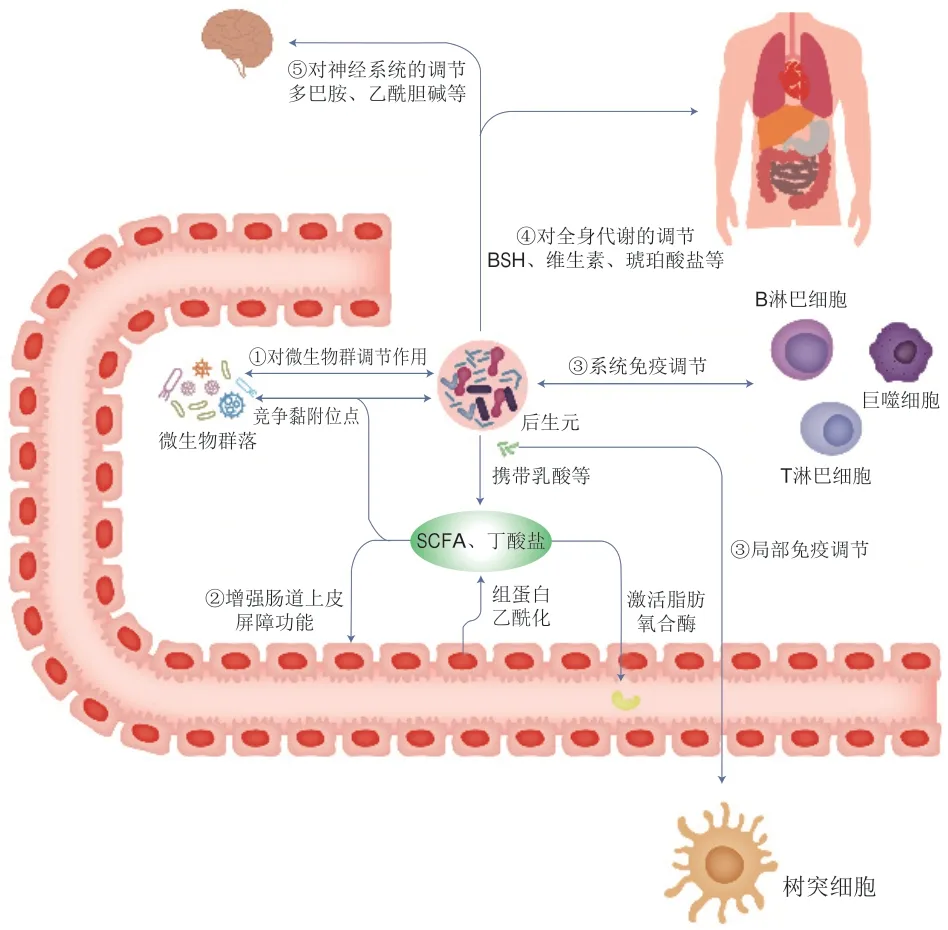
图1 后生元潜在作用机制Fig.1 Potential mechanism of action of postbiotics
2.1 对微生物群的稳态调节
虽然后生元已无生命特征,但其中的许多成分具有生物活性,对肠道微生物具有调节改善作用。如细菌素(一种细胞外抗菌肽)可以抑制与致病性密切相关的微生物,被认为是肠道微生物群落多样性的重要贡献者[60]。另一后生元成分乳酸也具有抗菌活性[61-62]。在革兰氏阳性菌的细胞壁化合物中,磷壁酸与肽聚糖共价连接形成阴离子糖聚合物与磷酸二酯连接的重复单元,在细胞结构、细胞分裂控制中起关键作用,有利于宿主细菌间的相互作用和细胞生理学中其他关键生化和代谢作用。此外,后生元中可能存在群体感应和群体淬灭分子[63],肠道中的某些微生物可以利用后生元中携带的乳酸,产生对机体有益的SCFAs和丁酸盐。如果处理后的后生元中仍含有保持原活性的黏附成分(如菌毛和凝集素),那么后生元也可以与常驻微生物竞争黏附位点[64],发挥益生功效。
2.2 强化肠道上皮屏障功能
分泌蛋白(如分泌蛋白Msp1/p75和Msp1/p40,或来自鼠李糖乳杆菌GG的蛋白质[65])可介导增强肠道上皮屏障功能[9]。研究发现热灭活的双歧杆菌MIMBb75可缓解IBS,可能的原因是灭活后的细菌及其代谢物依然能够附着在肠道内壁细胞上,加强肠道屏障,从而抵御可能导致IBS的有害细菌和毒素[21]。后生元中的SCFAs如果达到足够的水平,也可能会改变肠道上皮屏障功能,并抵御脂多糖(lipopolysaccharide,LPS)诱导的肠道屏障功能障碍[66]。例如,在Caco-2细胞中,后生元组分丁酸盐可依赖肌动蛋白结合蛋白突触足蛋白(recombinant synaptopodin,SYNPO)促进肠道屏障功能,加速肠上皮细胞损伤修复[67];或通过组蛋白乙酰化激活脂肪氧合酶,从而改变紧密连接的通透性[68]。
2.3 免疫调节
后生元对机体局部和全身的免疫调节活动,通常由微生物相关分子与免疫细胞的特定识别受体相互作用来介导,进而导致各种细胞因子和免疫调节剂的表达[9]。这表现在副干酪乳杆菌DG的EPS通过增强人类单核细胞系Tamm-Horsfall蛋白1(THP-1)中肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)基因的表达,特别是IL-8和趋化因子配体20(C-C chemokine ligand 20,CCL20)基因的表达,显示出免疫刺激特性[69]。乳酸等代谢物也可通过肠道CX3CR1+细胞中GPR31依赖的树突突起,介导免疫反应[70]。同样地,罗伊氏乳杆菌产生的色氨酸衍生物吲哚能激活小鼠肠道中CD4+T细胞的芳香烃受体,诱导其分化为CD4+CD8αα+双阳性上皮内淋巴细胞[71]。Qi等[72]对鼠李糖乳杆菌LGG不同后生元化合物免疫调节特性的研究表明,大多数后生元组分通常抑制LPS刺激的小鼠巨噬细胞RAW264.7中Toll样受体(Toll-like receptors,TLR)、丝裂原活化蛋白激酶、细胞外调节蛋白激酶和核因子-κB信号通路的激活。
2.4 全身代谢调节
后生元对全身代谢的调节可直接由灭活微生物内部或表面的代谢物以及酶来介导[9]。如BSH负责胆汁酸的解离,从而使微生物进行进一步的生物转化,并使系统循环的胆汁酸池多样化[73]。已有的研究表明副干酪乳杆菌细胞壁蛋白组分可通过诱导细胞凋亡从而抑制人结肠癌细胞系的生长[74]。同时,热灭活短乳杆菌和副干酪乳杆菌可通过Bcl2关联X蛋白(BCL2-associated X,Bax)/B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl2)和半胱天冬酶途径诱导HT-29人结肠癌细胞系的凋亡[74]。另一种后生元物质琥珀酸盐作为一种碳水化合物发酵的细菌中间体,也是肠道糖异生的底物,已被发现可改善小鼠的血糖水平[75]。一项关于线虫的研究发现,灭活副干酪乳杆菌D3-5菌株的胞壁成分脂磷壁酸(lipoteichoic acid,LTA)可通过促进肠道黏蛋白生成,从而减少衰老相关的肠道渗漏和炎症,促进人体健康[76]。
2.5 作用于神经系统
微生物可以代谢多种神经活性物质,这些物质可以作用于肠道和中枢神经系统,可能调节动物和人类的行为及认知功能。这些物质包括几种神经递质(如血清素、多巴胺、乙酰胆碱和γ-氨基丁酸)以及能与大脑中表达受体结合的各种化合物(例如吲哚和胆汁酸)。微生物酶还可以代谢饮食前体以合成宿主神经递质,如色氨酸可用于血清素的合成,酪氨酸可用于多巴胺的合成,从而降低营养物质的生物利用率[77]。除了酶之外,一些代谢物如SCFA可合成维生素(如VB),对中枢神经系统功能有着重要的调节作用。
3 后生元改善肥胖研究进展
随着后生元对人体作用机制研究的深入,利用后生元改善肥胖的研究也取得了初步进展,后生元形式多样,不仅包括灭活的微生物菌株及其自身的细胞成分,还包括微生物产生的代谢产物等。目前一些高效的抗肥胖后生元在乳杆菌属、双歧杆菌属及拟杆菌属等[21,24-25,78-79]中均有发现。已有相关研究报道了一些具有减肥降脂作用的微生物代谢产物后生元,而目前对微生物细胞自身成分的抗肥胖作用鲜有研究,因此,本文主要从后生元菌株及菌体代谢物的角度综述后生元在调节代谢以改善肥胖症状方面的研究进展,并对一些其他形式的减肥后生元进行补充说明。
3.1 后生元菌株改善肥胖症状研究进展
3.1.1 嗜黏蛋白阿克曼菌
嗜黏蛋白阿克曼菌(Akkermansia muciniphila,Akk)是一种肠道共生菌,Akk的丰度与肥胖呈负相关,在肠道中占比约为3%~5%[80]。2016年比利时鲁汶大学Plovier等[81]首次发现巴氏灭活(70 ℃、30 min)的Akk比活菌能够更好地降低小鼠脂肪含量并减轻胰岛素抵抗和血脂异常,这是灭活Akk作为后生元在改善肥胖症状方面优于益生菌的有力证据;此后的多项研究也证实了Akk的这一特性[82-86]。Akk代谢产物SCFA与肠上皮细胞受体FFAR3-FFAR2(又称GPR43-GPR41)结合,刺激肠道内胃肠激素胰高血糖素样肽1(glucagon-like peptide-1,GLP1)和GLP2的分泌,从而有助于糖代谢和肠道屏障功能的调节。活菌在70 ℃巴氏杀菌30 min后某些细胞成分的活性会部分或全部保留[87-88],Akk外膜特异性蛋白Amuc_1100的耐热特性正是Akk发挥减肥降脂作用的关键[23,81,85,89]。研究人员在比较Amuc_1100和活菌以及巴氏杀菌后的Akk对饲喂HFD小鼠的影响时发现,饲喂Amuc_1100小鼠与饲喂巴氏杀菌后的Akk小鼠观察到的情况类似,即Amuc_1100激活了TLR2,并单独发挥了Akk的部分益生功能[85,89]。Cani[90]和Yoon[91]等发现了Akk的另一关键蛋白——分子质量为84 kDa的P9蛋白[90-91]。研究发现Akk能够增加小鼠肩胛间褐色脂肪组织(brown adipose tissue,BAT)的产热,而对白色脂肪组织(white adipose tissue,WAT)无影响[91-92],用Akk的无细胞上清液处理人肠分泌L细胞(NCI-H716),观察到其上清液中的P9蛋白刺激了GLP-1的分泌,而GLP-1是小肠分泌的一种抑制食欲的激素,可以调节宿主能量平衡、改善小鼠葡萄糖稳态,并且P9蛋白促进GLP-1分泌的作用比Amuc_1100更加显著,而P9蛋白诱导GLP-1分泌的机制与钙离子信号蛋白和细胞间黏附分子2(intercellular adhesion molecule 2,ICAM-2)有关(图2)。

图2 Akk外膜蛋白激活GLP-1R释放GLP-1Fig.2 Akk outer membrane proteins activate GLP-1R to release GLP-1
3.1.2 双歧杆菌属
双歧杆菌属为具有抗肥胖功能的后生元菌株[92]。热灭活(121 ℃、20 min)的动物双歧杆菌乳亚种CECT8145(Ba8145)可通过增强碳水化合物氧化以增加能量消耗,从而介导肥胖,能量消耗的增强可能与线粒体功能的改善和BAT产热相关基因的激活有关[93]。此外Ba8145能够降低饲喂自助餐厅式膳食(cafeteria diet,CAF)肥胖大鼠的肠系膜脂肪含量,并增加其胰岛素敏感性,改善血脂异常[94]。Pedret等[95]发现热灭活的Ba8145显著改善腹部肥胖指标、舒张压和胰岛素抵抗指数的机制可能与其促进肠道Akk丰度的增加有关。灭活的长双歧杆菌也能改善小鼠肠道菌群组成,抑制HFD引起的小鼠肥胖[96]。肠道屏障通常会阻止来自微生物或饮食的LPS,肠道屏障的受损会导致肥胖动物或人类血浆LPS水平的长期升高[97]。长双歧杆菌通过降低小鼠血液中的LPS水平,减少其向肠道的流入,以改变肠道菌群丰度,并促进GLP-1分泌,从而控制小鼠进食欲望来改善肥胖症状。Othman等[98]探究了摄入灭活长双歧杆菌对肥胖糖尿病模型小鼠的影响,进一步证明长双歧杆菌对体质量的增加和总脂肪组织的积累有显著的抑制作用。
3.1.3 乳杆菌属
单磷酸腺苷(adenosine 5’-monophosphate,AMP)激活的蛋白激酶(AMP-activated protein kinase,AMPK)参与维持体内脂类和胆固醇的细胞能量平衡和稳态[99]。Lee等[100]证实口服植物乳杆菌KTCT13497BP(L-14)提取物可通过AMPK信号通路抑制小鼠前脂肪细胞(3T3-L1)和人骨髓间充质干细胞(hBMMSCs)向成熟脂肪细胞分化。L-14提取物中的EPS通过TLR2和AMPK信号通路抑制脂肪形成,口服L-14提取物可改善体内肥胖及肥胖相关疾病。Lim等[101]发现植物乳杆菌k8制备的后生元LAB-P可以激活能量调节因子AMPKα,AMPKα激活后通过刺激脂质氧化、葡萄糖摄取和抑制脂质合成发挥减肥降脂作用[102]。近年来也有利用植物乳杆菌L-137调节脂代谢以改善肥胖的研究,如热灭活L-137可减轻大鼠脂肪组织肥大和炎症、改善胰岛素抵抗[103],临床研究发现每日摄入热灭活L-137能够改善超重或健康成人的脂代谢[97]。除植物乳杆菌外,热灭活副干酪乳杆菌N1115对长期HFD导致的脂代谢异常具有改善作用[104]。开菲尔乳酸菌后生元(postbiotic lactic bacteria,PLAB)[105]的细胞成分、表层蛋白和EPS可以修复HFD引起的生态失调,改善以Akk为代表的肥胖特征性肠道微生物菌群丰度,其表层蛋白和EPS与葡萄籽粉的多酚类物质结合,能够协同改善HFD诱导的脂肪生成。过氧化物酶体增殖物激活受体(peroxisome proliferatorsactivated receptors,PPAR)的激活可改善脂质代谢紊乱,研究人员从32 种食源性细菌中筛选出一株高PPARα/γ活性的噬淀粉乳杆菌CP1563,发现物理破碎后的菌株可以代替有机溶剂萃取来表达CP1563的体外活性[106]。
除上述几种常见的改善肥胖后生元菌株,研究人员在酵母属、芽孢杆菌属、链球菌属及粪杆菌属[107-109]中也发现了可用于改善肥胖的后生元菌株。
3.2 后生元菌株代谢产物改善肥胖症状研究进展
SCFAs是指碳链中碳原子数小于6的有机脂肪酸,主要包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸[110]。SCFAs是人体肠道中最丰富的微生物代谢物之一[111],这些代谢产物在肠道菌群和宿主之间起中介作用。SCFAs参与体内脂肪酸合成、脂肪酸氧化和脂肪分解的调节[110],作为后生元活性物质,其抵御肥胖作用通常涉及3 种机制——能量消耗、抑制食物摄入和调节脂质代谢[93]。丙酸作为人体脂肪酸生成的抑制剂[112],可降低体质量、收缩压和空腹胰岛素水平,并抑制HFD引起的肝脏大泡性脂肪变性、肝细胞肥大[19]。有研究发现运动后生成的血清乳酸可跨越肠上皮屏障进入小鼠肠道,在肠道菌群作用下代谢为丙酸,从而提高机体运动性能,增大能量消耗[113]。丁酸作为一种组蛋白去乙酰化酶抑制剂,能够通过调节基因表达而调控相关细胞代谢[114]。动物实验表明,摄入丁酸对脂肪组织的代谢和功能、能量和底物的代谢、胰岛素敏感度和体质量控制有积极影响[115]。Wang Li等[115]发现丁酸盐可降低小鼠食欲,促进脂肪氧化,激活BAT。丙酸盐和丁酸盐在人体血液中的浓度通常较低,但它们可以通过激活激素和神经系统间接发挥作用[116]。如丁酸盐通过肠-脑神经回路降低食欲并激活BAT[117],丙酸盐、乙酸盐也能够以类似途径对葡萄糖及脂质代谢、食欲及能量消耗产生影响[118]。总体来说,微生物来源的SCFAs能够通过肠道、中枢神经系统、脂肪组织的互作减少食欲[119],SCFAs作为G蛋白偶联受体GPR41和GPR4396的信号分子或内源性配体,介导SCFAGPR41肠-脑神经轴,并通过GPR依赖的方式刺激肠内分泌GLP-1和肽YY(peptide YY,PYY),让大脑产生饱腹感,从而减少食物摄入[111]。瘦素[120]作为饱腹激素,是脂质代谢及相关代谢通路的重要成分,由脂肪组织合成,其合成和释放也与GPR41的激活以及GLP-1和PYY的表达量增加有关。
胆汁酸是能量稳态的外周和中枢调节因子,在全身脂质代谢和葡萄糖代谢中发挥关键的调控作用[118],其通过胆汁酸在体内的初级胆汁酸代谢和次级胆汁酸代谢来实现[121]。肠道菌群可以生成多种次级胆汁酸,其中脱氧胆酸(deoxycholic acid,DCA)和石胆酸(lithocholic acid,LCA)是肠道菌群代谢最丰富的次级胆汁酸,其通过G蛋白偶联受体TGR5调节宿主能量稳态和代谢[122]。肠道中的一些特定细菌还能通过7α-脱羟基作用将胆酸和鹅去氧胆酸等初级胆汁酸分别转化为DCA和LCA[123],同时DCA、LCA及其衍生物是胆汁酸池再循环的主要成分,而胆汁酸池的大小、组成或其生物学作用的改变,也可能会使机体平衡向肥胖偏移[124]。此外,12α-羟基胆汁酸是另一种影响胆汁酸池组成的次级胆汁酸,胆汁酸代谢酶Cyp8b1是产生12α-羟基胆汁酸必需的酶,研究发现Cyp8b1基因敲除小鼠的胆汁酸水平正常,但胆汁酸组成显著改变,因此影响了小鼠进食情况[125]。
革兰氏阳性细菌和革兰氏阴性细菌中有一些微生物可以促进色氨酸代谢产生吲哚及各类吲哚衍生物,如吲哚乙酸、色胺、吲哚醛等[13]。有研究人员在HFD诱导的小鼠实验中发现,吲哚能够有效预防肥胖,这是由于肠道吲哚代谢物作为一种信号分子,可以诱导肠内分泌L细胞释放GLP-1,从而抑制食欲、促进胰岛素分泌、减缓胃排空[126],这一结论在吲哚丙酸大鼠实验中同样得到了证实[127]。同样地,多形拟杆菌代谢物色胺能够激活肠上皮G蛋白偶联受体,调节小鼠脂代谢[128]。另一肠道菌群(尤其是乳杆菌属)的吲哚类代谢物3-吲哚乙酸与LPS可分别作用于孕烷X受体及TLR4,促进调节性B细胞IL-35+B在脂肪组织中的累积,从而抑制HFD诱导的小鼠肥胖[129]。Virtue等[130]通过动物实验发现来自肠道微生物菌群的色氨酸代谢物能够控制小鼠WAT中RNAmir-181的表达,从而调节其能量消耗和胰岛素敏感性。一项纳入63 名正常和肥胖受试者的人体研究对菌群代谢产物与大脑奖励网络的功能和连接关系进行分析,发现肠道菌群吲哚代谢物(吲哚、吲哚乙酸和甲基吲哚)含量的增加与受试者大脑中杏仁核、伏隔核和前脑岛等区域的功能和连接增强相关,且吲哚和甲基吲哚分别与BMI和食物上瘾评分呈正相关,这表明肠道菌群衍生的吲哚代谢物可能作用于大脑的奖赏网络,从而影响食物上瘾和肥胖[131]。此外,通过临床样本分析以及小鼠和细胞实验发现,吲哚含量与肥胖相关的NAFLD存在负相关性,补充吲哚能减轻小鼠饮食诱导的NAFLD,减少肝脏脂肪含量[132]。
细胞外囊泡(extracellular vehicles,EVs)是微生物释放的球形结构,携带各种生物活性成分。越来越多的证据表明,肠道微生物菌群衍生的EVs可能是微生物-宿主跨领域交流的相关媒介,在肠道微生物菌群介导的肠道稳态中发挥作用,并最终参与一些代谢性疾病的调控。一些研究已经证实EVs可以改善肥胖症,并且能够轻松穿过黏液层与宿主相互作用,以降低败血症感染风险[109]。Chelakkot等[133]探究了EVs与改善HFD诱导糖尿病小鼠肠道屏障完整性和代谢状况之间的直接关系,发现口服Akk的EVs能够降低小鼠肠道屏障通透性,减少体质量增加,并改善葡萄糖耐量。肠道微生物还可以代谢一些具有生物活性的脂质,常作为后生元代谢物发挥作用。10-羟基-顺式-12-十八碳稀酸(10-hydroxy-cis-12-octadecenoic acid,HYA)是由微生物代谢产生的初始中间共轭亚油酸,HYA能够激活GPR40和GPR120并促进GLP-1的释放,直接调节葡萄糖稳态,并通过G蛋白偶联受体家族的EP3受体促进肠道蠕动,从而抑制脂质吸收[134]。一些乳酸菌代谢物ω-6多不饱和脂肪酸可以在不引起花生四烯酸介导的脂肪炎和通过游离脂肪酸受体改善代谢条件的情况下减轻HFD诱导的小鼠肥胖[134]。其他代谢物如拟杆菌产琥珀酸可以通过激活肠道糖异生作用降低血糖,从而改善小鼠肥胖和代谢功能障碍[135]。普氏杆菌Prevotella copri可改善葡萄糖代谢与其产生的琥珀酸相关[136]。除此之外,部分肠道细菌的神经递质类代谢产物神经酰胺还能够通过分解代谢来介导环境低温诱导机体的产热活动[137]。
3.3 其他形式后生元改善肥胖症状研究进展
目前对抵御肥胖后生元的研究多集中在菌株发掘和代谢产物方面,而构成菌体细胞本身的成分如磷壁酸、肽聚糖、LPS中还鲜有发现具有确切减肥降脂功效的后生元,其他形式的后生元如细胞裂解物多见于调节机体免疫与改善炎症方面[138-140],一些以无细胞上清液形式存在的后生元被发现具备改善肥胖的作用。无细胞上清液中含有许多低或高分子质量的生物分子和活性代谢物,能够对机体健康产生有益的作用,多发现于乳酸菌或酵母菌上清液中[141],鼠李糖乳杆菌GG上清液能够减少高脂肪/高果糖饮食加间歇性缺氧暴露小鼠的体质量增加和肝脏脂肪的沉积,减少脂肪含量,减轻胰岛素抵抗和肝脏损伤,大幅减少新脂肪生成,增强脂质β-氧化,增加能量消耗[142]。胃饥饿素是由胃部细胞产生的多肽,被称为“饥饿荷尔蒙”,负责提高食欲并促进脂肪囤积,其受体GHSR-1a遍布人体的肠道和大脑,在维持能量平衡以及对食物摄入动机和情绪的中枢调节方面起着关键作用。有研究发现制备双歧杆菌(长双歧杆菌APC1472和短双歧杆菌APC6331)和乳酸杆菌(鼠李糖乳杆菌DPC6118和加氏乳杆菌DPC6106)上清液能够调控GHSR-1a减弱胃饥饿素介导的信号传导[143],这为上清液形式抗肥胖后生元的功效提供了有力证据。
4 结 语
肥胖作为全球性疾病,已成为世界上最普遍的公共健康问题之一,与之相关的代谢紊乱疾病发病率在过去的几十年里一直在稳步上升,肥胖的发生与人体能量失衡和机体选择性代谢密切相关,但有关肥胖的病理生理学机制仍存在争议且尚未完全明确。后生元是不具备生命活性的混合物,其种类丰富、形式多样,可以通过不同途径发挥对机体的有益作用,其不仅可应用于食品、保健品等领域,也有越来越多的研究探索其在临床治疗和预防疾病方面的功效。近年来大量体外和体内模型被用来评估后生元在治疗、缓解肥胖症状方面所具有的潜在益生功能及作用机制,发现其菌株主要为Akk、双歧杆菌属及乳杆菌属,且后生元在形式上呈现出多样化特点,揭示后生元在肥胖的预防和疾病治疗中有着良好的发展前景。
当前肥胖依旧是普遍存在的一种慢性疾病,是多种代谢紊乱病的主要诱发因素之一,严重危害着全球公共卫生健康,同时肥胖也是WHO一直非常关注的疾病之一,控制体质量的方法和预防肥胖的相关措施一直在随着科技的进步与研究的深入而多样化推进。目前,后生元由于无生命特征、菌体成分及其活性成分可以高密度集中、安全系数高、质量稳定且可与抗生素同时使用等优势,已被广泛应用于食品、药品等领域,过去20 年间对肥胖的研究和临床试验数量显著增加,尽管后生元的部分作用已得到研究证实,但其对人体抗肥胖的作用机制还不完全明确;因此,有必要通过促进生物机动性(后生元)的综合治疗策略来优化相关肥胖综合征所涉及的不同治疗方法。后生元有望成为代替活菌或其他药物治疗肥胖的有效手段。

