食品中常见真菌毒素的表面增强拉曼光谱检测研究进展
朱家骥,荣雅文*,焦天慧,郭志明*
(1.盐城工学院电气工程学院,江苏 盐城 224051;2.江苏大学食品与生物工程学院,江苏 镇江 212013;3.集美大学海洋食品与生物工程学院,福建 厦门 361021)
真菌毒素是曲霉属(Aspergillus)、青霉菌属(Penicillium)、镰刀菌属(Fusarium)和链格孢属(Alternaria)等真菌自然产生的小分子次级代谢产物[1]。真菌毒素作为天然污染物广泛存在于花生、玉米、小麦、坚果、油籽、水果和蔬菜等食品中,尤其是在食品加工、储存和运输过程中,真菌毒素很容易在适宜的温度和湿度环境下产生。据联合国粮农组织估计,全球约25%的食品受到真菌毒素的污染,约45~50亿人口面临接触真菌毒素的风险[2]。因此,真菌毒素污染已成为世界范围内关注的重要的食品安全问题。近年来,随着分析技术的发展以及越来越多的真菌被分离,已有超过400 种真菌毒素被发现和鉴定[3]。其中,食品中最常见的真菌毒素包括黄曲霉毒素(aflatoxins,AFs)、赭曲霉毒素A(ochratoxin A,OTA)、伏马毒素(fumonisins,FBs)、玉米赤霉烯酮(zearalenone,ZEN)和脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)等[4]。食用受真菌毒素污染的食品会对生物体造成严重的毒理学影响,包括中毒性肝炎、出血、水肿、免疫抑制、肝癌、食管癌和肾衰竭等[5]。然而,大多数真菌毒素具有耐物理化学处理的特性,使其在食品加工过程中很难被清除[6]。因此,针对食品中真菌毒素污染严重的问题,加大对食品中真菌毒素的检测力度,防止重大食品安全问题的发生已成为当务之急。
目前,真菌毒素的常规检测方法主要包括以下两类:1)仪器理化分析法,主要包括气相色谱法、高效液相色谱法、气相色谱-质谱联用法和液相色谱-质谱联用法等[7-9];2)免疫分析法,主要包括酶联免疫吸附分析、荧光免疫分析、放射免疫分析和化学发光免疫分析等[10-12]。仪器理化分析法虽然具有结果准确可靠的优点,但是此类方法通常需要结合复杂的样本前处理,且依赖于昂贵的仪器设备,并需要训练有素的专业技术人员进行操作。免疫分析法虽然具备高通量、现场快速筛查的优势,但是该方法中的抗原抗体的制备费时费力、成本较高,且抗干扰能力较差、假阳率偏高,往往需要精确的仪器理化分析法进行验证。显然,上述两类常规检测方法难以满足食品加工与流通过程中现场快速检测的需求。因此,开发一种快速、高精度的真菌毒素检测方法,以应对快速、多变的市场需求,对于保障食品安全、维护消费者健康有着重要的意义。
拉曼散射是一种光的非弹性散射现象,入射光子与物质分子发生碰撞,使得散射光携带了物质的结构信息,即能够提供物质分子的特异性“指纹图谱”[13]。因此,拉曼散射研究受到了广泛的关注,并逐渐形成了一项新的分析技术——拉曼光谱分析技术。但是,由于拉曼散射信号非常微弱(约为入射光强度的1/106)等因素,拉曼光谱分析技术的实用性受到了很大的限制。20世纪70年代,研究发现贵金属(如金、银、铜等)表面纳米结构是造成拉曼散射信号显著增强的主要原因,由这种增强效应所获得的拉曼光谱被称为表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)[14-15]。目前,SERS技术作为一种新型的快速检测分析技术,既承载了丰富的分子“指纹图谱”信息,又具有灵敏度高(增强因子可达106~1010)、检测速度快、操作简单、不受水分子干扰等优点。基于上述特点,SERS技术已被广泛应用于食品安全、化学分析、生物医学、环境监测以及刑侦科学等领域[16-19]。
本文介绍了SERS信号的增强机理、检测模式,重点综述了SERS在食品常见真菌毒素检测中的应用研究进展,并对目前存在的问题和今后的研究趋势进行了总结和展望。
1 SERS信号增强机理
虽然SERS技术已在多个领域获得了成功应用,但其复杂的增强机理至今尚未完全清楚。目前,科学界的主流观点认为SERS信号增强主要有两种机理——物理增强机理和化学增强机理。
物理增强也被称为电磁场增强,通常发生在金属纳米结构表面,由金属纳米结构表面等离子体共振(surface plasmon resonance,SPR)所介导(图1),物理增强产生的增强因子可达108甚至更高[20]。物理增强效应与具有SERS效应的金属纳米材料的种类、结构、尺寸、间隙等多种因素密切相关。
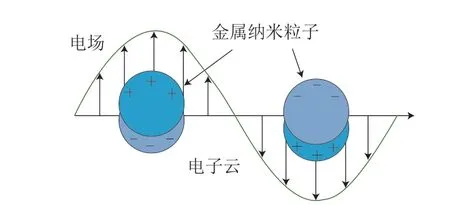
图1 SPR模型示意图Fig.1 Schematic diagram of SPR model
化学增强是由于被吸附的分子与金属纳米结构表面之间复杂的相互作用增大了体系的极化率,化学增强产生的增强因子约为102[21]。图2为化学增强机理示意图,当一定波长的激光照射在金属纳米结构表面时,电子从金属的费米能级附近跃迁到吸附分子上或者从吸附分子上共振跃迁到金属上,使得体系的极化率增大,从而产生SERS增强效应。
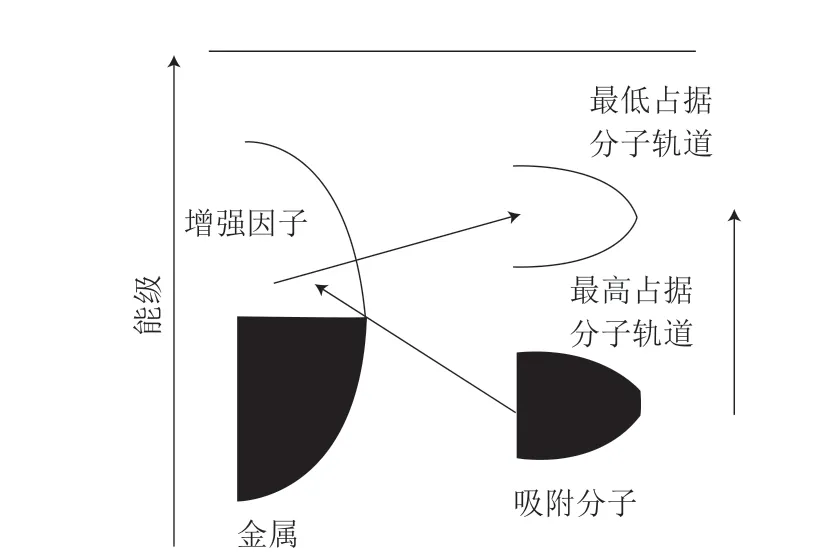
图2 化学增强机理示意图Fig.2 Schematic diagram of chemical enhancement mechanism
2 SERS检测模式
2.1 SERS直接检测技术
SERS直接检测技术也被称为SERS非标记检测技术,其原理是将SERS增强基底与目标分析物紧密结合,待目标分析物接近或吸附于SERS增强基底表面时,可获得其SERS信号,根据SERS信号所提供丰富的分子“指纹图谱”信息实现对目标分析物的检测与分析(图3A)[22]。在SERS直接检测技术中,常用的SERS增强基底包括银纳米管(Ag nanorods,Ag NRs)、银纳米球(Ag nanospheres,Ag NSs)、金纳米颗粒(Au nanoparticles,Au NPs)和金银核壳纳米颗粒(Au@Ag NPs)等[23-25]。SERS直接检测技术的优点在于SERS增强基底制备简单、成本低、可直接获得目标分析物的SERS信号。但是,SERS直接检测技术的缺陷也比较明显,包括SERS信号偏弱、复现性较差、易受到食品中复杂基质的干扰等。因此,研究者在实际应用中通过引入SERS增强基底表面改性技术、简单的样本前处理技术和化学计量学方法很大程度上提高了SERS直接检测技术的性能。
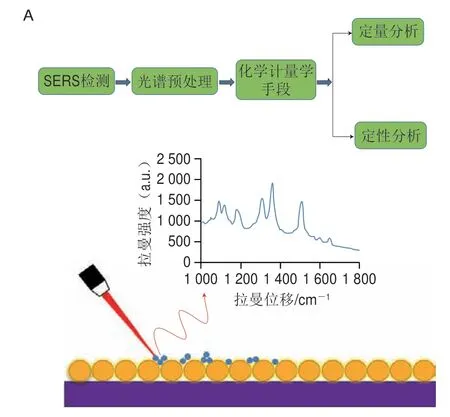
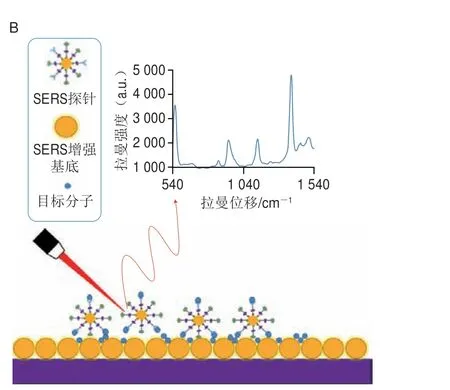
图3 SERS直接检测(A)和间接检测(B)技术示意图Fig.3 Schematic diagrams of label-free (A) and labeled (B) SERS methods
2.2 SERS间接检测技术
SERS间接检测技术又被称为SERS标记检测技术,其原理是利用特殊的SERS探针来示踪,通过对探针上标记物的检测和分析,实现对目标分析物的定性或定量分析(图3B)[26]。通常,SERS探针由SERS增强基底、拉曼信号分子、保护层和识别元件组成[27]。将具有散射截面大、金属亲和力强的拉曼信号分子修饰到SERS增强基底表面,能够产生灵敏度高、稳定性强的SERS信号。目前,一些有机小分子物质如4-巯基苯甲酸(4-mercaptobenzoic acid,4-MBA)、4-硝基硫酚(4-nitrothiophenol,4-NTP)、5,5’-二硫代双-2-硝基苯甲酸(5,5’-dithiobis-2-nitrobenzoic acid,DTNB)、4-氨基苯硫酚(4-aminothiophenol,4-ATP)和孔雀石绿异硫氰酸酯(malachite green isothiocyanate,MGITC)等已被成功用作拉曼信号分子[28-30]。在检测过程中,SERS增强基底容易受到各种因素的干扰,使得SERS信号不稳定,所以常在SERS增强基底表面包裹保护层以提高其稳定性,常用的保护层主要有硅层和多聚物等物质。此外,抗体和适配体作为识别元件赋予了SERS探针特异性识别的性能。与适配体相比,抗体更昂贵且不稳定,容易产生假阳性结果,但由于其制备技术成熟,仍是SERS标记检测中具有竞争力的识别元件[31]。另一方面,适配体因其成本低、易于合成、对目标分子具有良好的特异性和稳定性,已逐渐成为抗体的替代选择[32]。SERS标记检测机制可分为竞争性机制和非竞争性机制,前者适用于检测只有一个结合位点的目标分子,而后者适用于分析具有两个或多个位点的大分子。在竞争性免疫分析中,目标分子和SERS探针相互竞争与抗体结合,因此,SERS信号强度与目标分子的浓度呈负相关。
无论是SERS直接检测技术还是间接检测技术都有其固有的优点和局限性,了解这些优点和局限性有助于更好地利用它们。因此,表1对比了两种SERS检测技术的优点与缺陷。
3 SERS在食品常见真菌毒素检测中的应用
3.1 SERS检测食品中AFs的应用
AFs是由多种曲霉属真菌产生的一系列剧毒、稳定的次级代谢产物,其中黄曲霉毒素B1(aflatoxin B1,AFB1)毒性最强,对人和动物具有严重、慢性的毒性[41]。目前,国际癌症研究机构已将AFs认定为1级致癌物质,长期接触AFs可诱发突变、畸形、胆管增生和肝癌等疾病[42]。因此,各个国家和国际机构都发布了严格的监管指导方针,中国和欧盟规定的AFs的最大限量范围分别为0.5~20.0 μg/kg和0.1~15.0 μg/kg[43-44],美国食品药品管理局规定AFs限量小于20 μg/kg[45]。
近年来,大量的研究报道了利用SERS直接检测技术检测食品中AFs的方法(表2)。例如,Lee等[46]合成Ag NSs作为SERS增强基底,然后结合化学计量学方法,建立了玉米中AFs的分类模型和定量检测模型。在分类模型中,K最近邻模型(K nearest neighbor,KNN)显示出最优的准确判别率;在定量检测模型中,多元线性回归模型(multivariate linear regression,MLR)展现出最佳的预测性能,检测限(limit of detection,LOD)为13 μg/kg,定量限(limit of quantification,LOQ)为44 μg/kg。Lin Bingyong等[47]通过自组装方法在阳极氧化铝模板的纳米孔洞中嵌入金纳米金字塔(Au nanobipyramids into the nanoholes of anodic aluminum oxide,Au NBPs@AAO)作为SERS增强基底,并且该SERS增强基底对拉曼信号分子4-ATP的平均增强因子可达1.0×108,将其用于花生样本中AFB1的检测,检测限为0.5 μg/L(0.5 μg/kg),检测时间为1 min,与传统的酶联免疫吸附分析法(检测时间约为30 min)相比,该方法更为高效。Kutsanedzie等[48]合成Ag NPs作为SERS增强基底,且通过优化其pH值获得了最大的增强因子(当pH值为11时,增强因子可达1.45×108),结合化学计量学方法竞争性自适应重加权采样-偏最小二乘回归(competitive adaptive reweighted sampling-partial least squares,CARS-PLS)和遗传算法-偏最小二乘回归(genetic algorithm-partial least squares,GA-PLS)用于可可豆中AFB1的加标检测,检测限为4.15 pg/mL(4.15×10-3μg/kg),加标回收率为98.58%~108.44%。除化学计量学方法外,SERS直接检测技术也通常与简单的样本前处理技术以及表面改性技术等方法结合以提高其检测性能。例如,Qu Lulu等[49]合成Au NPs作为SERS增强基底,并且结合薄层色谱法用于霉变花生中AFB1、黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素G1(aflatoxin G1,AFG1)和黄曲霉毒素G2(aflatoxin G2,AFG2)的检测,检测限分别为1.5×10-6、1.1×10-5、1.2×10-6mol/L和6.0×10-7mol/L(469、3 460、390 μg/kg和198 μg/kg),说明该方法可用于4 种AFs的分离检测,在食品现场快速筛选中具有良好的应用前景。Szlag等[50]合成金纳米薄膜(Au nanofilm,Au NF)作为SERS增强基底,并在其表面包裹聚合物亲和剂(polyN-acryloyl glycinamide,pNAGA)用于吸附AFB1分子,将该方法可用于水中AFB1的检测,检测限为10 μg/L(10 μg/kg)。
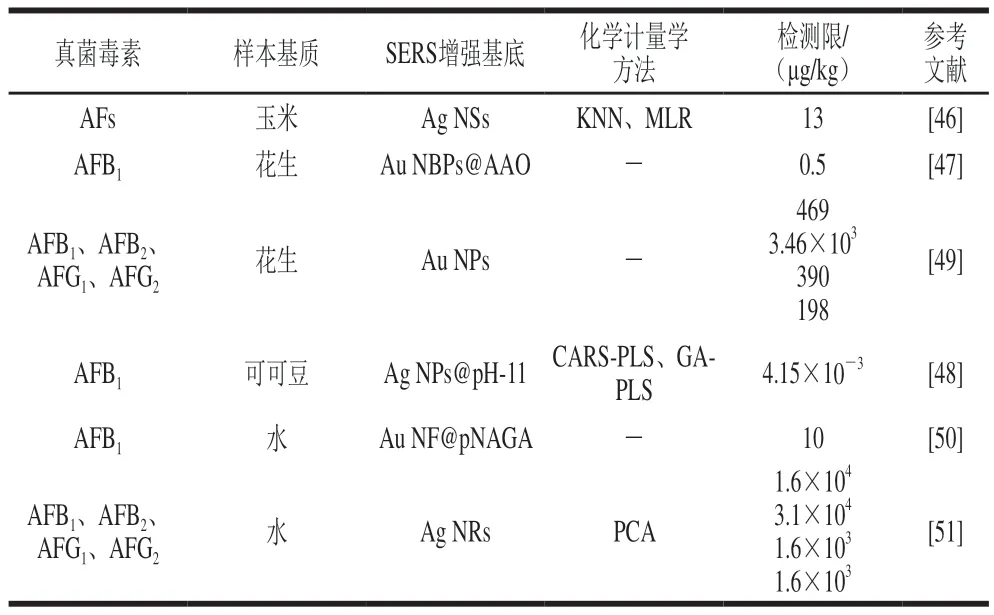
表2 SERS直接检测技术检测食品中AFs的方法Table 2 Label-free SERS methods for detecting AFs in foods
除SERS直接检测技术外,采用SERS间接检测技术检测食品中AFs的方法也有广泛报道(表3)。在SERS间接检测中,由于抗体制造技术已较为成熟,因此其成为应用最广泛的识别元件。例如,Ko等[52]构建了基于SERS的免疫检测平台,以二氧化硅包裹中空金纳米颗粒(silica-encapsulated hollow gold nanoparticles,SEHGNs)作为SERS增强基底,并在其表面修饰拉曼信号分子MGITC与AFB1的抗体Anti-AFB1构成组装体SEHGNs-MGITC-Anti-AFB1作为SERS探针,同时将表面修饰抗体Anti-ATB1的磁性纳米颗粒(magnetic nanoparticles,MNPs)用作负载免疫复合物的支撑基底,借助磁分离与竞争性免疫分析手段实现了对水中AFB1的定量分析(图4A),检测限为0.1 ng/mL(0.1 μg/kg),该方法检测速度快(短于30 min)、灵敏度高、重现性好,有望成为多种真菌毒素痕量检测的一种新方法。
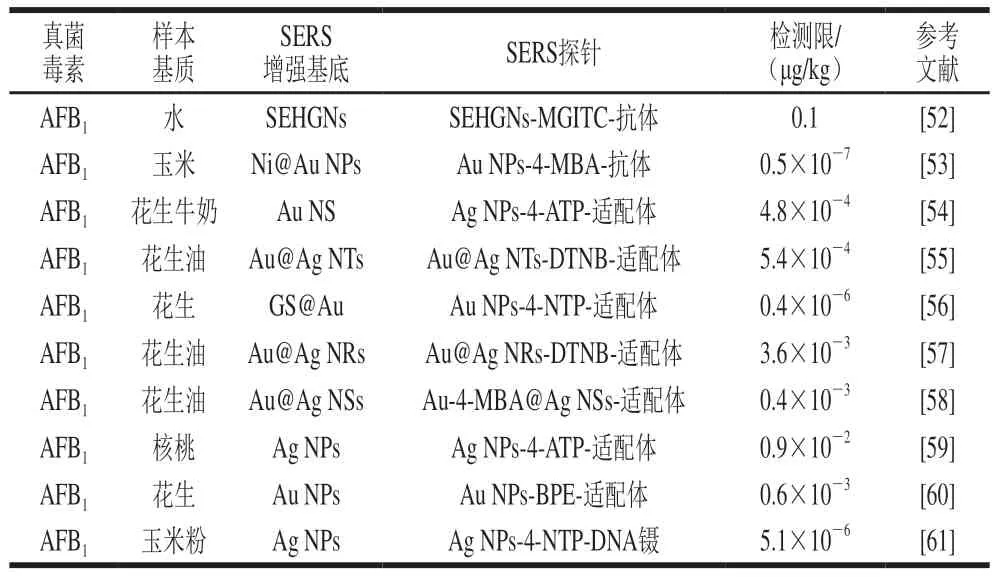
表3 SERS间接检测技术检测食品中AFs的方法Table 3 Labeled SERS methods for detecting AFs in foods
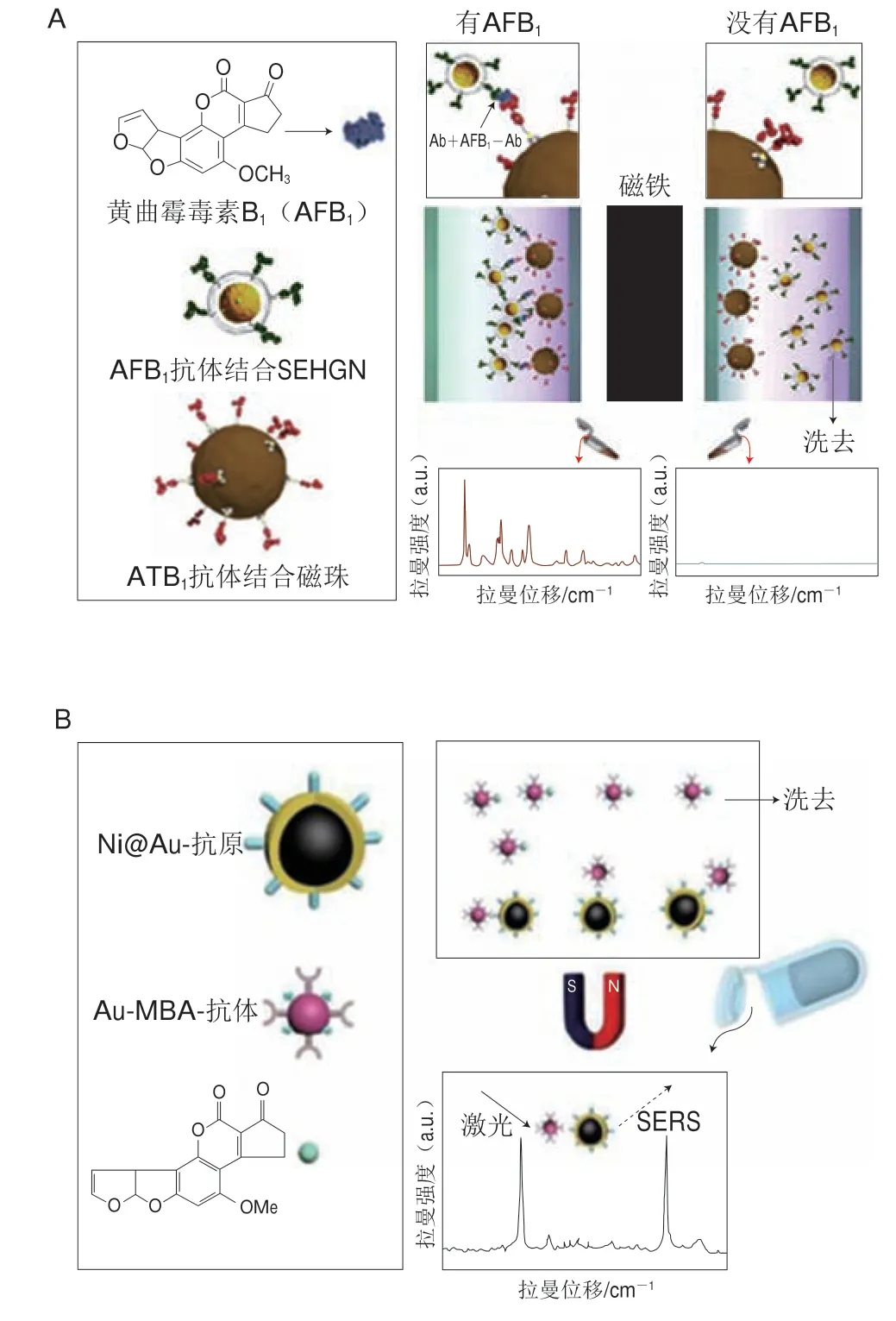
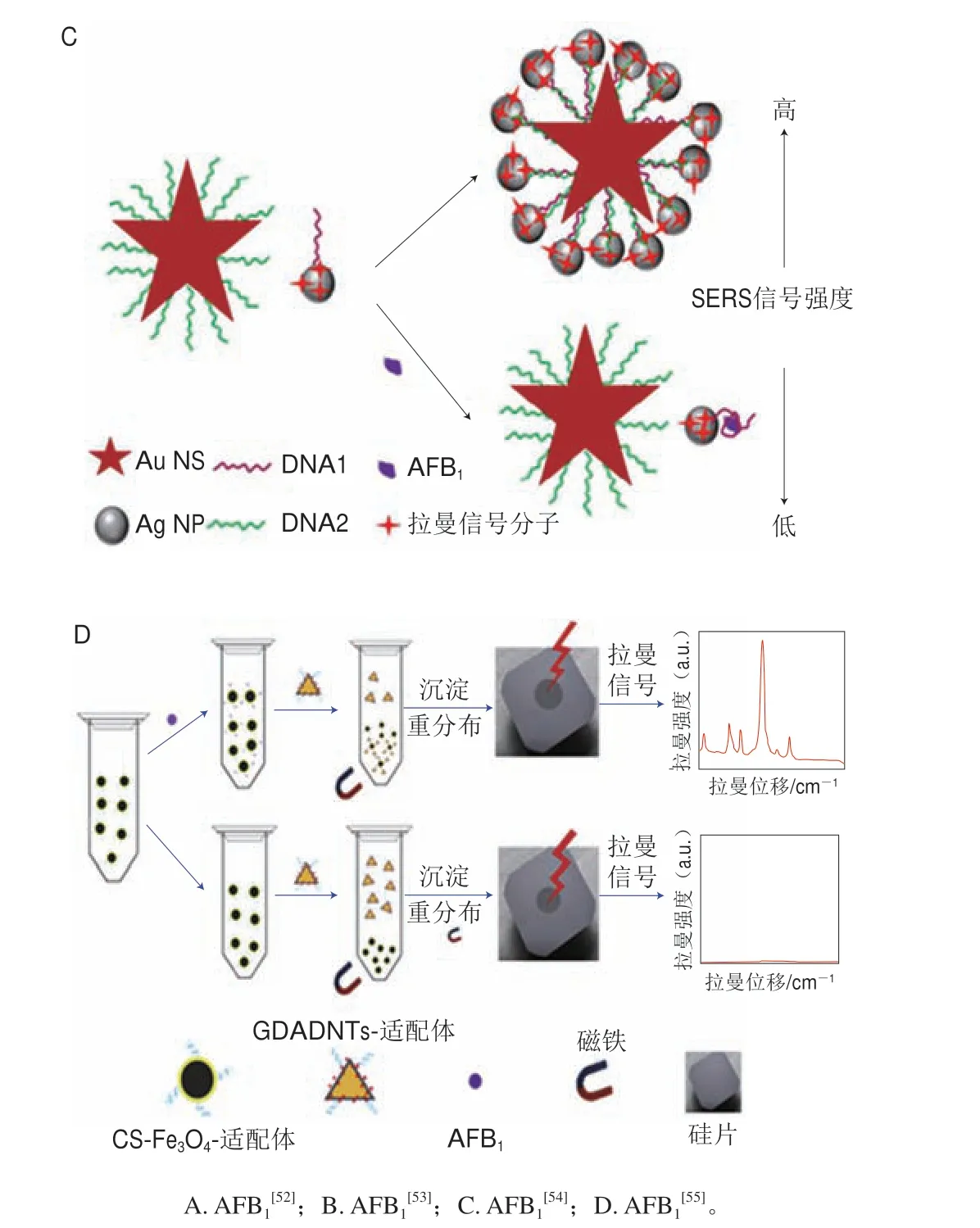
图4 SERS间接检测原理示意图Fig.4 Schematic diagrams of the principle of labeled SERS detection
Fang Congwei等[53]合成了金包裹镍纳米颗粒(Ni@Au NPs)作为SERS增强基底,并在其表面修饰AFB1抗原,同时合成Au NPs,并在其表面修饰拉曼信号分子4-MBA与AFB1抗体构成组装体Au NPs-4-MBA-抗体作为SERS探针。当不存在自由AFB1分子时,在抗原-抗体相互作用下,修饰抗原的SERS增强基底与SERS探针结合成一个复合物,此时4-MBA的拉曼信号非常强。当存在自由AFB1分子时,修饰抗原的SERS增强基底将优先与AFB1结合,从而脱离SERS探针,通过磁分离之后4-MBA的拉曼信号显著衰减(图4B),该方法对AFB1的检测限为0.05 fg/mL(0.5×10-7μg/kg),将该方法用于玉米中AFB1的加标检测,加标回收率为87.4%~111.7%,与标准检测方法液相色谱-质谱联用法相比,该方法具有灵敏度高的明显优势。
除抗体之外,适配体因其成本低、易于合成、对目标分子具有良好的特异性和稳定性,逐渐成为抗体的替代选择,在SERS间接检测中获得广泛应用。例如,Li Aike等[54]合成金纳米星(gold nanostar,Au NS)作为SERS增强基底,并在其表面修饰AFB1适配体(DNA1),同时合成Ag NPs,并在其表面修饰拉曼信号分子4-ATP与适配体互补链(DNA2)构成组装体Ag NPs-4-ATP-DNA2作为SERS探针。当不存在自由AFB1分子时,在DNA1与互补链DNA2的相互作用下,修饰DNA1的SERS增强基底与SERS探针形成一个复合物,此时4-ATP的拉曼信号非常强。当存在自由AFB1分子时,修饰DNA1的SERS增强基底将优先与AFB1结合,将DNA2释放出来,通过清洗分离后4-ATP的拉曼信号显著衰减(图4C),该方法对AFB1的检测限为0.48 pg/mL(4.8×10-4μg/kg),将该方法用于花生牛奶中AFB1的加标检测,加标回收率为88.33%~103.66%。
Yang Mingxiu等[55]合成金银核壳纳米三角(Au@Ag nanotriangles,Au@Ag NTs)作为SERS增强基底,并在其表面修饰拉曼信号分子DTNB与AFB1适配体,构成组装体Au@Ag NTs-DTNB-适配体作为SERS探针,同时合成壳聚糖(chitosan,CS)包裹的四氧化三铁磁性材料(CS-Fe3O4),并在其表面也修饰AFB1适配体作为磁性富集探针,当存在自由AFB1分子时,SERS探针与磁性富集探针将共同捕获AFB1分子形成三明治结构复合物,此时将增强DTNB的拉曼信号(图4D),该方法对AFB1的检测限为0.54 pg/mL(5.4×10-4μg/kg),将该方法用于花生油中AFB1的加标检测,加标回收率为94.7%~109.0%。
3.2 SERS检测食品中OTA的应用
赭曲霉毒素(ochratoxins,OTs)是曲霉属真菌和青霉属真菌产生的次级代谢产物,在已经被发现的多种OTs中,OTA是各类食品中毒性较大、最常见的一种真菌毒素,国际癌症研究机构已将其认定为2B级致癌物质[62]。中国和欧盟规定的OTA的最大限量范围分别为低于5 μg/kg和0.5~10.0 μg/kg[43-44]。
目前,SERS直接检测技术已被广泛应用于食品中OTA的检测(表4)。例如,Galarreta等[63]首次将SERS技术应用于OTA的检测研究,他们通过纳米技术研制了一款管道中嵌有金纳米结构(Au nanostructure,Au NSTR)的聚二甲基硅氧烷微流控芯片作为SERS检测平台,用于水中OTA的检测,检测限为50 nmol/L(0.2×102μg/kg)。Gillibert等[64]合成粗糙的Au NF作为SERS增强基底,同时借助PLS和PCA等化学计量学方法实现了水中OTA的定量检测,检测限为10 pmol/L(4.0×10-3μg/kg)。Rostami等[65]开发了一种新型的SERS检测平台,首先合成二氧化硅包覆的银纳米柱(Ag-capped silicon nanopillars,Ag NPILs@SiO2)作为SERS增强基底,然后通过结合高通量支持液膜法实现了白酒中OTA的定量检测,检测限为0.12×10-3g/L(120 μg/kg)。
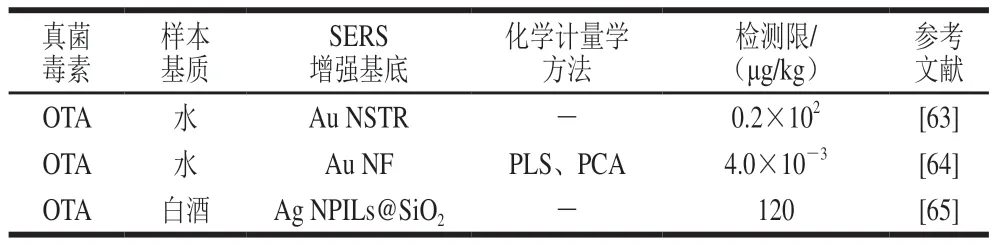
表4 SERS直接检测技术检测食品中OTA的方法Table 4 Label-free SERS methods for detecting OTA in foods
除SERS直接检测技术外,SERS间接检测技术也被广泛应用于食品中OTA的检测。例如,Ganbold等[66]合成Ag NPs作为SERS增强基底,将由染料分子Cy5标记的OTA适配体作为SERS探针。当不存在自由OTA分子时,在絮凝剂的作用下,SERS探针将吸附在SERS增强基底表面,此时Cy5的拉曼信号获得了极大的增强。当存在自由OTA分子时,SERS探针将从SERS增强基底表面脱落,然后与OTA结合,通过清洗分离后Cy5拉曼信号显著衰减(图5A),该方法可实现水中OTA的定量检测,检测限为0.1 nmol/L(4.0×10-2μg/kg),该方法也为实现低成本、快速痕量检测真菌毒素提供了一种新思路。
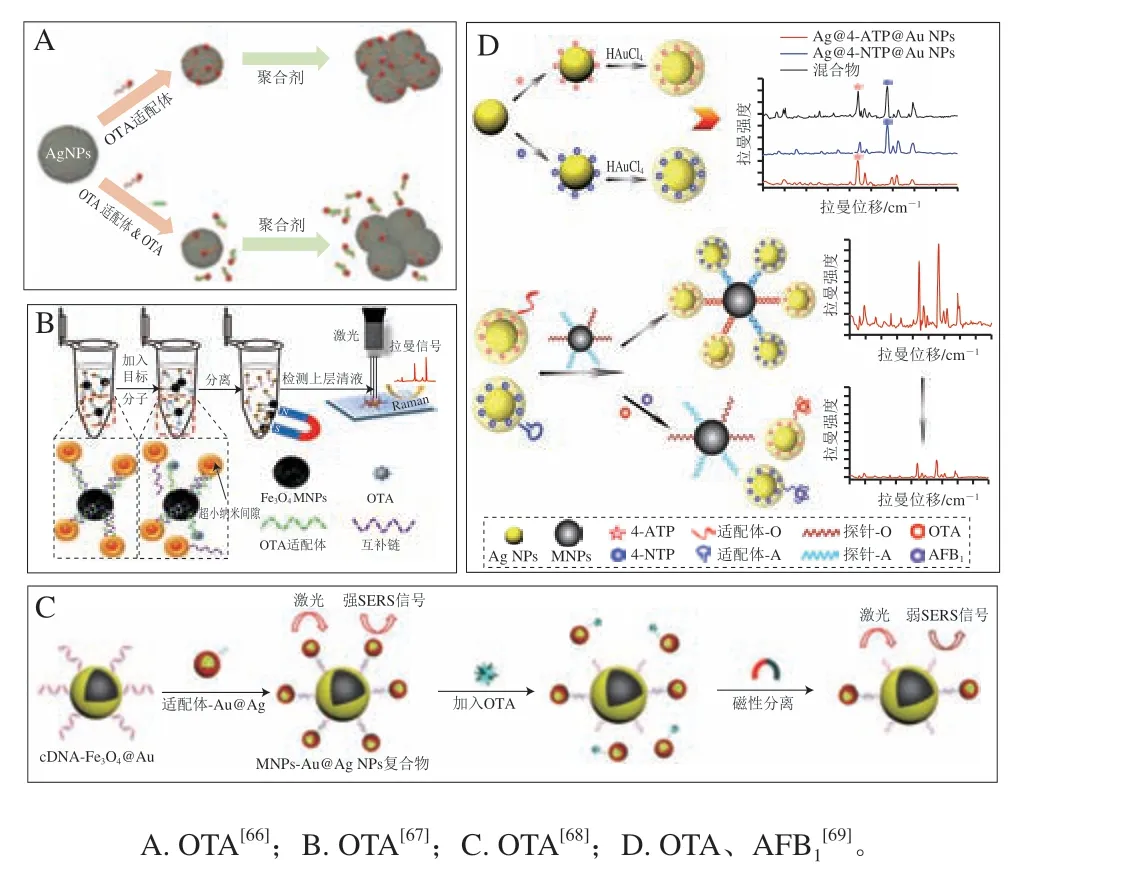
图5 SERS间接检测原理示意图Fig.5 Schematic diagram of the principle of labeled SERS detection
Shao Baoyi等[67]合成了一种带有纳米内隙的金核金银合金壳结构(Au@Au-Ag nanogapped nanostructures,Au@Au-Ag NNSs)作为SERS增强基底,并在其表面修饰拉曼信号分子4-MBA和OTA适配体互补链,构成组装体Au@Au-Ag NNSs-4-MBA-适配体互补链作为SERS探针,同时合成Fe3O4MNPs,并在其表面修饰OTA适配体。当不存在自由OTA分子时,在适配体与其互补链的相互作用下,SERS探针与Fe3O4MNPs结合成一个复合物,此时4-MBA拉曼信号得到显著增强。当存在自由OTA分子时,Fe3O4MNPs将优先与OTA结合,从而脱离SERS探针,通过磁分离之后4-MBA拉曼信号明显衰减(图5B),该方法对OTA的检测限为0.004 ng/mL(0.4×10-2μg/kg),将该方法用于红酒中OTA的加标检测,加标回收率为92%~112%,与传统的酶联免疫吸附分析法相比,该方法更具优越性。
Song Dan等[68]合成Au@Ag NPs作为SERS增强基底,并在其表面修饰拉曼信号分子DTNB和OTA适配体,构成组装体Au@Ag NPs-DTNB-适配体作为SERS探针,同时合成Fe3O4@Au MNPs,并在其表面修饰OTA适配体互补链。当不存在自由OTA分子时,在适配体与其互补链的相互作用下,S E R S 探针与F e3O4@Au MNPs结合成一个复合物,此时DTNB拉曼信号获得显著增强。当存在自由OTA分子时,SERS探针将释放Fe3O4@Au MNPs,从而与OTA结合,通过磁分离之后DTNB拉曼信号明显衰减(图5C),该方法对OTA的检测限为0.48 pg/mL(4.8×10-4μg/kg),将该方法用于红酒、咖啡中OTA的加标检测,加标回收率分别为88%~104%和86%~107%。
近年来,实现多种真菌毒素的同步检测既是现实需求,也是一种挑战与发展趋势。Zhao Yuan等[69]开发了一种基于SERS的同步检测OTA和AFB1的新方法,合成Ag@Au NPs作为SERS增强基底,在一部分SERS增强基底表面修饰拉曼信号分子4-ATP和OTA适配体,构成组装体Ag@Au NPs-4-ATP-适配体1作为SERS探针1(针对OTA),在另一部分SERS增强基底表面修饰拉曼信号分子4-NTP和AFB1适配体,构成组装体Ag@Au NPs-4-NTP-适配体2作为SERS探针2(针对AFB1)。同时在合成的MNPs表面分别修饰OTA适配体互补链和AFB1适配体互补链。当不存在自由OTA和AFB1分子时,在适配体与其互补链的相互作用下,SERS探针1、SERS探针2与MNPs结合成一个复合物,此时4-ATP与4-NTP的拉曼信号非常强。当存在自由OTA与AFB1分子时,SERS探针1将优先与OTA结合,SERS探针2将优先与AFB1结合,通过磁分离之后4-ATP与4-NTP的拉曼信号明显衰减(图5D),该方法对OTA的检测限为0.006 ng/mL(0.6×10-2μg/kg),对AFB1的检测限为0.03 ng/mL(0.3×10-1μg/kg),将该方法用于玉米粉中OTA与AFB1的同步加标检测,加标回收率分别为(95.00±3.08)%~(99.48±3.79)%和(95.00±3.35)%~(99.65±3.95)%,该方法启发了基于不同长度适配体、抗体或其他识别元件的多种真菌毒素同步检测新思路。
SERS间接检测技术在食品中OTA检测方面的应用如表5所示。
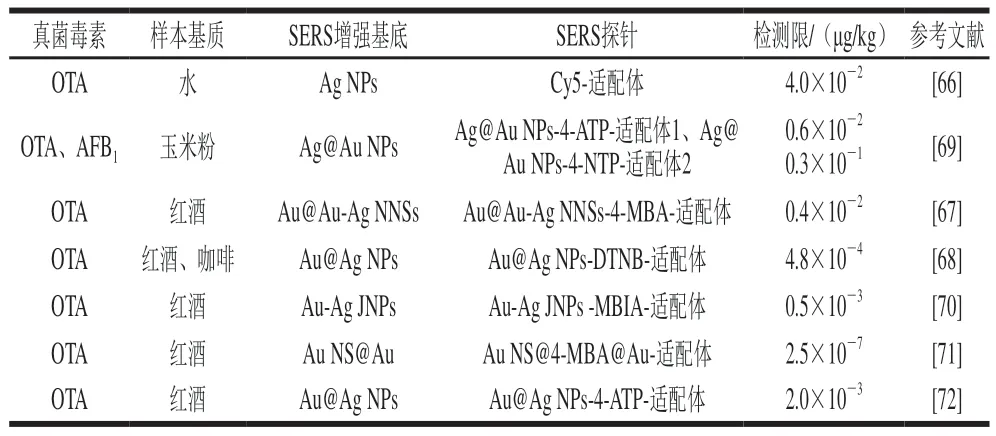
表5 SERS间接检测技术检测食品中OTA的方法Table 5 Labeled SERS methods for detecting OTA in foods
3.3 SERS检测食品中FBs、ZEN和DON的应用
FBs、ZEN和DON均为镰刀菌属产生的次级代谢产物。FBs具有多种类型,其中FB1、FB2和FB3为最主要的3 种类型,FBs主要对人和动物产生肝脏和肾脏毒性[73]。ZEN主要与雌激素活性有关,同时也具有免疫毒素、基因毒性、肝脏毒性和肾脏毒性;DON主要引起人和动物的消化系统疾病,包括恶心、呕吐、腹泻和肠出血等[74-75]。目前,国际癌症研究机构已将FBs和ZEN认定为2B级致癌物质[76]。因此,各个国家、地区和国际机构发布了严格的监管指导方针:1)中国、美国和欧盟规定的FBs最大限量范围分别为200~4 000 μg/kg、2 000~4 000 μg/kg和200~4 000 μg/kg[43-44,77];2)中国和欧盟规定的ZEN最大限量范围分别为低于60 μg/kg和20~350 μg/kg[43-44];3)中国、美国和欧盟规定的DON最大限量范围分别为低于1 000 μg/kg、低于1 000 μg/kg和200~1 750 μg/kg[43-44,78]。
目前,SERS直接检测技术已被广泛应用于食品中FBs、ZEN和DON的检测(表6)。随着纳米合成技术的发展,3D SERS增强基底因其稳定性好、灵敏度高等优点已获得了广泛应用。例如,Lee等[79]合成银枝晶(Ag dendrites,Ag Ds)作为3D SERS增强基底,然后结合化学计量学方法,建立了玉米中FBs的不同污染程度的分类模型和定量检测模型。在分类模型中,在一阶导数光谱预处理的基础上,KNN显示出最优的准确判别率;在定量检测模型中,在一阶导数光谱预处理的基础上,MLR展现出最佳的预测性能,定量限为1.25 mg/kg。Li Jinjie等[80]提出了一种基于SERS的同时检测AFB1、DON和ZEN的新方法,首先在聚二甲基硅氧烷涂层的阳极氧化铝(polydimethylsiloxane coated anodic aluminum oxide,PDMS@AAO)复合衬底表面溅射Au NPs得到3D SERS增强基底Au NPs-PDMS@AAO,该SERS增强基底对拉曼信号分子4-MBA的增强因子可达2.2×106,然后结合化学计量学方法构建了AFB1、DON和ZEN的定量检测模型,检测限分别为1.8、24.8 ng/mL和47.7 ng/mL(1.8、24.8 μg/kg和47.7 μg/kg),将该方法用于玉米中AFB1、DON和ZEN加标同步检测,加标回收率为94%~110%。Liu Qing等[81]通过双光子聚合法构筑了金纳米柱阵列(Au nanopillar arrays,Au NPILAs)作为3D SERS增强基底,并采用时域有限差分法(finite-difference time-domain,FDTD)模拟其周围的电磁场增强以获得最佳的SERS增强效果,同时结合化学计量学方法实现了DON和FB1的定量检测。Yuan Jing等[82]合成Ag NPs作为SERS增强基底,在絮凝剂的作用下可实现DON标准溶液的高精度检测,将该方法用于玉米、菜豆和燕麦中DON的加标检测,检测限分别为10-6、10-6mol/L和10-4mol/L(3.0×102、3.0×102μg/kg和3.0×104μg/kg)。
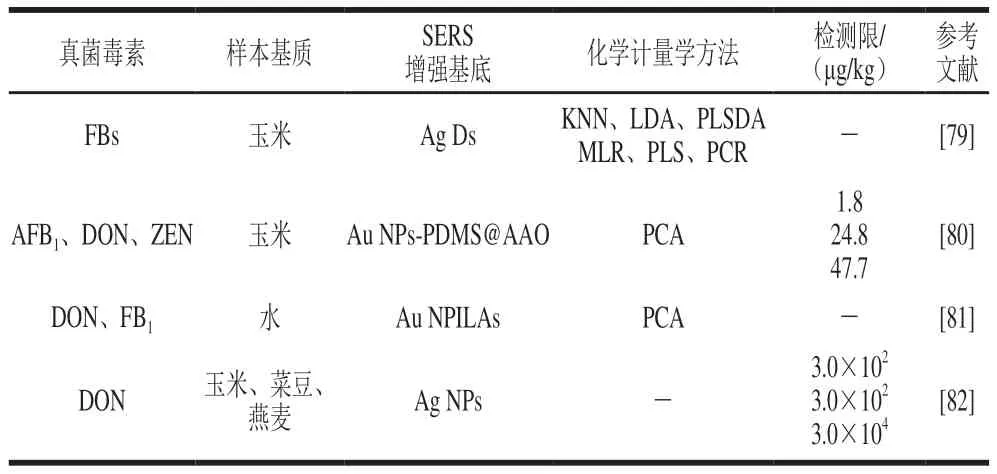
表6 SERS直接检测技术检测食品中FBs、ZEN和DON的方法Table 6 Label-free SERS methods for detecting FBs, ZEN, and DON in foods
除SERS直接检测技术外,SERS间接检测技术也被广泛应用于食品中FBs、ZEN和DON的检测。例如,Liu Jianzhi等[83]合成了Au NPs作为SERS增强基底,并在其表面修饰拉曼信号分子4,4’-联吡啶和ZEN抗体构成组装体Au NPs-4,4’-联吡啶-抗体作为SERS探针,同时在载玻片上修饰牛血清白蛋白(bovine serum albumin,BSA)和ZEN抗原作为捕获基底。当不存在ZEN自由分子时,在抗原-抗体相互作用下,SERS探针与捕获基底结合成一个复合物,此时4,4’-联吡啶拉曼信号获得了增强。当存在自由ZEN分子时,SERS探针将脱离捕获基底,从而与ZEN分子结合,通过清洗分离后4,4’-联吡啶拉曼信号大幅衰减(图6A)。因此,该基于SERS的竞争性免疫分析方法可实现ZEN的高精度检测,检测限为1.0 pg/mL(1.0×10-3μg/kg),将该方法用于对玉米中ZEN的加标检测,加标回收率为99.0%~105.2%,该方法还可以进一步应用于多种被ZEN污染的天然谷物样本的分析,具有很大的实际样品检测潜力。
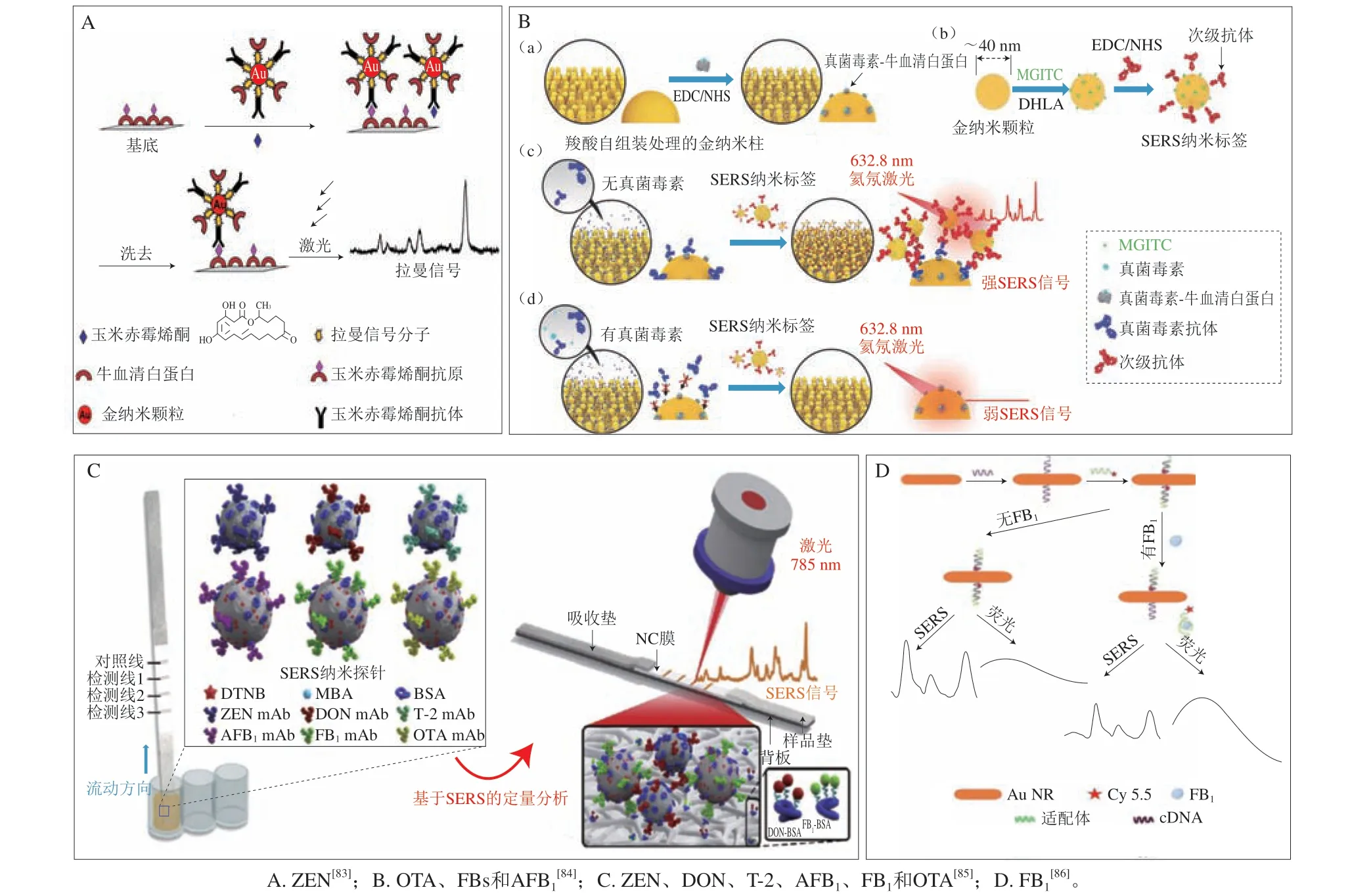
图6 SERS间接检测不同真菌毒素原理示意图Fig.6 Schematic diagram of the principle of labeled SERS detection for different mycotoxin
Wang Xiaokun等[84]开发了基于SERS的高灵敏检测多种真菌毒素的竞争性免疫分析平台,一方面构筑Au NPILAs作为3D SERS增强基底,首先在其表面固定羧酸自组装单层形成亲水表面,然后采用1-乙基-3-(3-(二甲氨基)-丙氨基)碳二亚胺(1-ethyl-3-(3-(dimethylamino)-propyl) carodiimide,EDC)和N-羟基丁二酰亚胺(N-hydroxysuccinimide,NHS)激活羧酸基团,最后在SERS增强基底表面修饰真菌毒素-BSA;另一方面合成Au NPs,并在其表面修饰拉曼信号分子MGITC和次级抗体,构成组装体Au NPs-MGITC-次级抗体作为SERS探针。当不存在自由目标真菌毒素分子时,在抗原-抗体相互作用下,真菌毒素抗体将与SERS增强基底表面的真菌毒素结合,从而固定在其表面,然后在抗体-抗体相互作用下,真菌毒素抗体将与次级抗体相结合,从而形成SERS增强基底-真菌毒素抗体-SERS探针三明治结构复合物,此时将极大增强MGITC拉曼信号。当存在自由目标真菌毒素分子时,真菌毒素抗体将优先与目标真菌毒素分子相结合,从而SERS探针将脱离SERS增强基底,通过清洗分离后MGITC拉曼信号显著衰减(图6B)。因此,该方法可实现OTA、FBs和AFB1的高精度检测,检测限分别为5.09、5.11 pg/mL和6.07 pg/mL(5.09×10-3、5.11×10-3μg/kg和6.07×10-3μg/kg),该方法的灵敏度比传统的酶联免疫吸附法高两个数量级。
Zhang Wanjun等[85]开发了基于SERS的高灵敏检测多种真菌毒素的侧流竞争免疫分析平台,首先合成Au@Ag NPs作为SERS增强基底,将一部分SERS增强基底表面修饰拉曼信号分子4-MBA,然后分别在其表面修饰ZEN抗体构成组装体Au@Ag NPs-4-MBA-抗体1作为SERS探针1,修饰DON抗体构成组装体Au@Ag NPs-4-MBA-抗体2作为SERS探针2,修饰T-2抗体构成组装体Au@Ag NPs-4-MBA-抗体3作为SERS探针3;其次,将另一部分SERS增强基底表面修饰拉曼信号分子DTNB,然后分别在其表面修饰AFB1抗体构成组装体Au@Ag NPs-DTNB-抗体4作为SERS探针4,修饰FB1抗体构成组装体Au@Ag NPs-DTNB-抗体5作为SERS探针5,修饰OTA抗体构成组装体Au@Ag NPs-DTNB-抗体6作为SERS探针6。将AFB1-BSA和ZEN-BSA混合作为捕获抗原并设置于侧流竞争免疫分析平台检测区1,将FB1-BSA和DON-BSA混合作为捕获抗原并设置于侧流竞争免疫分析平台检测区2,将OTA-BSA和T-2-BSA混合作为捕获抗原并设置于侧流竞争免疫分析平台检测区3。当不存在自由真菌毒素分子时,在抗原-抗体相互作用下,SERS探针1和SERS探针4将固定于检测区1,SERS探针2和SERS探针5将固定于检测区2,SERS探针3和SERS探针6将固定于检测区3,此时3 个检测区域的4-MBA和DTNB拉曼信号均非常强烈。当存在自由真菌毒素分子时,抗体将优先与目标真菌毒素分子相结合,从而脱离相应的SERS探针,经过清洗分离后4-MBA和DTNB拉曼信号显著衰减(图6C)。因此,该方法可实现6 种真菌毒素(AFB1、ZEN、FB1、DON、OTA和T-2)的高精度同步检测,检测限分别为9.6×10-4、6.2×10-3、0.26、0.11、1.57×10-2μg/kg和8.6×10-3μg/kg,将该方法用于玉米中AFB1、ZEN、FB1、DON、OTA和T-2的加标检测,加标回收率分别为83.2%~106.2%、78.9%~97.3%、81.1%~104.5%、79.5%~102.3%、82.7%~97.7%和81.3%~100.5%,该方法检测速度快(小于20 min),检测精度可与液相色谱-质谱联用法相媲美,故该方法是一种很有应用前景的多种真菌毒素同步检测方法。
He Deyun等[86]合成了Au NR作为SERS增强基底,并在其表面修饰FB1适配体互补链作为SERS探针,同时在FB1适配体上修饰拉曼信号分子Cy5.5。当不存在FB1自由分子时,在适配体与其互补链的相互作用下,SERS探针与修饰Cy5.5的FB1适配体结合成一个复合物,此时Cy5.5拉曼信号非常强烈。当存在FB1自由分子时,修饰Cy5.5的FB1适配体优先与FB1分子结合,从而与SERS探针脱离,经过清洗分离后Cy5.5拉曼信号显著衰减(图6D)。因此,该方法可实现FB1的高精度检测,检测限为3.0 pg/mL(3.0×10-3μg/kg),将该方法用于玉米中FB1的加标检测,加标回收率为92%~107%,该方法检测精度可与液相色谱-质谱串联法相媲美。
SERS间接检测技术在食品中检测FBs、ZEN和DON的应用如表7所示。
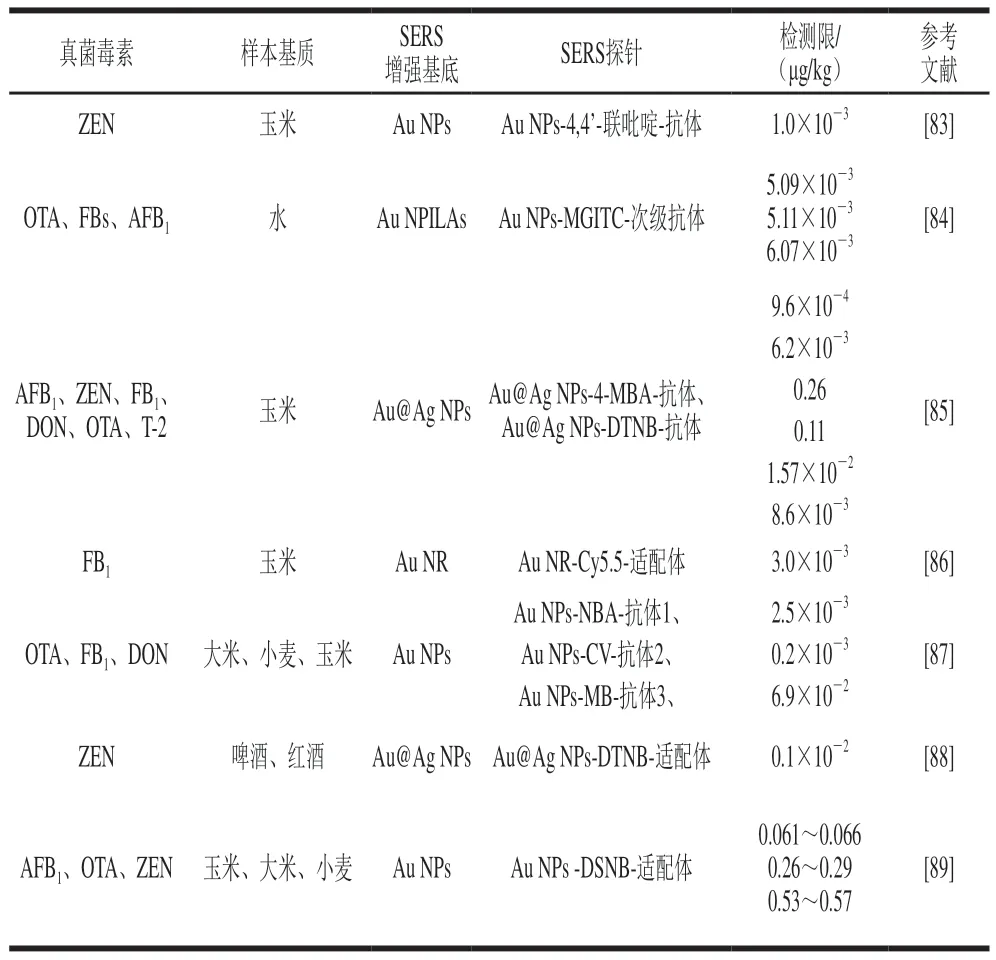
表7 SERS间接检测技术检测食品中FBs、ZEN和DON的方法Table 7 Labeled SERS methods for detecting FBs, ZEN, and DON in foods
4 结 语
作为一种新兴的检测分析技术,SERS能够提供丰富的分子“指纹图谱”信息,且具有灵敏度高、检测速度快、操作简单、不受水分子干扰等优点,目前已成为食品安全检测领域的研究热点。本文重点介绍了近年来SERS技术在食品常见真菌毒素(AFs、OTA、ZEN、FBs和DON等)检测中的应用情况,且SERS技术在真实样本中的分析能力和准确性在已这些研究中获得了证实。然而,将SERS技术真正应用于现场分析仍存在许多问题亟待解决:1)SERS增强基底在SERS检测中发挥着至关重要的作用,然而大规模制备具有均匀SERS活性的基底仍然是一个重大挑战。因此,在未来的研究中需要进行更严格的试验来探究批量制备之间的差异和大规模制备的可行性,同时将半导体材料引入贵金属SERS增强基底以获得更好的性能。2)目前已广泛应用的抗体和适配体仅能特异性识别常见的真菌毒素,很大程度上限制了SERS技术的检测范围。因此,在未来的研究中有必要将识别元件的范围进一步扩展到其他亲和剂,如分子受体、聚合物和多肽等,而不是仅局限于抗体和适配体,这将有助于拓宽真菌毒素的检测范围。3)食品中的复杂基质对目标真菌毒素分子SERS信号的严重干扰,是SERS技术从实验室走向现场分析的又一大障碍。因此,在未来的研究中需要开发高性能的化学计量学算法,以实现从复杂、海量的光谱数据中提取关键信息,从而提高定性与定量分析模型的精度。4)目前尚未建立食品中真菌毒素的拉曼光谱“指纹图谱”数据库,这为SERS现场快速检测带来了较大的困难。因此,在未来的工作中需要广泛地收集和汇总真菌毒素的拉曼光谱“指纹图谱”,建立可搜索、可操作的数据库和网络平台,打破时间和区域的界限,实现研究机构资源共享,赋能真菌毒素现场快速检测技术。

