基于UPLC指纹图谱的西洋参饮片、标准汤剂、配方颗粒的质量相关性研究
马智玲,陈敬然,杜微波,张志强,沈建梅
(1.中国中医科学院中药研究所,北京 100700;2.北京康仁堂药业有限公司,北京 101301;3.中药配方颗粒关键技术国家地方联合工程研究中心,北京 101301;4.北京市中药配方颗粒工程技术研究中心,北京 101301)
西洋参为五加科植物西洋参PanaxquinquefoliumL.的干燥根,具有补气养阴、清热生津等功效[1],主要包括三萜皂苷、多糖、黄酮、甾体、蛋白质、脂肪、挥发油、维生素、微量元素等化学成分[2-3],现代研究表明这些化学成分具有显著的抗肿瘤、抗缺氧、抗疲劳、抗病毒、抗氧化等药理活性[4-5],能够有效改善和治疗多种疾病。
西洋参配方颗粒以标准汤剂作为物质基础,经水提、浓缩、干燥和制粒后,失去了原有饮片的外观形态,在加热过程中,部分不耐高温的化学成分可能发生变化,且2020年版《中华人民共和国药典》(一部)“西洋参”项下仅限于对单个人参皂苷的含量控制,未对其他药理活性成分及配方颗粒制备过程中的物质转化进行质控,然而中药发挥疗效通常取决于有效成分的综合作用。故针对西洋参饮片、标准汤剂及配方颗粒的物质传递过程中各有效成分进行质量相关性研究尤为重要。
目前,关于西洋参的质量研究主要集中于药材和饮片[6-8],而西洋参服用方式多为另煎兑服或配方制剂,对于西洋参及其他配方颗粒中物质的量值传递规律的现有研究中,通常采用相似度、峰相对保留时间及峰数目等方式进行定性评价[9-12],或者采用传统的指标成分转移率进行定量评价[13-15],而采用指标成分转移率进行定量评价时需要具有对照品进行随行参照,对于无对照品参照的成分,无法有效获取相应物质传递的量值情况,极大地限制物质传递规律的评价。汤成成等[9]与刘野婷等[13]采用HPLC法建立了西洋参标准汤剂及配方颗粒的指纹图谱,研究表明各特征峰均能够稳定存在,但二者的分析时间较长,且未对饮片至标准汤剂和配方颗粒过程中的化学成分变化情况和传递规律进行分析。因此本研究采用的高效液相色谱(UPLC)指纹图谱方法,建立西洋参饮片、标准汤剂、配方颗粒的UPLC指纹图谱,不仅可以评估中药材的质量,还可以评估不同制剂之间的质量相关性、相似性和量质传递规律,既省时省力又能实现定性和定量控制,可为中药的药理研究和临床应用提供重要的数据支持。
1 仪器与材料
LC-30AD超高效液相色谱仪,TUV Detector紫外检测器,均由日本岛津公司提供;Agilent 6530 Q-TOF高分辨飞行时间质谱仪,美国Agilent公司提供;JY20002百分之一天平,上海舜宇恒平科学仪器有限公司提供;ME104E万分之一天平,上海梅特勒·托利多仪器有限公司提供;KQ-500DB超声波清洗器,昆山市超声仪器有限公司提供;电子恒温水浴锅DZKW-4,北京中兴伟业仪器有限公司提供。色谱柱Thermo Accucore C18(2.1 mm×150 mm,2.6 μm),赛默飞世尔科技(中国)有限公司提供。
色谱纯乙腈,赛默飞世尔科技(中国)有限公司提供;蒸馏水,广州屈臣氏食品饮料有限公司提供;分析纯甲醇,国药集团化学试剂有限公司提供。
对照品详细信息见表1。18批西洋参饮片(编号 :Y1—Y18)均经北京康仁堂药业有限公司王孝涛传承工作室于立伟执业药师鉴定为五加科植物西洋参PanaxquinquefoliumL.的干燥根,饮片产地见表2。西洋参标准汤剂(编号:D1—D18)及配方颗粒(编号:K16—K18)样品由18批饮片一一对应制备。

表1 对照品信息表
表2 样品信息表
2 实验方法
2.1 色谱条件
色谱柱:Thermo Accucore C18(2.1 mm×150 mm,2.6 μm);以乙腈(A)-水(B)为流动相,梯度洗脱程序为0~8 min,5%A→20%A;8~14 min,20%A;14~20 min,20%A→26%A;20~28 min,26%A;28~29 min,26%A→30%A;29~38 min,30%A→40%A;38~48 min,40%A→43%A,检测波长为203 nm,流速为0.4 mL/min。理论板数按人参皂苷Rb1峰计算不得低于10 000。
2.2 对照品溶液的制备
取西洋参对照药材1.0 g,置于锥形瓶中,加水25 mL,加热回流30 min,过滤,取续滤液10 mL于20 mL容量瓶中,加甲醇定容至刻度线,超声处理(功率为250 W,频率为40 kHz)30 min,取出,冷却,摇匀,过滤,取续滤液作为药材对照品溶液。另取人参皂苷Rg1,Re,Rb1对照品适量,精密称定,加乙腈-水(体积比为20∶80)混合溶液分别制成质量浓度为15 μg/mL的人参皂苷Rg1,0.40 mg/mL的人参皂苷Re,0.50 mg/mL的人参皂苷Rb1的溶液,作为对照品溶液。
2.3 供试品溶液的制备
按要求从西洋参饮片、标准汤剂、配方颗粒中取适量样品,研细,精密称定,置于具塞锥形瓶中,精密加入50%(体积分数,下同)甲醇50 mL,密塞,称定质量,超声处理(功率250 W,频率40 kHz)30 min,冷却,再称定质量,用50%甲醇补足减失的质量,摇匀,过滤,取续滤液,即得。其中饮片称样量为3.0 g,标准汤剂、配方颗粒及阴性样品称样量为0.5 g。
3 结果分析和评价
3.1 含量测定
3.1.1 专属性试验
分别精密吸取“2.2”项混合对照品贮备液、空白溶剂和“2.3”项阴性样品、西洋参配方颗粒供试品溶液,按“2.1”项检测,结果表明供试品色谱与混合对照品色谱在同一保留时间处有相同色谱峰,空白溶剂及阴性样品无干扰,表明该方法专属性良好。
3.1.2 精密度试验
精密吸取“2.2”项混合对照品溶液,按“2.1”项色谱条件连续进样6次,计算3号峰人参皂苷Rb1峰面积的RSD为0.37%,表明仪器精密度良好。
3.1.3 重复性试验
取西洋参配方颗粒(编号为K16)6份,按“2.3”项方法处理,进样检测,计算人参皂苷Rg1,Re,Rb1总含量的RSD为0.80%,表明方法重复性良好。
3.1.4 稳定性试验
取“2.3”项下西洋参配方颗粒供试品溶液1份,于0,2,4,8,12,24 h测定,计算人参皂苷Rg1,Re,Rb1峰面积的RSD分别为3.0%,1.6%,1.9%,表明供试品溶液在24 h内稳定性良好。
3.1.5 加样回收率试验
取人参皂苷Rg1,Re,Rb1对照品适量,精密称定,加50%甲醇溶液制成每1 mL含人参皂苷Rg19.30 μg,Re 101.37 μg,Rb1386.12 μg的混合对照品储备液。取西洋参配方颗粒(编号为K16)粉末适量9份,每份约0.25 g,精密称定,分为3组,分别精密加入人参皂苷Rg1,Re,Rb1混合对照品储备液5,10,15 mL,精密加入50%甲醇溶液45,40,35 mL,按“2.3”项方法制成加样回收供试品溶液9份,按“2.1”项色谱条件进样测定,计算加样回收率,结果见表3。人参皂苷Rg1,Re,Rb1的平均回收率分别为100.2%,97.8%,97.2%,回收率结果均在92%~105%,RSD均小于3.0%,表明该方法准确可靠。
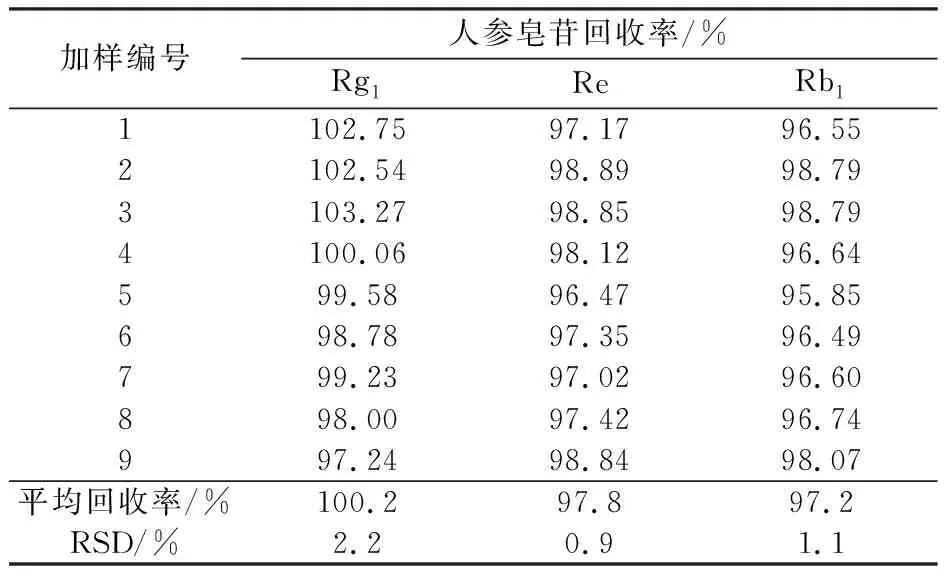
表3 回收率试验结果
3.1.6 线性关系考察
取人参皂苷Rg1,Re,Rb1对照品适量,精密称定,加50%甲醇溶液制成人参皂苷Rg1系列对照品溶液(0.002 60,0.005 10,0.010 20,0.020 50,0.041 0,0.082 0 mg/mL)、人参皂苷Re系列对照品溶液(0.010 4,0.020 9,0.052 2,0.104,0.209,0.522 mg/mL)、人参皂苷Rb1系列对照品溶液(0.092,0.153,0.256,0.426,0.710,1.184,1.973 mg/mL),分别吸取10 μL进样,测定其峰面积,以质量浓度(x)为横坐标,峰面积(y)为纵坐标,计算回归方程。结果如表4所示,表明人参皂苷Rg1,Re,Rb1在各自的线性范围内线性关系良好。

表4 线性关系结果表
3.1.7 样品含量测定
分别精密吸取“2.2”“2.3”项混合对照品和供试品溶液10 μL,按“2.1”项色谱条件测定,计算人参皂苷Rg1,Re,Rb1的总量。西洋参饮片人参皂苷Rg1,Re,Rb1总量范围为4.6%~6.3%;标准汤剂总量范围为6.2%~10.2%,转移率范围为49%~91%,依据制成量折算成配方颗粒总量范围为4.1%~6.8%;3批颗粒的总量范围为5.0%~5.5%,转移率区间为55.6%~61.0%,均在标准汤剂标准区间之内。说明饮片、标准汤剂、配方颗粒制备过程工艺成熟、稳定,能够保证配方颗粒的临床药效。
3.2 指纹图谱
3.2.1 方法学验证
3.2.1.1 精密度试验
精密吸取“2.3”项同一供试品(编号为K16)溶液,按“2.1”项色谱条件连续进样6次,以3号特征峰人参皂苷Rb1为参照峰,计算各共有峰相对保留时间和相对峰面积的RSD,结果均小于3.0%,表明仪器精密度良好。
3.2.1.2 重复性试验
将“3.1.3”所获得的色谱图,以3号特征峰人参皂苷Rb1为参照峰,计算各共有峰相对保留时间和相对峰面积的RSD,结果均小于3.0%,表明方法重复性良好。
3.2.1.3 稳定性试验
将“3.1.4”所获得的色谱图,以3号特征峰人参皂苷Rb1为参照峰,计算各共有峰相对保留时间和相对峰面积的RSD,结果均小于3.0%,表明供试品溶液在24 h内稳定性良好。
3.2.2 指纹图谱的建立
按“2.3”项供试品溶液制备方法分别制备18批次的西洋参饮片、标准汤剂及3批次的配方颗粒供试品溶液,按“2.1”项色谱条件进行检测,记录色谱图。导入“中药色谱指纹图谱相似度评价系统(2012版)”,进行色谱图匹配,分别得到三者的指纹图谱共有模式,同时分别生成西洋参饮片、标准汤剂及其配方颗粒的对照图谱,结果见图1—图4。三者的指纹图谱共确定了8个共有峰。并通过对照品指认了其中5个峰,分别为峰1(人参皂苷Rg1),峰2(人参皂苷Re)、峰3(人参皂苷Rb1)、峰4(人参皂苷Rc)和峰6(人参皂苷Rd)。

图1 西洋参饮片UPLC指纹图谱Fig.1 UPLC fingerprint of American Ginseng pieces

图2 西洋参标准汤剂UPLC指纹图谱Fig.2 UPLC fingerprint of American Ginseng standard decoctions

图3 西洋参配方颗粒UPLC指纹图谱Fig.3 UPLC fingerprint of American Ginseng formula granules

图4 西洋参饮片、标准汤剂及配方颗粒的对照指纹图谱Fig.4 Reference map of American Ginseng pieces, standard decoctions and formula granules
根据所获得色谱图,确定西洋参指纹图谱的评价方式:供试品色谱中应呈现8个特征峰,并应与对照药材参照物色谱峰中的8个特征峰保留时间相对应,与人参皂苷Rb1峰相应的峰为S峰,计算各特征峰与S峰的相对保留时间,峰1、峰2相对保留时间应在规定值的±20%范围之内,其余峰相对保留时间应在规定值的±5%范围之内,规定值分别为0.45(峰1)、0.46(峰2)、1.00(峰S)、1.02(峰4)、1.07(峰5)、1.09(峰6)、1.13(峰7)、1.22(峰8)。
3.2.3 指纹图谱的辨识
取供试品溶液,按“2.1”色谱条件,利用高效液相串联高分辨飞行时间质谱仪获得其质谱图,通过对特征图谱的紫外光谱信息及所采集的一级质谱图信息的研究,同时参考文献对西洋参中的主要化学成分进行结构推测,并配制主要化学成分人参皂苷Rg1,Re,Rb1,Rc,Rd的对照品溶液,按色谱条件进行检测比对,推断供试品溶液特征图谱中各特征峰,结果见图5、表5及图6所示。

图5 对照品峰指认图谱Fig.5 Peak identification atlas of reference substance

图6 西洋参配方颗粒203 nm色谱图、阳离子总离子流图Fig.6 Chromatogram and total cation flow diagrams at 203 nm of American Ginseng formula granules

表5 西洋参配方颗粒指认化合物
通过与对照品对比,确定峰1为人参皂苷Rg1、峰2为人参皂苷Re、峰3为人参皂苷Rb1、峰4为人参皂苷Rc、峰6为人参皂苷Rd(见图5)。
3.2.4 相似度评价
分别将不同批次的西洋参饮片、标准汤剂及其配方颗粒的指纹图谱与相应的对照指纹图谱相比较,结果见表6。不同批次西洋参三者的指纹图谱与相应的对照图谱的相似度范围分别为0.976~1.000,0.988~1.000和0.995~0.999。将三者的对照指纹图谱进行相似度分析,结果见表7。西洋参饮片的8个共有峰在西洋参标准汤剂及配方颗粒中均有所体现,三者的对照指纹图谱的相似度达到0.95以上,表明西洋参饮片、标准汤剂及其配方颗粒指纹图谱非常相似,在化学成分种类上具有一致性,差异很小。西洋参配方颗粒的8个共有峰在西洋参饮片中均可追溯,传递过程中没有出现色谱峰丢失的情况,表明西洋参配方颗粒的质量较稳定,可以代替饮片应用于临床。

表6 18批西洋参饮片、标准汤剂及其配方颗粒相似度结果

表7 西洋参饮片、标准汤剂及其配方颗粒对照指纹相似度结果
3.3 量值传递分析
3.3.1 饮片至标准汤剂物质传递分析
按照“3.2.2”项获得18批西洋参饮片及标准汤剂的色谱图,以样品浓度、出膏率和8个共有特征峰峰面积按公式(1)计算K值,分析饮片至标准汤剂物质传递情况,结果见表8。并按公式(2)计算已知峰的转移率,结果见表9。结果表明K值能够科学地分析标准汤剂的物质量值传递规律,且该K值的获取无需成分对照品的引入,分析更加简便。

表8 18批西洋参饮片至标准汤剂的K值

表9 18批西洋参饮片至标准汤剂含量转移率
(1)

(2)
人参皂苷Rg1,Re,Rb1,Rc,Rd的K值分别为0.12~0.35,0.12~0.36,0.17~0.50,0.15~0.49和0.17~0.56。对于含量转移率平均值和K值平均值,人参皂苷Rg1为0.15和0.17;人参皂苷Re为0.16和0.18;人参皂苷Rb1为0.18和0.21;人参皂苷Rc为0.25和0.20;人参皂苷Rd为0.30和0.23。由于18批次标准汤剂与饮片检测条件存在一定差别,因此K值与含量转移率数值存在略微区别,但K值与含量转移率的趋势一致,表明在不需要使用对照品的前提下,K值基本能描述多种成分物质的变化趋势。
西洋参标准汤剂8个特征峰的K值范围较大,分析其原因主要是目前原料的质量差异较大导致的。若以该范围值作为参照,则会出现工艺偏差。鉴于原料质量差异问题不可避免,因此选择符合标准汤剂范围的同批次的中药材饮片制备得到的标准汤剂K值作为参照,对工艺研究进行质控,保证所得终产品与标准汤剂的一致性。
西洋参作为名贵的滋补药材,具有补气养阴,清热生津之功效。现代研究认为,西洋参中的皂苷类成分既是其功效成分也是其主要活性物质。通过分析西洋参标准汤剂的8个特征峰的18批次K值,除个别批次外都小于0.30,其中特征峰多为皂苷类成分,可知西洋参皂苷类成分转移的趋势基本一致。因此可以选择对人参皂苷Rg1,Re,Rb1,Rc,Rd进行控制,进而控制西洋参中皂苷类成分的转化。故确定西洋参的工艺关键控制成分为峰1(人参皂苷Rg1)、峰2(人参皂苷Re)、峰3(人参皂苷Rb1)、峰4(人参皂苷Rc)、峰6(人参皂苷Rd)代表的成分。
3.3.2 饮片、配方颗粒全过程物质传递分析
以同批次标准汤剂中的K值均值作为可接受转化程度的标准对生产工艺进行筛选,筛选出最佳工艺条件。在该工艺条件下制得3批西洋参配方颗粒,3批次西洋参配方颗粒的工艺过程中的各中间产物以及最终西洋参配方颗粒的峰1—峰4和峰6的K值结果如表10所示。

表10 西洋参工艺研究过程中的K值变化
3批西洋参配方颗粒在研究过程中的各峰量值传递的K值趋势一致。通过K值确定的工艺关键控制点对颗粒制备过程进行质控后,峰1、峰2、峰3、峰4及峰6的K值均与相应批次标准汤剂K值接近,并均在标准汤剂范围内。可以确定制备得到的颗粒与标准汤剂药效物质基础一致性较好,因此,进一步确定上述3批次的工艺条件制备得到的颗粒均符合要求。综上可知:采用K值确定的工艺关键属性能够保证配方颗粒临床应用的药效及安全性。
2021年国家药监局发布的《中药配方颗粒质量控制与标准制定技术要求》中,明确要求中药材、中药饮片、中间体、中药配方颗粒特征图谱或指纹图谱应具相关性,并具有明确的量质传递规律[16]。K值的获取无需成分对照品的引入就能够进行多成分分析,科学合理地评价西洋参饮片中的各成分的量值传递规律。因此,可以用于实现西洋参中药配方颗粒、其中间产物、含西洋参饮片的经方或者其中间产物中各类已知或未知物质的量值传递规律的评价,更好地保证西洋参配方颗粒或经方的临床应用的安全性。西洋参饮片、冻干粉、配方颗粒的内在质量具有相关性,因此,可以通过加强对原料药的质量控制,达到获得稳定均一的中药配方颗粒的目的。
4 结 语
该研究对西洋参从饮片到配方颗粒的生产环节中人参皂苷Rg1,Re,Rb1总量及指纹图谱采用UPLC法同时测定,并通过对指纹图谱的测定结果进行相似度和K值分析。所得结论如下。
1)人参皂苷Rg1,Re,Rb1总含量及转移率范围均符合量值传递规律,总量质量相关性较强;西洋参饮片、标准汤剂、配方颗粒的特征图谱基本一致,均标示8个主要特征峰,且相似度均在0.90以上,表明西洋参配方颗粒与标准汤剂的成分基本一致,在生产过程中物质传递良好。
2)所构建的评价方法可降低检测成本,测定方法通过方法学验证,简单便捷,结果准确可靠,能够作为内控质量标准。
3)K值的提出克服了现有技术中在无对照品参照的情况下,不能够有效用于西洋参各种物质的量值传递规律的评价的问题,从而提供一种评价西洋参物质量值传递规律的方法;该评价指标无需对照品,也能够有效对西洋参饮片制备可得到的样品中的物质的量值传递规律进行评价,也可为其他品种的配方颗粒、经典名方或其他制剂形式的量质传递规律的研究提供了思路。
中药发挥疗效通常取决于有效成分群的综合作用,本研究仅以西洋参中重要活性成分皂苷为研究对象,未对多糖类、黄酮类等其他化学成分进行质量控制,故后续研究应着重对其他类成分进行方法的建立及质量控制,以更全面、准确地把控药物生产过程中药效成分的转移,从而发挥更好的疗效。

