植物病原真菌对杀菌剂抗性的研究进展
吴小美, 王海霞, 云英子, 马忠华*
(1. 浙江大学生物技术研究所,浙江省作物病虫生物学重点实验室,杭州 310058;2. 镇江市植保植检站,镇江 212002;3. 福建农林大学植物保护学院,闽台作物有害生物生态防控国家重点实验室,福州 350002)
杀菌剂在植物病害防治中发挥着重要作用,然而随着药剂的长期使用,病原菌抗药性问题也日趋严重,成为制约药剂防治效果和使用寿命的重要因素之一。20世纪70年代之前所使用的杀菌剂几乎都是保护性杀菌剂,作用位点多,不易引发病原菌产生抗药性,但是随着杀菌剂的发展进入高效、内吸、作用位点较为单一的内吸型杀菌剂时代以来,杀菌剂抗性问题愈发普遍和严重,已成为化学防治所面临的一大挑战。
由于病原菌对杀菌剂的抗性可以随着病原菌的繁殖而稳定遗传给后代,病原菌的抗性群体在药剂的选择压力下会逐步扩展,进而使得病菌群体对杀菌剂的敏感性整体下降。病原菌的抗药性主要是由病原菌的单个或者多个基因突变造成的,在自然条件下抗性菌株在病菌群体中出现的频率很低,因此不会影响杀菌剂对病害的防治效果。但是,由于杀菌剂的连续使用,在持续的药剂选择压力下,敏感菌株生长繁殖受到抑制,抗药菌株得以迅速生长和繁殖,在病菌群体中逐渐占优势地位,从而导致杀菌剂的防效下降甚至失效。抗性菌株的适合度(包括温度适应性、产孢和致病能力等)决定了抗性菌株群体的发展趋势。如果抗性菌株适合度低,在自然环境中生存力弱,那么一旦停止使用杀菌剂,抗性菌株的种群比例就会下降;但是如果抗性菌株与敏感菌株的适合度相似,在自然界能够保持良好的生长繁殖和致病能力,则容易导致田间杀菌剂抗性问题[1]。总体来说,病原菌对杀菌剂产生抗性的机制主要包括以下几种情况:1)杀菌剂作用靶点突变导致药剂与靶标的结合能力降低;2)杀菌剂靶标基因的过量表达;3)病菌对杀菌剂外排能力或代谢分解能力增强。除此之外,近来研究发现,表观遗传在病菌抗药性中也发挥重要作用。
本文对几类常用杀菌剂的抗药性现状及抗性机制进行综述,包括:苯并咪唑类杀菌剂(benzimidazole,BZD)、肌球蛋白抑制剂(myosin inhibitor)、甾醇脱甲基抑制剂(sterol demethylation inhibitor,DMI)、QoI类抑制剂(quinone outside inhibitor,QoI)、琥珀酸脱氢酶抑制剂(succinate dehydrogenase inhibitor,SDHI)以及二甲酰亚胺类杀菌剂(dicarboximide,DC)。在此基础上,介绍几种杀菌剂抗性快速检测技术的研究进展。
1 杀菌剂抗性的分子机制
1.1 苯并咪唑类杀菌剂
苯并咪唑类杀菌剂是一类以苯并咪唑环为母体的内吸广谱性杀菌剂,其代表药剂有苯菌灵、多菌灵以及甲基硫菌灵等。该类药剂自20世纪60年代投入市场以来,在多种病害防控中发挥了重要作用。该类杀菌剂靶向病菌的β-tubulin蛋白,通过抑制微管蛋白组装而阻断细胞分裂[2]。由于长期使用,目前已有100多种真菌对苯并咪唑类杀菌剂产生了抗性[3]。病菌对该类药剂的抗性多由菌体内靶蛋白的突变所致(表1)。在大多数抗性菌株中,β-tubulin基因的单碱基突变导致单个氨基酸的改变,影响药剂与靶标的结合能力,进而产生抗药性[4-5]。研究发现,β-tubulin基因上第6、50、167、198、200、235或者第240位密码子的突变均会导致病原菌对苯并咪唑类杀菌剂产生抗性[1,6-7],其中以E198A/G/K/Q和F200Y突变最为常见[6],且不同位点氨基酸的突变导致的菌体抗药性水平不同。在实生链核盘菌Moniliniafructicola中,β-tubulin上第6和第198位氨基酸的突变分别导致菌株产生低水平和高水平抗药性[8];在苹果黑星病菌Venturiainaequalis中,β-tubulin上第198和第200位氨基酸的突变分别导致菌株产生中等水平和高水平抗性[9];在禾谷镰孢复合种Fusariumgraminearumcomplex中,β-tubulin上F167Y或F200Y突变导致菌株产生中等水平抗性[10-11],E198A或E198L突变则导致病菌的高水平抗性[12-13]。另外,β-tubulin基因同一位点密码子的不同突变也会使菌株产生不同水平的抗性;例如,在Tapesiayallundae的抗性菌株中,β-tubulin上第198位氨基酸如果由谷氨酸突变为丙氨酸、甘氨酸、赖氨酸或者谷氨酰胺,可导致突变菌株对该类药剂产生不同水平的抗性,抗性菌株EC50的变化范围为0.5~25 μg/mL[14]。
Duan等[15]对2017年-2018年从我国6省份黄瓜上采集的619株黄瓜褐斑病菌Corynesporacassiicola进行靶基因β-tubulin序列比较分析,首次发现含有3种双突变E198A和M163I,E198A和F167Y,以及E198A和F200S的抗性菌株,其中,双突变E198A和M163I分布广、频率高,成为C.cassiicola优势抗性种群。与E198A单突变菌株相比,3种双突变菌株对苯并咪唑类药剂的抗性水平更高,且对多菌灵、苯菌灵和噻菌灵产生很强的交互耐药性。该研究表明,随着药剂使用量的增加和使用时间的延长,对苯并咪唑中等水平抗性的单突变抗性菌株可能会进一步演变为高水平抗性的双突变菌株。
通常情况下,与敏感菌株相比,抗性菌株的适合度可能有不同程度的改变。Yan等[16]通过实验室药剂驯化诱导获得了串珠镰孢Fusariummoniliforme抗性菌株,发现其β-tubulin上第5位氨基酸发生突变同时导致病菌对低温的敏感性增强。在田间发现的实生链核盘菌M.fructicola的多菌灵抗性菌株β-tubulin上第6位氨基酸发生突变后对低温也更敏感[8]。然而,有些抗性菌株对高温表现敏感,例如,M.fructicolaβ-tubulin上第198位突变以及核果链核盘菌M.laxa第240位氨基酸突变菌株都对高温敏感[8,17],此外,从田间分离到的抗甲基硫菌灵的木瓜蒂腐病病菌Lasiodiplodiatheobromae的产孢能力明显低于敏感菌株[18]。任璐等[19]对室内诱导的抗甲基硫菌灵的瓜类白粉病菌Podosphaerafusca的适合度进行研究发现,在无药剂压力下,突变体的产孢量、孢子萌发率、侵染频率及引起的病情指数均显著低于亲本。当前,苯并咪唑类杀菌剂仍然在多种作物上登记使用,因此,监测该类杀菌剂的抗性、解析新的抗性机制对药剂的合理使用仍有现实意义。
1.2 肌球蛋白抑制剂
在真核细胞中,肌球蛋白与丝状肌动蛋白及其伴侣蛋白结合,通过水解ATP将生物能转化为机械力,而机械力对细胞分裂、囊泡运输等各种细胞活动至关重要[105]。因此,肌球蛋白可以作为一个全新的药靶,用于开发新型杀菌剂。氰烯菌酯是江苏农药研究所有限公司研发的对镰刀菌引起的作物病害(例如小麦赤霉病、水稻恶苗病)有特效的新药剂,该药剂直接作用于病原菌的Ⅰ型肌球蛋白(MyoⅠ),并抑制其ATP酶活性[106-107]。对禾谷镰孢Fusarium graminearumMyoⅠ晶体结构的分析表明,氰烯菌酯的结合位点位于MyoⅠ与肌动蛋白结合的变构口袋中,当氰烯菌酯与MyoⅠ结合时,变构口袋变形,使得MyoⅠ不能与肌动蛋白结合,进而使得MyoⅠ失去活性[108]。由于MyoⅠ对镰刀菌生长和真菌毒素生物合成至关重要,MyoⅠ抑制剂不仅抑制真菌生长,还显著减少脱氧雪腐镰刀菌烯醇的产生[106]。
浙江大学生物技术研究所作物病虫生物学重点实验室从2008年开始,连续10多年监测田间赤霉病菌对氰烯菌酯的抗性情况,到目前为止,没有发现田间赤霉病菌对氰烯菌酯产生抗药性问题。与赤霉病菌不同的是,目前田间已经发现水稻恶苗病病原藤仓镰孢Fusarium fujikuroi对氰烯菌酯产生抗性(表1)。Wu等[21]检测了2017年-2018年浙江省F.fujikuroi对氰烯菌酯的抗性情况,结果发现,其对氰烯菌酯的抗性频率从2017年的18%增加到2018年的47%。抗性机制研究发现,F.fujikuroi的MyoⅠ密码子218或219位发生突变导致其产生抗药性。
连锁零售业实体企业的产业在商品流通的过程中,展现了一条完整的产业链。这个时候,就需要针对实际情况,构建合作共同体。但是在传统的理念上,连锁性零售业实体企业仅仅就担负了销售商品的主要任务,而且这样就显得销售渠道过于单一。因此,这个时候,不少企业就开始加入了零售业的电商范畴,还有不少代理商,直接在天猫与淘宝平台上展开销售业务,这样不仅压缩了实体零售企业利润空间,而且也提升了实体零售企业的竞争力。
1.3 甾醇脱甲基抑制剂(DMI)
DMI类是最大的一类杀菌剂,靶向真菌麦角甾醇的合成途径,其作用靶标为CYP51基因编码的14α脱甲基酶,抑制麦角甾醇前体24-亚甲基二氢羊毛甾醇(24-methylenedihydrogenlanosterol)的l4位上脱甲基化[109]。自20世纪70年代投入市场以来,多种植物病原真菌对DMI类杀菌剂产生抗药性,包括:大麦白粉病菌Erysiphe graminisf.sp.hordei[22]、苹果黑星病菌Venturia inaequalis[40,110]、指状青霉Penicillium digitatum[36,111]、瓜类白粉病菌P.fusca[112]、樱桃叶斑病菌Blumeriella jaapii[41]、实生链核盘菌M.fructicola[44]、香蕉黑条叶斑病菌Mycosphaerella fijiensis[23]、玉米黑粉病菌Ustilago maydis[24]以及小麦发酵壳针孢Zymoseptoria tritici[25,27]等。研究表明,植物病原真菌对DMI的抗性机制主要包括:1)CYP51基因点突变;2)CYP51基因高表达(表1)。
1.3.1CYP51基因点突变导致对DMI的抗性
由于DMI类药剂长期用于防治小麦病害,20世纪90年代首先在欧洲发现了抗DMI的小麦发酵壳针孢Z.tritici菌株;抗性菌株Cyp51上至少存在17种氨基酸突变类型,包括第107位天冬氨酸突变为缬氨酸、第134位天冬氨酸突变为甘氨酸以及第136位缬氨酸突变为丙氨酸等[26,28]。对2019年-2020年采自爱沙尼亚的353株大麦柱隔孢叶斑病菌Ramularia collo-cygni的抗性菌株进行CYP51基因测序发现,Cyp51蛋白的氨基酸序列存在6种突变,即I381T、I384T、S459C/Y/T/L,其中第459位丝氨酸突变为半胱氨酸(S459C)最为常见,该位点2019年平均发生频率为80%,2020年为79%[29]。
DMI类药剂对麦类作物的白粉病有良好的防治效果,但由于长期大量使用,很多地区的麦类白粉病菌已对其产生抗性。白粉病菌对DMI类药剂的抗性也是由CYP51基因的点突变所致,目前已经发现的抗性突变位点包括:小麦白粉病菌的S79T、Y136F、K175N以及大麦白粉病菌的Y136F、K147Q、Y137F、S524T等[30-32]。此外,葡萄白粉病菌Uncinula necator对三唑醇的高水平抗性由Cyp51的Y136F突变所致;有趣的是,在自然情况下U.necator中存在A、B两种群体,这两类菌群在产孢能力、致病性和地理分布等方面存在明显差异,A、B两种菌群的Cyp51蛋白第37和156位氨基酸不同,B类菌群相比于A类菌群对三唑类药剂更加敏感,且更易发生第136位氨基酸点突变(Y136F)[33]。由于三唑类药剂的长期使用,在部分法国葡萄园中,含有Y136F点突变的B类菌群抗性菌株已占到病菌群体的90%以上[34,48]。与U.necator存在两个菌群相类似,Tapesia acuformis和T.yallundae是引起麦类眼斑病的2个近缘种。T.acuformis对DMI类中的三唑亚类药剂具有抗性却对咪唑亚类药剂敏感,而T.yallundae对这两亚类药剂均敏感。研究发现,T.yallundae和大多数丝状真菌中Cyp51第180位氨基酸均为苯丙氨酸,而T.acuformis中Cyp51第180位为亮氨酸,可能由于第180位氨基酸的不同导致了这2种病原菌对DMI类药剂敏感性的差异[113]。另外,值得注意的是,同一种病菌的Cyp51上存在多个点突变,不同点突变的组合可以引起病菌对DMI产生不同的抗药性水平[38]。
1.3.2CYP51基因高表达导致对DMI的抗性
已有研究表明,CYP51基因的高表达能够导致病菌对DMI类药剂产生抗性。目前,真菌中存在几种调控CYP51基因高表达的分子机制。在人类病原菌白色念珠菌Candida albicans中,CYP51基因拷贝数的增加导致该基因高表达,进而引起病菌对DMI类药剂产生抗性[35]。在植物病原真菌中,CYP51基因高表达常由基因启动子区的序列变异所致 (表1)。例如,指状青霉P.digitatum抗性和敏感菌株的CYP51基因的编码区序列完全一致,但在抗性菌株的CYP51基因启动子区域有5个串联的126bp特异性重复序列,而在敏感菌株中只有1个;将抗性菌株的CYP51基因启动子区转化到敏感菌株中,转化子对DMI表现抗性;相反,将抗性菌株中126bp特异性重复序列从5次串联降至2次串联,转化子对DMI的抗性水平也相应下降;表明抗性菌株启动子区域的126bp特异性重复序列的插入引起CYP51基因高水平表达,从而使菌株对DMI产生抗性[36]。此外,在多种植物病原菌抗性菌株中均检测到CYP51基因启动子区的改变,包括:苹果黑星病菌V.inaequalis[40]、樱桃叶斑病菌B.jaapii[41-42]、实生链核盘菌M.fructicola[43-45]和小麦发酵壳针孢Z.tritici[46-47]等。在这些病菌的抗性菌株中,CYP51基因启动子区均发现插入片段,不同病菌中插入片段大小不同,从65bp到几千个碱基不等;插入片段中含有转录调控因子的顺式元件,进而导致CYP51基因高水平表达;但目前在这些病菌中尚没有找到作用顺式元件的转录调控因子。
研究还发现,尽管酿酒酵母Saccharomyces cerevisiae中仅含有1个CYP51基因,但多种病原真菌中含有2~3个CYP51基因[1]。例如,指状青霉中含有2个CYP51基因(PdCYP51A和PdCYP51B),除了先前报道的PdCYP51A启动子区126bp重复串联序列导致的DMI抗性之外,PdCYP51B启动子区的195bp或199bp序列插入同样可以导致对DMI的抗性,并且该插入比PdCYP51A启动子区126bp重复串联序列更为稳定[37-39]。
1.4 QoI类药剂
自从1996年第一个QoI药剂醚菌酯投入市场以来,目前已有21个QoI药剂被成功开发用于防治各类植物病害,然而抗药性问题成为制约该类药剂防效的重要因素。QoI抗性最早发生在德国北部的小麦白粉病菌群体,之后小麦发酵壳针孢Z.tritici中也发生了QoI抗药性问题,目前至少有47种植物病原菌对QoI药剂产生了抗性。
QoI类药剂通过与真菌细胞色素b和c1复合体Qo部位结合而阻断呼吸作用的电子传递,从而抑制真菌的生长[114-115]。在大多数病原真菌的QoI抗性菌株中,细胞色素b基因cyt b的点突变导致了病菌对该类药剂产生抗性,而且第143位的甘氨酸突变为丙氨酸(G143A)是最为常见的突变类型 (表1)。例如,在巴西的中部和南部,稻瘟病菌Pyricularia oryzaeG143A突变类型从2005年占群体的36%上升到2012年的90%[50];在爱沙尼亚,大麦柱隔孢叶斑病菌R.collo-cygni中G143A突变基因型在病菌群体中的比例达到80%[29],导致QoI药剂失去防治效果。此外,第129位或137位上氨基酸突变也可以导致QoI抗性[115]。例如,大豆锈病病菌Phakopsora pachyrhiziCytb上F129L突变导致病菌对QoI产生抗性[52];核桃疮痂病菌 Venturia effusa对QoI的抗性由G137S所致[53];葡萄霜霉病菌Plasmopara viticola的抗性菌株中存在F129L和G143A2种点突变;小麦褐斑病菌Pyrenophora tritici-repentis的抗性菌株中则发现F129L、G137R和G143A3种突变类型[54-55]。研究发现,Cytb不同的点突变类型导致不同的抗性水平,一般情况下,F129L和G137R/S导致病菌对QoI产生中低水平抗性,而G143A则引起高水平抗性[1,15,52]。
研究发现,多数情况下,G143A突变不引起病菌适合度的改变。在灰葡萄孢Botrytis cinerea中,G143A突变的QoI抗性菌株在菌丝生长、产孢和致病性等生物学特性上与敏感菌株类似[60];在葡萄白粉病菌U.necator中,在QoI药剂筛选压力下,G143A突变的QoI抗性菌株在实验室和田间条件下都能够稳定生长,在无药剂筛选的情况下,抗性菌株也可以在田间稳定存在[59];在互隔链格孢Alternaria alternata中,QoI抗性菌株的适合度也没有改变,甚至在一些柑橘品种上QoI抗性菌株的致病力更强[61]。与田间自然产生的抗性菌株不同,在实验室诱导获得的由G143S突变所致的稻瘟病菌抗性突变体的适合度下降[51]。另外,含G143A的Venturia inaequalis、Podosphaera fusca和Phytophthora megasperma抗性菌株,其适合度也有所下降[62]。值得一提的是,研究发现,如果紧邻着CYT b第143位密码子之后有内含子,病菌不容易产生G143A突变。酿酒酵母紧接着G143之后含有1个内含子,在酵母中G143A的点突变使得其后的内含子不能正确剪接,使得菌体不能形成成熟的CYT bmRNA,菌体的呼吸功能受损,在自然条件下难以生存[63]。
除了细胞色素b的点突变外,其他生理生化机制的改变也可能导致菌体对QoI产生抗性。在小麦发酵壳针孢Z.tritici中,交替呼吸途径中交替氧化酶(alternativeoxidase,AOX)的高表达也会导致病菌对QoI药剂敏感性降低[64]。
1.5 琥珀酸脱氢酶抑制剂(SDHI)
琥珀酸脱氢酶抑制剂(SDHI)类杀菌剂作用于病原菌线粒体呼吸系统的复合物Ⅱ(即琥珀酸脱氢酶),通过抑制真菌的呼吸作用,进而抑制病原菌生长。琥珀酸脱氢酶是真菌呼吸链的重要组分,由黄素蛋白SdhA、铁硫蛋白SdhB及2种嵌膜蛋白SdhC、SdhD等4个亚基组成;嵌膜蛋白SdhC和SdhD将SdhA和SdhB固定在内膜上,且具有泛醌还原酶活性[116]。SDHI类杀菌剂通过完全或者部分占据琥珀酸脱氢酶泛醌的位点,抑制了电子从琥珀酸到泛醌的传递,干扰呼吸链上复合体Ⅱ电子传递,阻止其产生能量,进而达到抑制病原菌生长的效果[117]。
20世纪60年代,第一个SDHI杀菌剂萎锈灵进入市场,主要作为种子处理剂,防治担子菌引起的真菌病害。20世纪80-90年代,新一代SDHI杀菌剂灭莠胺、氟酰胺、呋吡菌胺和噻呋酰胺等陆续上市,这4个药剂主要防治水稻病害,防病谱相对较窄。2003年,巴斯夫公司成功研发了第一个内吸广谱性SDHI杀菌剂啶酰菌胺,可用于防治白粉病、灰霉病、茎腐病等多种病害。随后,许多广谱高效的SDHI类杀菌剂陆续上市,目前,已有23种SDHI类杀菌剂投入市场,在植物病害防治中发挥重要作用。随着SDHI类杀菌剂的大量使用,目前Alternaria alternata、A.solani、Botrytis cinerea、Blumeriella jaapii、C.cassiicola、D.bryoniae、 F. graminearum、M.fructicola、P.fusca、Pyrenophora teres、R.collo-cygni、S.sclerotiorum、大蒜匐柄霉叶枯病Stemphylium vesicarium、U.nuda和V.inaequalis等20多种真菌已经对该类药剂产生了抗药性,特别是抗SDHI的灰霉病菌已在世界各地发现[65,67-72,74-76,118]。尽管氟唑菌酰羟胺2019年年底才在我国登记用于防治小麦赤霉病,但在2021年病菌抗药性监测中,Shao等在田间已经检测到高抗该药剂的小麦赤霉病菌[77]。
研究表明,病原菌对SDHI类杀菌剂产生抗药性多是由靶标琥珀酸脱氢酶突变所致,目前已发现至少27种发生在琥珀酸脱氢酶的SdhB、SdhC和SdhD这3个亚基上的氨基酸突变可以导致病菌产生抗药性[65]。其中,以SdhB亚基上泛醌结合位点组氨酸突变为酪氨酸最为常见,也偶有发现组氨酸突变为亮氨酸或者精氨酸(表1)。研究发现,大麦柱隔孢叶斑病菌R.collo-cygni 在SdhB发生N224T、R264P、H266R/Y/L、B-T267I、B-I268V突变,以及SdhC发生T7S、Q8R/P、Q9L、A65P、A81P、N83S、N87S、G91R、A121G、H146R/L、R152M、H153R、K156N、K161N、N164H/P、G167D、G171D、V184L等多种突变,导致病菌对氟唑菌酰胺和啶酰菌胺等SDHI类药剂产生抗性[29,78]。灰葡萄孢SdhD第132位组氨酸突变为精氨酸(H132R)、第230位天冬氨酸突变为亮氨酸(N230I)以及第272位组氨酸突变为亮氨酸(H272L)导致病菌产生抗药性[66]。然而,目前尚未有报道表明SdhA亚基发生突变可引起抗药性。
1.6 二甲酰亚胺类杀菌剂
二甲酰亚胺类杀菌剂是20世纪70年代初推出的一类广谱性杀菌剂,被广泛用于防治B.cinerea、M.fructicola以及Sclerotiniaspp.和Alternariaspp.引起的多种真菌病害。代表药剂有乙烯菌核利、腐霉利、菌核净和异菌脲等。由于二甲酰亚胺类杀菌剂的广泛使用,多种植物病原真菌对该类药剂产生了抗药性,影响了药剂的防效;尤其在灰霉病的防治中,抗性菌株的普遍存在导致该药剂在全世界很多地区失去防效[79-80]。在大多数情况下,田间抗性菌株的适合度没有明显变化,在药剂选择压力下,抗性病菌群体在田间能够快速发展。例如,宋晰等和郑媛萍等测定发现,福建、上海、江苏、山东、辽宁等省份的部分地区的田间病菌群体中,抗二甲酰亚胺类杀菌剂的灰葡萄孢处于优势群体,占79%~90%,表明抗性菌株在田间有很高的适合度[119-120]。
在过去20年中,研究多种丝状真菌对二甲酰亚胺类杀菌剂抗性机制发现,该类药剂能够导致真菌的高渗透甘油(highosmolarityglycerol,HOG)信号途径异常激活,进而抑制病菌生长[121]。从田间采集的抗该类药剂的灰葡萄孢通常由HOG信号途径上组氨酸激酶Bos1点突变所致,目前已经发现BOS1上G278D、I365S/N/R、Q369P+N373S、I365S+T581P、G415D和A493T等点突变均可导致灰葡萄孢对二甲酰亚胺类杀菌剂产生抗性[81-82]。除了灰葡萄孢,A.alternata[83-84]、A.arborescens[86]、A.brassicicola[84]、A.longipes[85]、M.fructicola[87]、Sclerotinia homoeocarpa[88]和S.sclerotiorum[89]等对该类药剂的抗性也由组氨酸激酶上点突变所致。
1.7 多药抗性
多药抗性(multidrugresistance,MDR)通常是指ATP结合盒式转运蛋白(ATP-bindingcassettetransporter,ABC)高水平表达,使得病菌对多种药剂产生抗性。ABC转运蛋白是细胞膜上一类ATP驱动泵,通常由跨膜结构域和胞质侧ATP结合域组成。参与药物运输的ABC转运蛋白能利用水解ATP的能量以主动运输的方式将细胞内药物转运到细胞外。因此,ABC转运蛋白高水平表达可将更多的药剂从病菌的细胞内运输到细胞外,导致病菌对多种药剂产生抗性。目前,在灰霉萄孢B.cinerea[90-91]、黄色镰孢F.culmorum[93-94]、禾谷镰孢F.graminearum[95-96]、小麦发酵壳针孢Z.tritici[97-99]、稻瘟病菌P.oryzae[100]、实生链核盘菌M.fructicola[101]、指状青霉P.digitatum[102-103]和草坪草币斑病病原菌Sclerotinia homoeocarpa[104]等多种病原真菌中发现,ABC转运蛋白基因的过量表达导致病菌对包括DMI在内的多种药剂敏感性下降。在灰葡萄孢中,目前已确定了3种主要的MDR类型,MDR1菌株对咯菌腈、嘧菌环胺和托萘酯表现出耐药性;MDR2菌株对环酰菌胺、放线菌酮、嘧菌环胺等表现抗性;MDR3菌株对多数杀菌剂均表现抗性。研究MDR机制发现,MDR1和MDR2分别由ABC转运蛋白ATRB和MFSM2的过量表达所致[91]。进一步研究发现,MDR1菌株中,调控ATRB的转录因子Mrr1上发生点突变,导致ATRB过量表达[91];此外,MDR1菌株MRR1的第497位含有一个3bp的缺失,也能导致ATRB的高表达水平[92]。MDR2菌株在MFSM2启动子中含有1 326bp的插入片段,导致MFSM2的高水平表达。MDR3来自MDR1和MDR2的自然杂交,MDR3菌株包含MDR1和MDR2的变异类型[91]。德国和法国多个葡萄园的灰葡萄孢群体中MDR菌株的频率超过50%,导致严重的抗药性问题[80]。多药抗性的灰葡萄孢在我国也很普遍[122]。当前,多药抗性仍是杀菌剂抗性治理中的一个重要难题。
1.8 表观遗传调控的病菌抗药性
表观遗传学指在基因的DNA序列没有发生改变的情况下,由DNA序列修饰、组蛋白修饰、非编码RNA、RNA干扰(RNAi)、染色质重塑等因素导致靶标基因表达改变,并最终导致了表型变化[123]。
目前,表观遗传调控人类病原真菌抗药性已经受到高度关注。Calo等[124]研究发现,人类病原真菌卷枝毛霉Mucor circinelloides可能通过RNAi介导对抗真菌药物FK506产生抗性。FK506作用于肽基脯氨酰异构酶FKBP12,形成的FKBP12-FK506复合体抑制菌体内钙调神经磷酸酶的活性。编码FKBP12的fkbA基因或钙调神经磷酸酶2个亚基cnbR或cnaA基因的突变,可以使得病菌对FK506产生抗性。此外,表观遗传变化导致RNAi激活,进而沉默fkbA基因,使菌体也对FK506产生抗性。该研究首次揭示了表观遗传调控真菌的抗药机制。
目前,表观遗传调控植物病原真菌抗药性的研究还鲜有报道。Liu等近来研究发现,戊唑醇能够激活赤霉病菌菌体内高渗透甘油(HOG)激酶信号途径,该途径上被激活的FgHog1激酶进入细胞核,磷酸化转录因子FgSR,FgSR能够结合在FgCYP51基因启动子区含有2个CGAA重复序列的顺式元件上,且磷酸化的FgSR将染色质重塑复合体SWI/SNF招募至药靶基因FgCYP51的启动子区,对染色体进行重塑,移除药靶基因区的核小体。由于核小体是基因转录的障碍,被组蛋白紧密缠绕的DNA是无法与众多转录因子以及活化因子结合的,移除药靶基因区的核小体,促进药靶基因高水平转录,使得病菌对戊唑醇等三唑类药剂产生耐药性。转录因子FgSR突变体对三唑类药剂的敏感性增加上千倍,表明表观遗传因子染色质重塑复合体在病菌对药物敏感性中发挥重要作用[49]。
2 杀菌剂抗性快速检测技术
在杀菌剂的抗性检测中,经典的方法是在离体和/或活体上测定真菌对杀菌剂的敏感性,以此判断病菌是否产生抗药性。但对于大规模抗药性检测来说,传统手段无疑需要大量的时间和精力。随着分子生物学技术的发展,在解析杀菌剂的抗性分子机制基础上,开发分子检测技术是大规模监测病菌群体抗药性的前提。目前,常用杀菌剂快速检测技术包括:聚合酶链式反应(PCR)、PCR-限制性片段长度多态性(PCR-restrictionfragmentlengthpolymorphism,PCR-RFLP)、等位基因特异性PCR(allele-specificPCR,AS-PCR)和环介导等温扩增技术(loop-mediatedisothermalamplification,LAMP)等(表2)。
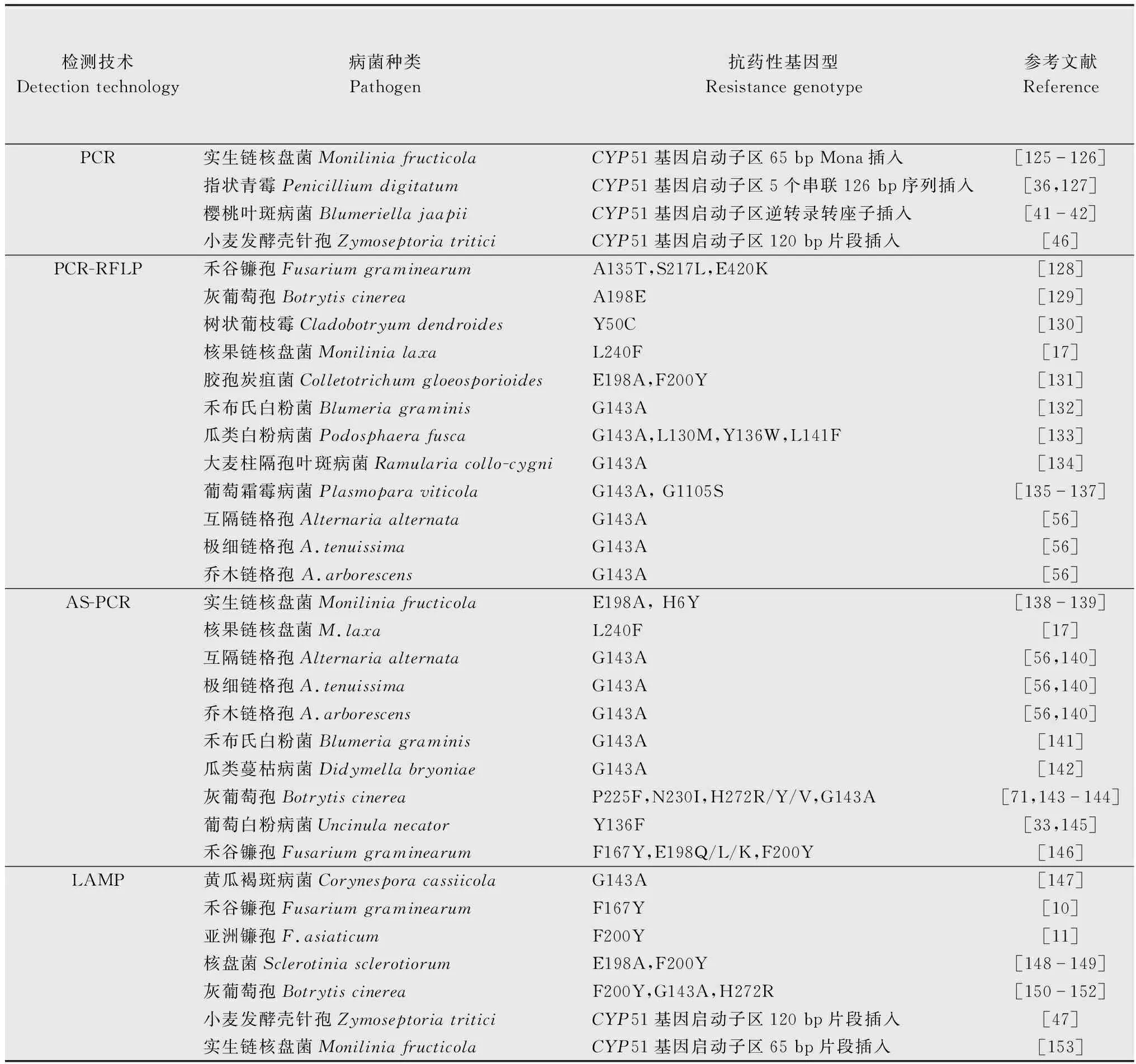
表2 几种常用的抗药性分子检测技术Table 2 Molecular technologies used for rapid detection of fungicide resistance
2.1 PCR
如前文所述,病菌对三唑类药剂产生抗性源于多种病原真菌的CYP51基因启动子区出现特定序列的插入片段导致相应基因的高表达。根据特异的插入片段,可以设计特异的PCR引物,进而快速检测抗药菌株。例如,Luo等[44]研究发现,M.fructicolaCYP51启动子区存在65 bp的Mona片段,导致病菌对DMI药剂产生抗药性;根据该插入片段设计的一组特异引物INS65-F/INS65-R,能快速地从抗性菌株中扩增出1个376 bp的特异性条带,但不能从敏感菌株中扩增出该大小的条带[125-126]。目前,PCR技术已经成功用于鉴定抗DMI类药剂的Penicilliumdigitatum[36,127]、Blumeriellajaapii[41-42]、Z.tritici[46]等病原真菌。
2.2 PCR-RFLP
PCR-RFLP将PCR技术和RFLP分析相结合,可以用于检测由单点突变导致的抗药性。通常,先利用PCR扩增待测目的DNA片段,然后通过DNA限制性内切酶对扩增产物进行酶切,最后经电泳分析目的DNA片段是否被切割分型,进而判断待测样品是否含有抗药性基因型。例如,Li等[128]根据Ⅰ型肌球蛋白基因myosin-5上A135T、S217L和E420K点突变,设计了Fgmyo5-135F/R、Fgmyo5-217F/R和Fgmyo5-420F/R引物,利用这些引物分别扩增myosin-5基因841 bp(含A135T突变)、802 bp(含S217L突变)和1 649 bp(含E420K突变)的基因片段,而后用限制性内切酶KpnⅠ、TasⅠ和DraⅠ对PCR产物进行酶切,含有A135T、S217L和E420K突变的PCR产物经过酶切后,可以分别产生256 bp和585 bp 2个片段,61、287 bp和54 bp 3个片段以及932 bp和717 bp 2个片段,而不含基因点突变的PCR产物酶切后只能分别产生841 bp 1个片段,515 bp和287 bp 2个片段和1 649 bp 1个片段;对酶切产物电泳图谱分析,进而对A135T、S217L和E420K突变的抗药株进行鉴定。采用PCR-RFLP方法还检测到了抗氰烯菌酯的F.graminearum菌株中的3种常见突变(A135T、S217L、E420K),准确率高达95.12%。目前,应用PCR-RFLP技术已经成功检测抗苯并咪唑类杀菌剂的B.cinerea[129]、Cladobotryumdendroides[130]、Monilinialaxa[17]、Colletotrichumgloeosporioides[131]等抗性菌株,抗QoI的B.graminisf.sp.hordei[132]、B.graminisf.sp.tritici[57]、P.fusca[133]、P.viticola[135]和R.collo-cygni[134]等,抗嘧菌酯的Alternariaalternata、A.tenuissima和A.arborescens[56]和P.viticola的双炔酰菌胺抗性菌株[136-137]。
2.3 等位基因特异性PCR
等位基因特异性PCR也是一种简单快速的检测基因点突变的方法。该方法在设计引物时要求一条引物与目的片段完全匹配,另一条引物的3′端碱基与模板上突变的碱基匹配,在合适的PCR反应条件下,只有完全匹配的引物才能扩增出PCR产物。例如,罗梅等[138]和Fan等[139]以M.fructicola为对象,基于已知的多菌灵抗性机理,即靶标β微管蛋白基因TUB2的点突变E198A和H6Y,建立了等位基因特异性PCR检测技术,快速灵敏地检测M.fructicola对多菌灵的抗性,该技术有望在实践中推广使用。在杀菌剂抗药性检测方面,等位基因特异性PCR已经应用于鉴定抗苯并咪唑类药剂的Monilinalaxa[17]、M.fructicola[1]、Alternariaalternata、A.tenuissima、A.arborescens[140]、B.graminisf.sp.tritici[141],抗嘧菌酯的Didymellabryoniae[142],抗QoI和SDHI的B.cinerea[71]以及抗DMI的U.necator[33]等抗性菌株。
将等位基因特异性PCR和荧光定量 PCR相结合的等位基因特异性荧光定量 PCR可以更有效地对杀菌剂抗性菌株进行定量检测。目前,该技术已经应用于多种病原真菌的抗药性检测,包括Alternariaspp.[56]、B.cinerea[143-144]、F.graminearum[146]和M.fructicola[139]等。此外,利用等位基因特异性荧光定量 PCR还可以快速地鉴定田间病原菌抗性群体的发生发展情况[1]。
2.4 LAMP
LAMP是一种速度快、灵敏度高和特异性强的核酸恒温扩增技术。LAMP仅需1种具链置换活性的DNA聚合酶(如Bst、Gsp等)及针对靶基因6~8个区域设计的4~6条引物,在60~66℃的恒定温度下,几十分钟就可以实现对靶基因进行大于109倍的扩增[154-155]。近年来,LAMP技术开始应用于杀菌剂抗药性的检测中。例如,Li等[147]利用LAMP技术建立了快速检测因cytb基因发生G143A突变导致的C.cassiicola对QoI产生抗性的菌株。此外,Duan等应用LAMP技术成功检测F.graminearum[10]、F.asiaticum[11]、S.sclerotiorum[148-149]和B.cinerea[151]的苯并咪唑类抗性突变类型,包括β-tubulin基因的F167Y、F200Y、E198A、E198K和E198V突变等。Hu等[150]利用LAMP方法检测抗QoI的灰葡萄孢B.cinerea;Fan等[152]利用该技术检测灰葡萄孢B.cinereaSDHB亚基第272位组氨酸突变为精氨酸的抗性菌株。
此外,LAMP方法还可用于检测非药物靶点突变介导的病菌抗药性。例如,针对由CYP51启动子区片段插入导致的DMI抗性,Fraaije[47]成功研发了快速检测Zymoseptoriatritici中 由CYP51启动子区片段插入所致的DMI抗性的LAMP方法。Chen等[153]建立了检测M.fructicola中MfCYP51基因启动子区65 bp插入片段的方法。
3 对策与展望
杀菌剂长期使用后,植物病原菌对药剂进化出了多种自我防御的抗性机制,这些机制可能单独或者协同发挥作用,使得药剂防效下降或失去抑菌效果。深入揭示植物病原菌对杀菌剂的抗性机制,可为科学用药以及新药剂研发提供重要理论支撑。目前,植物病原真菌对杀菌剂的抗性多数是药物靶基因位点突变所致,其次是药靶基因和ABC转运蛋白基因的高表达。此外,病菌仍存在着其他潜在的抗药机制,例如,病原菌对药剂的代谢分解作用增强。除了上述比较经典的抗药性机制之外,我们还需要关注在药剂选择压力下,病菌对药剂产生短期的、不稳定遗传的敏感性下降问题,病菌对药剂的适应性使得在短期内再次用药时防治效果不佳。目前少数几个研究案例表明,该现象可能与表观遗传变化相关,但具体机制有待于研究。
关于杀菌剂抗性治理,Brent等及Corkley等总结了一套抗性治理的基本策略[156-157],即:1)交替使用或混用不同作用机制的药剂,2)限制每个生长季节的用药次数;3)尽可能在病害发生早期用药;4)开发具有新作用机制的高活性杀菌剂;5)加强病害综合防控,减轻病害压力。
除了上述经典的抗性治理策略之外,表观遗传调控和RNA干扰(RNAi)等技术有望在杀菌剂抗性治理中发挥重要作用。表观遗传修饰在调控病菌生长、致病、抗逆等方面发挥极其重要的作用,因此,针对病菌的表观遗传修饰,有望开发新型杀菌剂。目前,正在开发几种表观遗传类药物,如DNA甲基化抑制药物、组蛋白乙酰转移酶抑制剂、组蛋白脱乙酰酶抑制剂、蛋白质甲基转移酶抑制剂和组蛋白甲基化抑制剂等,在临床上已经有效用于治疗真菌引起的人类疾病[158]。RNAi是另一种潜在的控制植物病害的新技术。RNAi可以通过将dsRNA分子输送到目标生物体的细胞中来抑制靶标基因表达,与传统农业化学品相比,其可能更具针对性、更精准地控制病害。在过去的10年中,已经开发了几种dsRNA递送系统,包括叶面喷雾、灌溉和树干注射,并且在特定环境下获得良好的防治效果。目前,尽管RNAi在大田环境下对病害的防治效果尚不够理想,但随着RNAi递送技术的不断完善,对杀菌剂具有高抗性风险的病害,例如灰霉病、白粉病和霜霉病,RNAi具有巨大的应用潜力[159]。

