m6A RNA甲基化修饰在昆虫生长发育、免疫和抗药性中的作用
张欣怡, 白 杨, 郭 乐, 朱流红,苏 奇, 张友军, 郭兆将*
(1. 长江大学农学院,荆州 434025;2. 中国农业科学院蔬菜花卉研究所,蔬菜生物育种全国重点实验室,北京 100081)
RNA修饰是最普遍存在的表观遗传修饰之一,迄今为止已经鉴定出170余种修饰方式[1-2]。目前研究最为广泛的RNA修饰主要包括N6-腺苷酸甲基化(N6-methyladenosine, m6A)、N1-腺苷酸甲基化(N1-methyladenosine, m1A)和5-胞嘧啶甲基化(5-methylcytidine, m5C)等。其中,RNA甲基化m6A修饰是真核生物中含量最为丰富存在最为普遍的RNA修饰[3]。m6A修饰存在于几乎所有形式的RNA中,包括转运RNA (transfer RNA, tRNA)、信使RNA (messenger RNA, mRNA)、核糖体RNA (ribosomal RNA, rRNA)以及小RNA (microRNA, miRNA)、长链非编码RNA (long non-coding RNA, lncRNA)和环状RNA (circular RNA, circRNA)等[4-6]。
m6A修饰最早发现于1974年[7],随后被证明通过影响RNA的选择性剪接、稳定性、出核、翻译和降解等分子功能,从而参与调控多项重要生物学功能[6]。在哺乳动物中,m6A修饰参与调控胚胎干细胞分化[8]、神经系统发育[9-10]和疾病生成[7, 11]等生理过程。在植物中,m6A修饰参与调控植物的生长发育[12-13],植物病毒感染免疫应答[14]等生理过程。在微生物中,m6A修饰影响酵母菌株减数分裂[15]。目前,m6A修饰在昆虫中的研究主要集中在模式昆虫果蝇Drosophila中,近年来在经济昆虫家蚕Bombyxmori和意大利蜜蜂Apismellifera中也有所研究,在为害水稻和小麦的灰飞虱Laodelphaxstriatellus和寄主十分广泛的烟粉虱Bemisiatabaci等农业害虫中也有报道。本文总结了目前m6A修饰在昆虫生长发育、免疫和抗药性中的作用,为进一步研究m6A修饰在昆虫中的生理功能奠定基础。
1 m6A修饰的分子机制
研究发现,m6A修饰是一种动态可逆的过程[16-17]。在生物体内,甲基转移酶(writer)可将S-腺苷甲硫氨酸(SAM)上的甲基(-CH3)转移到RNA分子上m6A基序(RRACH, R=A/G; H=A/U/C)中腺嘌呤(A)的第6位氮原子上,而此甲基又可被去甲基化酶(eraser)移除,起到去甲基化的作用。带有m6A修饰的RNA分子可被细胞核和细胞质中的识别蛋白(reader)识别,进而影响RNA分子的命运,调控基因的生物学功能[18](图1)。
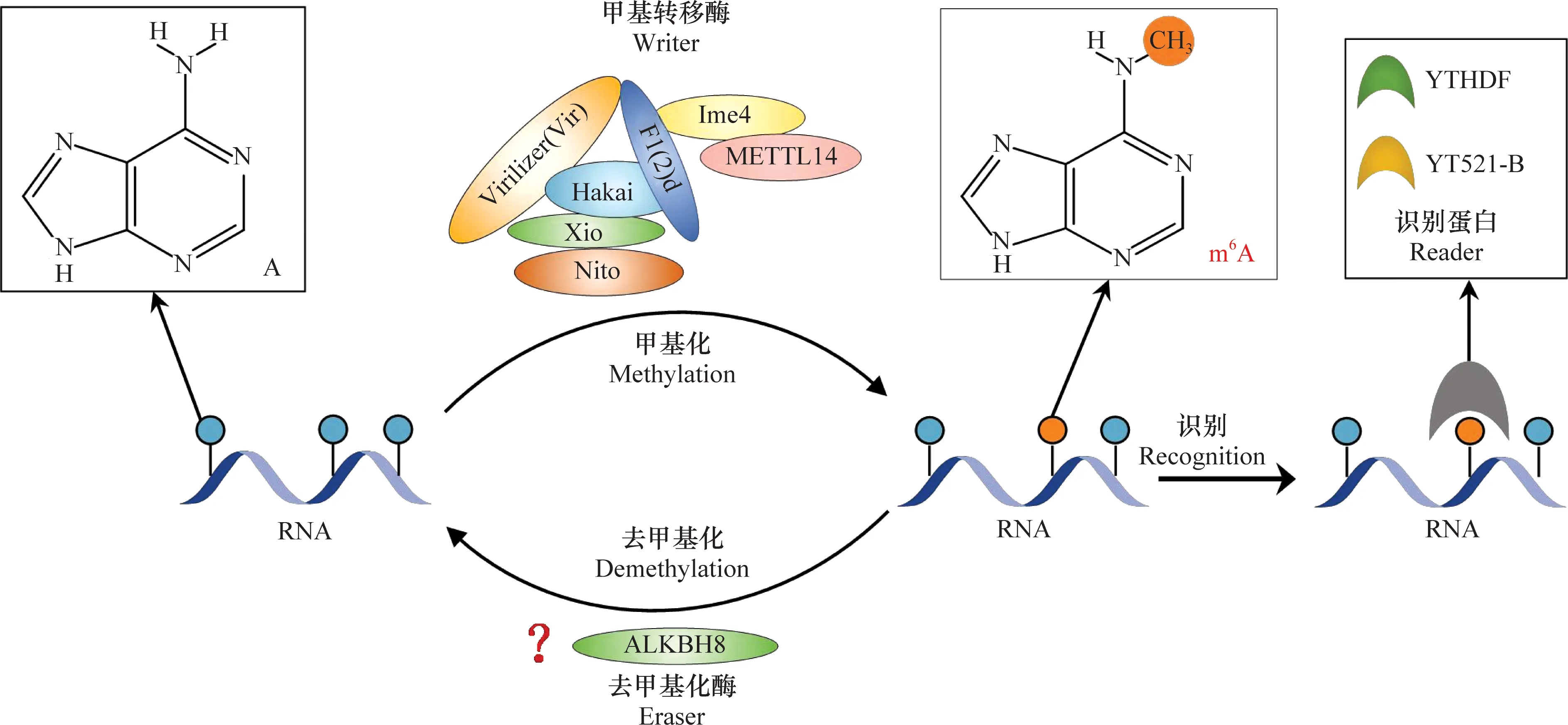
图1 黑腹果蝇中m6A修饰的分子机制Fig.1 Molecular mechanisms of m6A modification in Drosophila melanogaster
1.1 甲基转移酶
m6A甲基转移酶是一个保守的多蛋白复合体,可分为2个亚复合体: m6A-METTL复合体(m6A-METTL complex, MAC),即甲基转移酶3 (methyltransferase-like 3, METTL3)和甲基转移酶14 (methyltransferase-like 14, METTL14)形成的异源二聚体复合物,以及m6A-METTL相关复合体(m6A-METTL associated complex, MACOM),包括Wilms肿瘤1相关蛋白(WT1 associated protein, WTAP)、KIAA1429(也称为VIRMA)、RNA结合基序蛋白15 (RNA binding motif protein 15, RBM15)、CCCH型锌指蛋白13 (zinc finger CCCH-type containing 13, Zc3h13)和E3泛素连接酶(E3 ubiquitin ligases, Hakai)。
METTL3在甲基转移酶中作为催化亚基与SAM结合,同时将甲基从SAM供体转移至腺苷的第6位氮原子上。在甲基转移酶中与METTL3形成异源二聚体的METTL14被证明支持甲基转移酶复合物与RNA靶点之间的相互作用,并且对METTL3发挥活性至关重要,但是单独的METTL14并不具有催化作用[19]。WTAP作为调节亚基同样不具备甲基转移酶的催化活性,但它与MAC异源二聚体相结合并调控其活性、稳定性以及核定位[20]。除此之外,Schwartz等[21]发现KIAA1429也作为m6A甲基转移酶复合物的核心组分,其功能与WTAP类似,且对甲基转移酶复合体起到支架作用。进一步研究发现,RBM15/RBM15B结合m6A甲基化复合体并将其募集到RNA的特定位点,促进甲基化[22]。Zc3h13亚基对于Zc3h13-WTAP-Virilizer-Hakai复合物的细胞核定位至关重要,并可促进m6A甲基化[23]。此外,Hakai也是m6A-METTL相关复合体的组成部分,对于维持MACOM成分的稳定性至关重要[24]。
哺乳动物m6A甲基转移酶因子METTL3、METTL14、WTAP、Hakai、Zc3h13、RBM15/RBM15B和KIAA1429在果蝇中的同源基因分别为Ime4、METTL14、Fl(2)d、Hakai、Xio(Flacc)、Spenito(Nito)和Virilizer(Vir)[24-33]。
1.2 去甲基化酶
在哺乳动物中,目前发现2个m6A的去甲基化酶基因,分别为脂肪量与肥胖相关蛋白(fat mass and obesity-associated, FTO)和AlkB同系物5 (AlkB homolog 5, ALKBH5)。
在最初的研究中,FTO一直被认为是一种肥胖相关基因,与2型糖尿病和肥胖症等疾病相关。直到2011年,Jia等在人类肝肿瘤细胞中首次发现FTO可作为m6A修饰的去甲基化酶[16]。FTO属于非血红素铁(Ⅱ)/α-酮戊二酸依赖的双加氧酶AlkB基因家族,继FTO之后,Zheng等又在AlkB家族中报道了ALKBH5可作为小鼠的去甲基化酶[34],且发现ALKBH5的去甲基化活性影响mRNA输出和代谢,进而影响小鼠生育能力等生理过程。除此之外,在拟南芥中,发现ALKBH10B也可发挥去甲基化酶的作用,影响植物的开花性状、营养生长[35]以及调节拟南芥种子萌发过程中对脱落酸(abscisic acid, ABA)的反应[36]。目前,在昆虫中发现ALKBH8可能作为其m6A去甲基化酶,但其功能仍处于探索阶段[37]。
1.3 识别蛋白
带有m6A修饰的基序可以被细胞内的多种蛋白质识别并结合,从而调控RNA的加工、翻译及稳定性等。目前已被发现的识别蛋白,一类是YTH结构域家族蛋白,包括位于细胞质中的YTHDC2、YTHDF1~ YTHDF3以及位于细胞核中的YTHDC1,它们可以通过YTH结构域选择性识别并结合m6A修饰基序(RRACH, R=A/G; H=A/U/C)。其中,YTHDC1有调节mRNA剪接[38]和加快mRNA核输出[39]的作用。YTHDC2可以影响靶标mRNA的稳定性及其翻译效率[40]。YTHDF1能够增强mRNA的翻译[41]。YTHDF2能够通过直接招募CCR4-NOT脱腺苷酸化酶复合体而促使靶标RNA衰减[42]。YTHDF3可以与YTHDF1协同作用进而促进mRNA翻译;另一方面,YTHDF3可通过YTHDF2促进mRNA的降解[43]。异质性核糖核蛋白(heterogeneous nuclear ribonucleoproteins, HNRNPs)家族也可作为m6A的识别蛋白,包括HNRNPC、HNRNPG和HNRNPA2B1,其中HNRNPA2B1可调控靶标RNA的加工和选择性剪接[44]。近期研究发现,胰岛素样生长因子2 mRNA结合蛋白(insulin-like growth factor 2 mRNA-binding proteins, IGF2BPs)也被证明可作为m6A识别蛋白。IGF2BPs在正常和应激条件下以m6A依赖的方式促进靶标mRNA的存储以及其稳定性,从而影响其翻译效率[45]。
目前在昆虫中,发现了2种m6A修饰识别蛋白,即在果蝇中发现的YT521-B (CG12076)和YTHDF (CG6422),它们分别是哺乳动物中YTHDC1和YTHDF2的同源蛋白[28]。
2 m6A修饰在昆虫生长发育、免疫和抗药性中的作用
2.1 m6A修饰调控果蝇性别决定和剂量补偿
研究发现,果蝇性别决定的主调控基因sex-lethal (Sxl)的选择性剪接调控果蝇的性别,实现雄性果蝇的剂量补偿[46-47]。Sxl有两种不同的剪接形式。雄性果蝇中,外显子3的终止密码子处被剪接导致Sxl蛋白提前终止。但雌性果蝇则跳过外显子3,从而产生功能性Sxl蛋白,保持雌性分化[46-47]。除此之外,在雌性果蝇中,有功能的Sxl蛋白可抑制雄性特异性致死基因(msl-2)的翻译,使其在雌性个体中沉默,而在雄性个体中,msl-2基因正常表达,促进X染色体上基因转录,从而实现雄性个体的剂量补偿,因此Sxl基因的选择性剪接在果蝇中至关重要[47]。而近期研究发现,m6A修饰通过参与调控Sxl基因的选择性剪接影响果蝇的性别决定和剂量补偿[24-33]。
早在20世纪80年代,Fl(2)d[25]和Virilizer[26]就被证明通过调控果蝇Sxl基因的选择性剪接参与其性别决定。在2015年,研究者通过RNA干扰(RNAi)技术筛选又发现Spenito是性别决定通路中新的组成部分[27]。随着研究的不断深入,发现Fl(2)d、Virilizer和Spenito都是m6A甲基转移酶复合体的一部分,且共同调控果蝇Sxl基因的选择性剪接,这表明m6A修饰可能参与调控性别决定。进一步研究发现,识别蛋白YT521-B可识别Sxl上的m6A修饰,介导Sxl基因的选择性剪接从而调控果蝇性别决定和剂量补偿[28-30],但Sxl上具体的m6A位点仍不清楚。随后,Xio被证明是m6A甲基转移酶复合体中的成员并且通过调控Sxl基因的选择性剪接参与果蝇的性别决定[31-32]。近期研究发现Hakai也是m6A甲基转移酶复合体中的成员,同样也参与调控果蝇Sxl基因的选择性剪接[24, 33]。与此同时,通过RNA甲基化免疫共沉淀测序(MeRIP-seq)发现,Sxl基因外显子3附近存在3个m6A位点参与调控Sxl的选择性剪接[33]。基于以上研究,可以总结出m6A修饰参与调控Sxl选择性剪接进而调控果蝇性别决定和剂量补偿的作用模型:在雌性果蝇中,Sxl基因外显子3附近的m6A位点被m6A甲基转移酶复合物特异性识别并甲基化,同时由于这些位点非常接近于外显子与内含子的连接区域,因此m6A识别蛋白YT521-B会特异性识别并结合到这些m6A位点,从而干扰剪接机制,最终导致外显子3被跳过,使得在雌性果蝇中可以翻译成完整的Sxl蛋白(图2)。
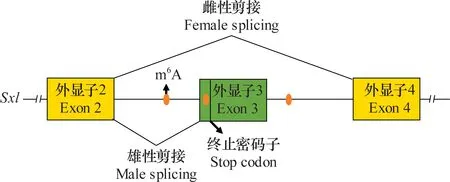
图2 m6A修饰调控Sxl基因的选择性剪接Fig.2 The m6A modification regulates alternative splicing of Sxl gene
2.2 m6A修饰调控果蝇神经发育和功能
研究发现,在果蝇胚胎发育过程中,m6A甲基转移酶亚基Ime4、METTL14、Fl(2)d和Virilizer大量富集于神经外胚层,表明m6A修饰可能参与调控果蝇的神经系统发育。虽然m6A水平在果蝇成虫阶段总体有所下降,但在头部仍然显著高表达,且当Ime4和METTL14被敲除后,果蝇的飞行和移动行为受到严重影响,但这样的影响可以通过表达神经元(elav-GAL4)所挽救,表明m6A修饰通过影响神经元功能来调控果蝇的行为[28]。除此之外,研究发现18S核糖体RNA 的甲基转移酶METTL5可能通过调控核糖体RNA的m6A修饰从而影响果蝇神经系统,进一步影响果蝇的移动和辨别方向等行为[48]。进一步研究表明,果蝇中m6A修饰的识别蛋白YTHDF参与调控神经系统发育,YTHDF可以与脆性X智力迟钝1(fragile X mental retardation type 1,Fmr1)基因相互作用,且抑制关键靶标基因的翻译,以确保适当的轴突生长和稳态,从而使神经系统正常发育[49]。m6A修饰调控果蝇神经功能不仅仅体现在果蝇的移动和辨别方向等行为,通过科学家们深入研究发现,m6A/YTHDF通路参与调控蘑菇体(mushroom body, MB)(联想学习中心)的神经元,从而介导果蝇对气味的识别记忆[50],这与哺乳动物中m6A修饰的功能相似,在哺乳动物中已经发现m6A修饰影响神经功能和行为,其中包括了学习和记忆机制[9-10, 51-52]。
2.3 m6A修饰可能调控家蚕应对核型多角体病毒(BmNPV)感染
家蚕核型多角体病毒(Bombyxmorinucleopolyhedrovirus, BmNPV)病是家蚕养殖过程中最常见且危害最严重的病毒。BmNPV侵入后首先感染家蚕中肠组织,使其体节肿胀,体色乳白,体壁易破。近期研究发现m6A修饰参与调控家蚕应对核型多角体病毒的感染[53-54]。Zhang等[54]对感染病毒和未感染病毒的家蚕中肠进行了m6A组学分析,发现感染与未感染病毒的家蚕之间有1 221个差异表达的m6A峰,表明m6A修饰可能参与了家蚕应对病毒感染的过程。除此之外,作者发现当使用siRNA技术沉默家蚕细胞中的2个甲基化酶核心亚基BmMETTL3和BmMETTL14以及家蚕识别蛋白BmYTHDF3基因后,家蚕中病毒结构蛋白VP39表达增加,而当过表达这3个基因后,情况相反[54]。他们在进一步的研究中发现与病毒复制和增殖相关的病毒极早期基因ie-1具有高水平m6A修饰,且此基因的m6A修饰负向调控了IE-1蛋白表达。除此之外,作者发现病毒复制在过表达BmYTHDF3的细胞中被显著抑制,且呈剂量依赖性,而在转染si-BmYTHDF3的细胞中则发现相反的作用[55]。但在另一项研究中,Xue等发现在家蚕中肠中,低水平的METTL3可以抑制核型多角体病毒的增殖。在家蚕细胞中,当METTL3表达水平降低抑制了BmNPV核衣壳蛋白基因VP39和包膜融合蛋白基因GP64的表达,说明低水平的m6A可能在一定程度上抑制BmNPV的增殖[56]。综上所述,m6A修饰参与调控家蚕应对家蚕核型多角体病毒的过程,但其作用机制十分复杂,因此还需要更多的研究去探索m6A修饰是如何具体参与这一过程的。
2.4 m6A修饰可能调控家蚕滞育
昆虫滞育是受环境条件的诱导发生的暂停发育的现象,是为了保障其在不利的环境中生存而进化出的特殊生活习性和生理反应。家蚕通过滞育可以调节生长和繁殖,提高抗应激能力,从而维持整个种群生存[57]。Jiang等发现与非滞育家蚕种群相比,滞育种群中m6A修饰相关基因表达和m6A修饰含量更高,这表明m6A修饰可能在家蚕滞育中起着关键作用[58],但其具体功能尚不清楚。
2.5 m6A修饰可能调控蜜蜂级型分化
蜜蜂的群居性表现出严格的劳动分工,这很大程度上是基于级型分化。级型分化是指蜜蜂的雌性低龄幼虫可以通过不同营养摄入控制幼虫发育成蜂王或者工蜂[59-60]。通过对3龄阶段的蜂王和工蜂幼虫进行m6A甲基化测序分析发现,蜜蜂幼虫的m6A甲基化水平可因营养摄入不同而发生变化,测序结果显示,工蜂幼虫比蜂王幼虫含有更多的m6A高甲基化峰。除此之外,在工蜂和蜂王之间,许多与级型分化相关转录本的m6A水平存在显著差异。值得注意的是,当使用甲基化抑制剂3-脱氮基腺苷(3-deazaadenosine, 3-DAA)抑制工蜂幼虫的m6A修饰水平时,工蜂幼虫表现出蜂王幼虫特征,进一步证明了m6A修饰在蜜蜂的级型分化中起到了重要作用[61]。
2.6 m6A修饰调控烟粉虱杀虫剂抗性
烟粉虱是一种全球分布,且破坏性极强的超级农业害虫,其寄主范围十分广泛,严重危害蔬菜和粮食作物生产[62-64]。新烟碱类杀虫剂是防治此害虫的有效手段,然而随着田间大量及不合理地使用此类杀虫剂,烟粉虱对这类杀虫剂已产生了严重的抗药性[65]。Yang等首次报道了细胞色素P450基因CYP4C64的表达量升高是导致烟粉虱对噻虫嗪产生抗性的主要原因之一[66]。CYP4C64基因序列的分析结果表明,抗性烟粉虱CYP4C64基因的5′-UTR区有一个T-206A突变,突变后的腺嘌呤位点可被甲基转移酶识别并进行甲基化修饰,即该突变引入了一个m6A修饰位点,通过进一步研究发现此m6A修饰位点可促进烟粉虱CYP4C64基因的表达,从而导致烟粉虱对噻虫嗪产生抗药性[66](图3)。
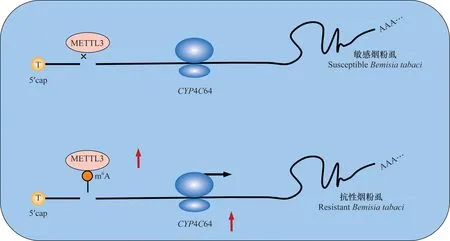
图3 m6A修饰介导烟粉虱CYP4C64基因的表达Fig.3 m6A-mediated regulation of CYP4C64 expression in Bemisia tabaci
2.7 m6A修饰调控灰飞虱应对水稻黑条纹矮缩病毒(RBSDV)感染
在灰飞虱中,Tian等发现当灰飞虱中肠组织携带水稻黑条纹矮缩病毒(rice black-streaked dwarf virus, RBSDV)后会导致灰飞虱的m6A水平下降,而干扰灰飞虱中m6A甲基转移酶基因(LsMETTL3和LsMETTL14)的表达后,灰飞虱中肠细胞中该病毒的积累水平显著升高,表明m6A水平与病毒复制呈负相关,即m6A修饰可以限制病毒的复制,同时病毒也可以抑制灰飞虱的m6A修饰达到其持久性传播的目的[67]。
3 总结与展望
近年来,随着RNA甲基化免疫沉淀测序等方法的应用,人们对RNA修饰生物学的兴趣和认识有了快速的发展[68]。m6A修饰目前已被证明调控哺乳动物、植物以及微生物的多项生理过程。而在昆虫中,m6A修饰的研究主要集中在模式昆虫果蝇和家蚕中。近年来在经济昆虫家蚕和蜜蜂,以及在为害水稻、小麦的灰飞虱和寄主十分广泛的烟粉虱中也有报道。
目前,m6A修饰对于果蝇性别决定和剂量补偿[24-33]以及神经发育和神经功能[28, 49-50]两方面的影响机制已经较为明确。但由于m6A修饰是一种动态可逆的过程,当前在昆虫中潜在的去甲基化酶ALKBH8已有相关研究报道,但针对昆虫去甲基化酶如何参与m6A调控及对其各项功能的影响还有待进一步明确[37]。
与此同时,m6A修饰也调控了其他昆虫的部分生理过程。研究发现,m6A修饰在家蚕滞育中发挥作用[57],并且调控家蚕应对家蚕核型多角体病毒(BmNPV)的侵染[54-56]。在蜜蜂中,发现m6A修饰调控了蜜蜂的级型分化[61]。在烟粉虱中,发现m6A修饰调控其对杀虫剂的抗性[66]。在灰飞虱中,发现其中肠中的m6A水平与中肠细胞中水稻黑条纹矮缩病毒(RBSDV)复制能力呈负相关[67]。但m6A修饰的功能在这些昆虫中的研究中还处于起始阶段,系统的调控作用机制有待进一步研究。此外,m6A除了调控以上昆虫的各项生理功能,在其他昆虫中的研究仍处于空白状态,还有待研究。本文系统总结了目前m6A修饰在昆虫生长发育、免疫和抗药性中的作用,为今后研究基于m6A的表观遗传修饰对昆虫各项生理机能的调控作用提供了新的思路。
昆虫与人类的关系密不可分,对人类而言,昆虫可以分为害虫和益虫。首先是一部分昆虫作为害虫对人类农业生产的危害,据联合国粮农组织的数据显示,全球每年将近40%的农作物在生产过程中受到害虫为害,造成的经济损失达4 466亿元。如农业害虫果蝇为害黑莓、蓝莓、樱桃、覆盆子和草莓等250余种栽培果蔬作物[69]。烟粉虱为害番茄、辣椒、十字花科蔬菜及棉花等600多种植物[62-64]。灰飞虱主要为害水稻、玉米等粮食作物[67]。其次是另一部分昆虫作为益虫对人类农业生产的益处。如经济昆虫家蚕吐出的蚕丝对人类纺织工业至关重要[70],蜜蜂取食花蜜花粉促进植物传粉受精而有益于农作物结实[71]。未来需要进一步研究m6A修饰在昆虫中的作用机制以及功能。如此,一方面可以更深入地了解昆虫各项生理功能,有助于针对果蝇、烟粉虱等害虫发现新的害虫防治靶标、制定新的防治策略,期望通过绿色环保的生物防治手段降低害虫对农作物的危害。另一方面,有助于更好地改造并培育家蚕、蜜蜂等经济昆虫的新品种,从而服务于人类农业生产。
总而言之,随着研究技术的不断发展,哺乳动物与植物中对于m6A的调控机制以及功能的研究已经取得了较为丰硕的进展。但在昆虫中,m6A的相关研究总体而言还处于起始阶段,未来需要进一步研究m6A修饰在昆虫中的作用机制以及各项功能,为更有效的害虫生物防治以及经济昆虫培育等生产实践提供坚实的研究基础。

