玉米小斑病研究进展
李智强, 张祥辉, 刘文德*
(1. 中国农业科学院植物保护研究所,植物病虫害综合治理全国重点实验室,北京 100193;2. 吉林大学植物科学学院,长春 130062)
玉米是我国种植面积最大的粮食作物,是重要的粮食、饲料和工业原料兼用作物,尤其是近些年再生能源与精深加工领域对玉米的需求急速增长,使玉米成为21世纪重要的战略资源[1-2]。2012年我国玉米播种面积为3 503万hm2,总产量2.056亿t,超过水稻产量,成为我国第一大粮食作物;2021年玉米播种面积和总产双双创历史新高,分别达到4 332 万hm2和2.726亿t(中华人民共和国2021年国民经济和社会发展统计公报,http:∥www.stats.gov.cn/xxgk/sjfb/zxfb2020/202202/t20220228_1827971.html)。因此,玉米的生产状况直接影响到畜牧、轻工、能源及其相关行业的发展,直接关系到国家粮食安全以及人民生活水平的提高,在我国国民经济中具有举足轻重的作用。玉米整个生育期内都会受到大量病虫害的严重威胁,特别是近些年,随着高产、耐密品种的广泛推广,单一品种连续大面积种植,耕作制度的改变以及全球性气候变暖等因素的影响,玉米各种病虫害的发生呈持续加重趋势,其中玉米小斑病的发生与危害尤为突出,并受到密切关注[3]。
1 玉米小斑病的分布与危害
玉米小斑病是一种在世界范围内广泛发生并严重影响玉米产量和品质的典型叶部真菌病害,在我国大部分玉米种植区都有发生,以夏玉米种植区(主要包括黄淮海大部、西北东部区域夏玉米种植区)发生较为严重。一般情况下,症状首先出现在玉米下部叶片,并逐步向上部叶片扩展。发病初期叶片上出现分散的水渍状病斑或褪绿斑,随着病情的发展,逐渐形成明显的病斑,使植株光合作用受到影响,最终可导致叶片枯死,严重时甚至引发茎秆倒伏并造成绝产[4]。玉米小斑病常见病斑类型主要有3种,典型病斑为椭圆或近矩形,中部黄褐色,边缘深褐色或紫褐色,病斑扩展不能突破叶脉;第二种表现为病斑可以突破叶脉限制,形成椭圆形、灰褐色,没有显著深色边缘的病斑;第三种为抗性病斑,常表现为黄褐色的小点状坏死斑,并伴有褪绿晕圈,但不能进一步扩展[5]。
玉米小斑病于1925年在美国佛罗里达州和菲律宾被首次报道,随后便迅速蔓延至全球各玉米产区,并成为各产区的主要病害之一[6]。20世纪70年代,T型胞质不育系玉米杂交品种大量种植导致玉米小斑病在美国突然暴发流行,造成了约10亿美元的经济损失[6]。20世纪初,俞大绂等在我国江苏省发现玉米小斑病[7];60年代,玉米小斑病曾在河北省和湖北省大流行,造成玉米大面积减产,产量损失高达400多万kg[8-9];1996年,河南北部玉米小斑病大暴发,产量损失达20%以上[10]。随着抗性玉米品种的推广与种植,玉米小斑病在一定程度上得到了控制,但近些年随着世界范围内种植业结构调整、耕作栽培方式转变、玉米品种更新换代、单一品种种植面积及地域的扩大和全球性气候变暖等因素的影响,玉米小斑病的发生呈持续加重的趋势。Chen等报道,近年来我国玉米小斑病的发病区域和发病严重程度均呈快速上升的趋势[11]。最近的研究报道显示,玉米小斑病在流行年份可引起10%~68%的产量损失,严重威胁当今全球的玉米安全生产[12-13]。2017年,国家农作物品种审定委员会在新修订的“主要农作物品种审定标准(国家级)”中,把小斑病抗性列为京津冀和黄淮海玉米产区玉米新品种审定的“一票否决”病害,高感即淘汰。
2 玉米小斑病病原菌形态及生物学
玉米小斑病病原菌为死体营养型子囊菌亚门真菌玉蜀黍平脐蠕孢Bipolarismaydis(Nisikado Miyake) Shoem.,目前,国内玉米小斑病病原菌主要分为O、C、S、T 等4个生理小种。其中O小种是我国优势小种[14-16]。玉米小斑病菌成熟的分生孢子中间粗两端细、钝圆,并向一侧弯曲,呈“月牙”状,黑褐色,一般具有3~13个隔膜,绝大多数具有7~9个隔膜,其芽管可从分生孢子的两端萌发延伸,被描述为双极性生长。研究表明,玉米小斑病菌分生孢子形成和萌发最适温度分别为25℃和26~32℃,高湿条件有利于分生孢子的形成和萌发。玉米小斑病菌分生孢子在接种1 h后开始萌发,6~10 h后出现侵染菌丝,继续生长2 h左右后沿叶脉出现粗壮菌丝,表明病原菌定殖成功。定殖成功后24~36 h,菌丝体向细胞壁外扩展形成气生菌丝或直接侵入相邻叶肉细胞。接种后60~72 h,在感病品种叶片上出现肉眼可见棕色、椭圆形、可扩展的病斑组织(图1)[17-18];抗性品种叶片上则表现为独立的黄褐色坏死点,彼此之间不交叉[19]。随后感病品种叶片的病斑上产生大量分生孢子,分生孢子借气流传播进行重复侵染。玉米收获后,病原菌以菌丝或分生孢子的形式随病株残体进入越冬阶段。翌年借气流或雨水传播到田间玉米叶片上,遇适宜温度、湿度,分生孢子开始萌发并引起新一轮的侵染。
3 玉米小斑病菌致病相关基因功能研究
对玉米小斑病菌基因功能的研究较早且主要集中于T毒素的形成与致病机制方面。研究证实,T小种产生T毒素并特异性地靶向玉米线粒体蛋白URF13,导致玉米线粒体能量代谢和电子传递紊乱,基质外流,最终致使细胞死亡[20]。T毒素的合成主要由包括Tox1在内的10个基因组成的基因簇控制[21],而Tox1由两个不连续的基因座Tox1A和Tox1B组成。已经证实T小种是O小种进化过程中突然插入Tox1A和Tox1B形成的[22]。除此之外,Bi等研究证明,Llm1通过调控T毒素的合成来调节玉米小斑病菌生长发育与致病性[23]。最近印度科研人员首次利用比较转录组学技术研究证明,玉米小斑病菌侵染抗病与感病玉米品种后,大量与线粒体代谢、细胞壁和几丁质合成、糖代谢、过氧化物酶活性、丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)活性和莽草酸脱氢酶相关的基因显著上调表达,同时侵染感病玉米品种后,小斑病菌内次生代谢和碳代谢生物合成途径相关基因高度富集[24]。研究表明,玉米小斑病菌中自噬相关基因ATG4与ATG8在其生长发育、适应胁迫和侵染致病过程中起重要调控作用,并影响Septin蛋白在分生孢子和附着胞底部的正确组装和定位,证明自噬发生与玉米小斑病菌侵染结构发育有着紧密联系[25-26]。PAK-like (p21-activated protein kinases)激酶是生物发育和形态发生的重要调节因子,在真核生物中具有保守性,日本研究人员通过敲除玉米小斑病菌中PAK-like激酶编码基因Cla4,证明该基因具有调控生长发育、致病性和无性/有性转变发育的重要功能[27]。Sorting nexins (SNXs)是一类含有PX (phox homology)结构域,并在细胞内吞和内体分选运输中发挥作用的蛋白。PX结构域是一种可以特异性结合磷脂酰肌醇的结构域,并介导SNXs蛋白与含有特异的磷脂酰肌醇的内体或细胞膜结合,但该类蛋白在病原真菌中的具体生物学功能不清楚,特别是在玉米小斑病菌中的功能还鲜有报道。最近Yu等发现SNXs相关基因Chsnx4和Chsnx41的缺失严重影响玉米小斑病菌营养生长、孢子形态和附着胞形成,进一步证明Chsnx4和Chsnx41对玉米小斑病菌致病性具有重要调控作用[28]。Yu等研究证明,异硫氰酸酯可以显著抑制玉米小斑病菌的生长,而ChNOX1和ChTRX2正向调控玉米小斑病菌对异硫氰酸酯的敏感性,该研究成果表明异硫氰酸酯将来可以开发成杀菌剂并用于玉米小斑病的防治,而ChNOX1或ChTRX2可以作为异硫氰酸酯的作用靶标[29]。MAP激酶应激激活相关蛋白Hog1的磷酸化水平受多个磷酸酶与去磷酸酶催化,并参与调控玉米小斑病菌生长发育与致病性[30]。Septin蛋白作为一类保守的细胞周期蛋白,在调控玉米小斑病菌生长发育和致病力中起重要作用[31]。Zhang等研究表明玉米小斑病菌通过铜离子转运蛋白ChCTR1和ChCTR4吸收环境中的铜离子正向调控附着胞形成与致病性[32]。最近Wang等对分离自中国的玉米小斑病菌菌株BM1进行了重测序,获得了高质量基因组,为研究玉米小斑病菌基因功能及致病分子机制提供了重要参考。此外,该研究提供的新基因组资源将有助于了解玉米小斑病的遗传多样性和不同病原真菌基因组的比较分析[33]。但目前对玉米小斑病菌功能基因组的研究主要集中在致病因子T毒素合成方面[23-34],对其生长发育和致病相关基因的调控途径还有待进一步解析[35]。因此深入开展玉米小斑病菌生长发育和侵染致病机制的研究,对制定玉米小斑病绿色防控策略具有重要的理论价值和实践意义。
4 玉米小斑病抗性基因定位与克隆研究进展
4.1 抗性基因定位研究
筛选与挖掘抗性优良玉米材料并开展抗病遗传机制解析是进行抗病育种的基础与前提。玉米小斑病抗性遗传由多基因控制,属于数量抗性遗传。目前在玉米中已经鉴定了超过180个小斑病抗性QTL (quantitative trait locus),按照bin值可划分为87个QTL[16]。20世纪80年代开始,大批研究单位与科研人员致力于小斑病抗性材料的筛选与抗性基因的定位与分离克隆工作。如Balint-Kurti等利用‘Mo17’בB73’构建了重组自交系群体(recombinant inbred lines,RILs),系统研究了其对小斑病的成株期抗性,共鉴定到3个主效抗病位点,分别位于bins1.10、bins3.04和bins8.02/03[14];Carson等和Balint-Kurti等利用相同作图群体(mapping population)对小斑病苗期抗性进行了分析,共鉴定到6个抗病位点,分别位于1、2、3、6、7和8号染色体上,其中在1号和3号染色体上鉴定到的抗病位点与成株期抗病位点位置接近[36-37]。来源于该课题组的另外一个自交系‘NC250’也表现出对玉米小斑病的高抗性状,并且是一份具有全生育期抗性的优良抗源,在玉米生长发育的不同阶段,对小斑病都表现出良好的抗病性,利用该自交系已成功选育出一批如‘NC292’和‘NC330’等高抗小斑病的优良自交系[38]。在此基础上,Belcher等以‘NC250’为供体亲本,‘B73’为轮回亲本构建近等基因系群体(near-isogenic lines,NILs),在bins3.03/04、bins6.01和bins9.02/03分别检测到主效抗病位点[39]。此外,Balint-Kurti等利用热带抗病材料‘NC300’与感病自交系‘B104’构建的RIL群体在bins3.03/04和bins9.03/04检测到主效抗病位点[40]。在利用双亲群体进行抗病QTL定位的同时,该课题组还利用一套包含25个RIL群体的巢式关联作图群体(nested association mapping,NAM)对玉米小斑病的抗病位点进行了检测。通过联合连锁-关联分析,在玉米全基因组中共鉴定到32个小斑病抗性QTL,证实该群体中的小斑病抗性表型变异主要由多个微效QTL的加性效应控制[41]。Chung等利用抗病材料‘CML52’和感病材料‘B73’构建了196份F6重组自交系群体,通过完备区间作图法(inclusive composite interval mapping, ICIM),共鉴定到6个小斑病抗性QTL[42]。Lopez-Zuniga等利用8个BC3F4:5染色体片段代换系群体(chromosome segment substitution lines, CSSLs)共鉴定到56个玉米小斑病抗性QTL,其中,bins1.03、3.02/03、3.04、3.09、4.06、6.01、9.02、9.05和10.05在至少两个BC3F4:5CSSL群体被鉴定到,这些抗性QTL物理位置被界定在5 Mb以内[43]。Zwonitze等利用抗病材料‘Ki14’和感病材料‘B73’构建了109份F6:8RIL群体,通过完备区间作图法,总共鉴定到10个玉米小斑病抗性QTL[44]。Liu等利用热带抗病材料‘T14’和感病材料‘T4’组配获得330个F2:3家系,通过复合区间作图法(composite interval mapping,CIM)共定位到18个玉米小斑病抗性QTL,分别位于3、4、6、8、9和10号染色体上[45]。蒋锋等以热带抗病亲本‘T14’和感病亲本‘T18’构建的238份F2:3家系作为抗性QTL鉴定群体,利用SSR标记结合表型对小斑病进行抗性QTL定位,结果在4号和6号染色体上分别定位到4个和1个抗性QTL[46]。通过上述多个群体的抗性位点的鉴定与相关研究报道表明,在玉米基因组中存在小斑病抗病热点区域,分别为bins3.03/04、bins6.00/01和bins9.02/03等(表1)。进一步克隆抗病热点区域中的具体抗病基因,并解析其分子遗传机制与抗病机理,可以为玉米小斑病抗性育种提供重要的理论基础与遗传材料。
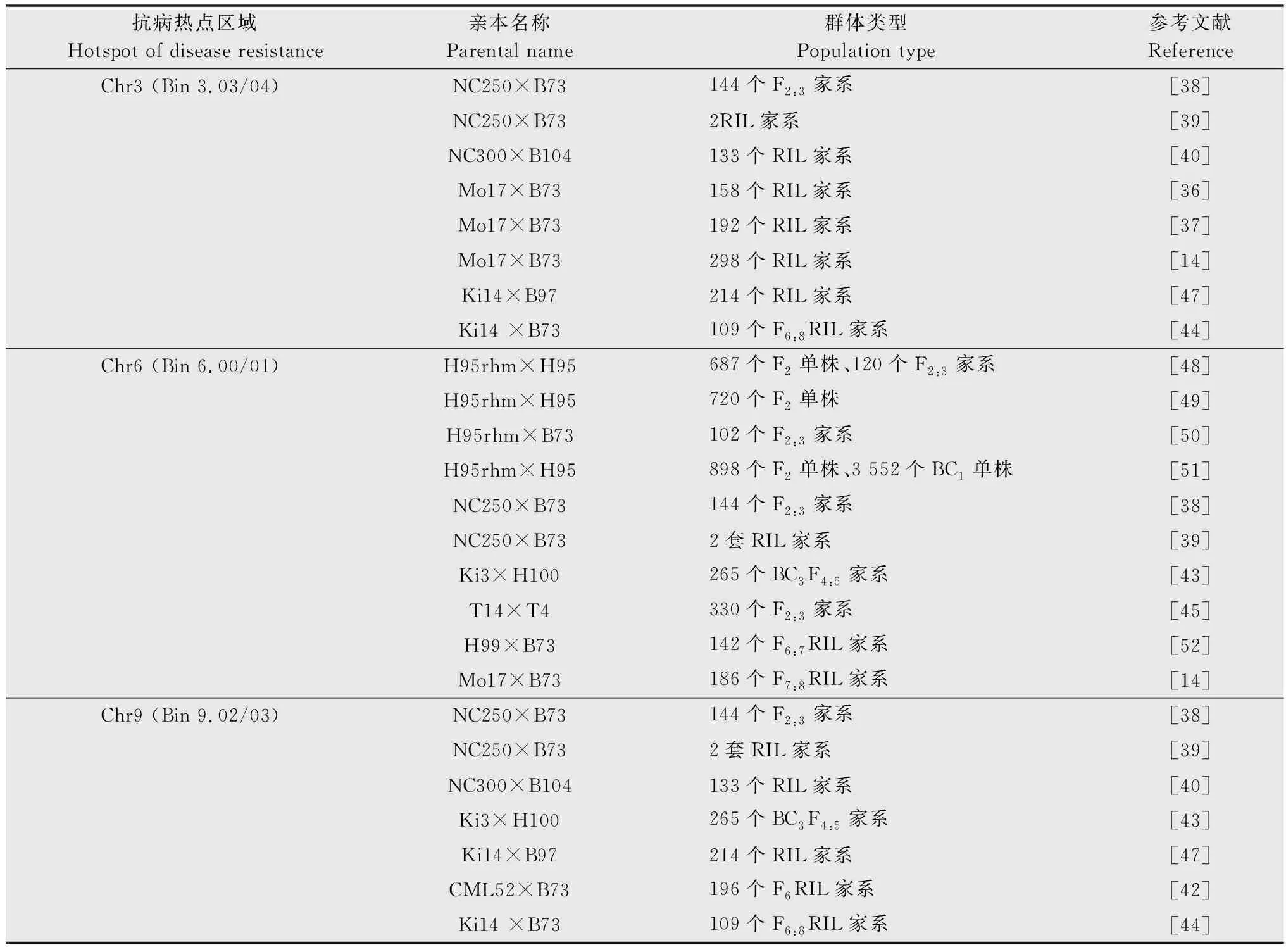
表1 玉米小斑病抗病热点区域Table 1 The hotspot of southern corn leaf blight resistance genes
4.2 抗性基因克隆研究
分离与克隆抗病基因是深入探究植物抗病分子机制的前提与基础。目前采用图位克隆和转座子标签等技术与方法,已经从植物中分离克隆到300多个抗病相关基因[53]。美国伊利诺伊大学抗病课题组采用经典遗传学研究方法对一份来自尼日利亚的小斑病抗性材料(Nigerian composite 024-2-4)进行系统的遗传分析,初步鉴定到一个隐性的抗病位点,命名为rhm[54]。随后,多个课题组开展了rhm基因克隆与遗传育种工作,并获得了大量抗性优良的玉米材料。中国农业大学才宏伟教授和赖锦盛教授课题组合作,成功把rhm基因限定在8.56 kb的区间内,并确定LHT1 (lysine histidine transporter 1)为rhm的候选基因[51]。Yang等利用多个遗传群体,在明确了9号染色体的主效抗病QTL的基础上,进一步通过精细定位、关联分析和表达分析等策略,在主效QTL位点qMdr9.02的抗病区域内鉴定到一个抗病基因ZmCCoAOMT2,并对抗病基因进行了功能验证。结果表明,ZmCCoAOMT2编码玉米木质素合成途径中的一个关键酶(咖啡酰辅酶A-O-甲基转移酶),该酶通过苯基丙酸类代谢途径参与木质部和维管束鞘中木质素的生物合成,引发抗病效应。此外,该基因还可能参与了脂氧合酶通路上代谢产物(如氧化脂类等)的合成,并通过调控细胞程序性死亡来帮助植物抵抗病原菌的侵染。进一步分析还发现,ZmCCoAOMT2不仅对玉米小斑病具有抗病效应,对玉米灰斑病和大斑病也具有良好的抗病效果,表现出广谱抗病效应,是一种新类型的抗病基因[55]。玉米10条染色体上均有玉米小斑病抗性QTL的分布,目前在3号染色体上鉴定到的QTL位点最多,其次为1号与9号染色体。但迄今为止,只有rhm基因与多抗基因qMdr9.02被克隆[54-55]。这表明玉米小斑病抗性遗传机制较为复杂,利用遗传学、分子生物学手段挖掘新的小斑病抗性QTL,解析其遗传机制任重道远。最近,Chen等利用多个遗传群体和多种统计分析方法系统解析了玉米小斑病抗性的遗传基础,并基于多组学手段克隆到2个抗玉米小斑病的新基因,分别为ZmFUT1和MYBR92。进一步采用基因编辑技术获得了2个基因的敲除突变体,研究发现这2个基因的敲除突变体比野生型材料更加感病,证明这2个基因正向调控玉米对小斑病的抗性,该研究成果为玉米遗传改良提供了有价值的技术手段与分析方法[56]。
4.3 反向遗传与组学分析鉴定玉米抗小斑病基因
Xiong等通过反向遗传学的方法,利用转录组测序发现光合作用、植物激素信号转导、MAPK信号通路、苯丙烷类生物合成和转录因子家族在玉米抗病过程中起着至关重要的作用。深入研究发现茉莉酸(JA)和水杨酸(SA)信号通路参与调控甜玉米对玉米小斑病的抗性,并证明ZIM类转录因子(ZIM-domin transcription factors)与PR基因(pathogenesis-related gene)响应玉米小斑病菌的侵染[57]。受体类激酶(receptor-like kinases, RLKs)在植物体内数量庞大,作为多种细胞过程中的关键调节因子,可协调植物的生长发育和胁迫响应。FERONIA是受体类激酶CrRLK1L亚家族的成员,是植物免疫反应中的多效调节因子。但关于玉米FERONIA类受体(FERONIA-like receptors,FLRs)如何响应叶部病原菌的侵染知之甚少。Yu等利用病毒诱导的基因沉默(virus induced gene silencing, VIGS)技术获得沉默ZmFLR1/2和ZmFLR3基因的植株,与对照相比,沉默植株中由flg22和几丁质诱导的活性氧产生显著减少;同时沉默植株对大斑病、小斑病、圆斑病以及炭疽茎腐病的抗性也显著减低;证明ZmFLRs正调控玉米的广谱抗病性[58]。Zhang等利用比较蛋白质组学技术在玉米中鉴定到258个响应小斑病菌侵染的蛋白,其中一个细胞质定位的抗坏血酸过氧化物酶(ZmAPX1)位于先前报道的与小斑病抗性相关的QTL区间内,且ZmAPX1受小斑病菌诱导表达。过表达Zmapx1可以显著提高玉米对小斑病的抗性,而Zmapx1突变体植株较野生型植株更感病。进一步研究发现,小斑病菌侵染后,Zmapx1过表达植物中H2O2含量降低、JA含量及其通路相关基因的表达量增加;而Zmapx1突变体则表现相反的结果,这表明ZmAPX1可以通过清除H2O2并激活JA信号通路来提高玉米对小斑病的抗性[59]。
5 玉米小斑病防治策略
目前,玉米小斑病的防治主要利用抗病品种和药剂防治。但由于选育抗病品种时间较长,加上耕作制度的变革、极端气候多发、病菌变异频繁、新的小种不断出现等因素,抗病品种选育和推广工作难度较大。在还没有培育出完全免疫的品种时,药物防治不可缺少。但是,玉米属于高秆作物,小斑病主要在抽雄后和灌浆期的危害较重,增加了药剂防治的难度。开发玉米小斑病的有效防控技术、促进玉米稳产高产仍是植保工作者的首要任务。
5.1 农业防治措施
抗性品种。种植抗性品种是防治玉米小斑病最为经济有效的策略,但同时需要对抗性品种进行合理布局并轮换种植,避免单一品种的长期连续种植,抗性丧失的品种要及时淘汰,还要结合优良栽培技术,这样才能充分发挥抗性品种潜在的抗病功能[60]。同时,应特别重视玉米小斑病抗性基因的利用,充分利用优良的抗性种质资源,并及时关注小斑病菌群体遗传结构的变化与动态分布,做到根据病原菌群体遗传结构的改变适当合理调整小斑病抗性品种的布局[61]。
田间管理。清理秸秆和深翻土地。玉米病株残体携带的菌源是玉米小斑病发生的最初侵染源,因此,彻底清理玉米秸秆和及时深翻土地埋压残留秸秆,可以有效减少初侵染源。另外轮作倒茬也可以有效减少小斑病的菌源量[62]。加强栽培管理,选择合适时间尽量早播,使抽雄期避开多雨季节,对于避开小斑病高发病期有较明显的效果[63]。施足底肥,氮、磷、钾肥适当混合配合施用,适当增加磷肥,在拔节及抽穗期及时追施复合肥,保证植株健壮生长,具有明显的防病增产效果;及时中耕松土、除草与雨后排涝,可以降低田间湿度,减轻小斑病的发生[64]。
5.2 化学防治措施
玉米心叶末期到抽雄期是病原菌侵染的重要时间点,也是防治玉米小斑病发生的关键时期[60]。可使用75%三环唑可湿性粉剂或25%丙环唑水剂、45%代森铵水剂、400 g/L氟硅唑乳油、24%井冈霉素水剂、19%丙环·嘧菌酯悬乳剂、18.70%丙环·嘧菌酯悬乳剂、27%氟唑·福美双可湿性粉剂、30%肟菌·戊唑醇悬浮剂、32%戊唑·嘧菌酯悬浮剂等药剂按照产品说明书进行喷雾防治,并可辅助以芸苔素内酯和氨基寡糖提高玉米的抗病性[64-65]。
综上所述,根据玉米小斑病的发生规律,采取以抗病品种为主,配合农业防治及化学防治的综合防治措施,才能取得较好的防治效果。
6 展望
深入解析玉米小斑病菌群体遗传结构,阐明病原菌致病机制。首先应对不同玉米种植区的小斑病菌生理小种进行全面解析,评估优良抗性品种,已分离克隆的抗病基因,抗病相关基因在不同遗传背景下对不同种植区来源的小斑病菌的适用性;深入挖掘玉米小斑病菌致病相关基因的功能及其调控的信号途径,可以为生物农药的研发提供重要的分子靶标。
挖掘玉米小斑病抗性相关基因,并解析其抗病机制。搜集国内外的种质资源,进行抗病性鉴定,筛选抗病材料;利用全基因组关联分析与图位克隆技术,分离克隆更多的感病或抗病基因,为进一步有针对性的抗玉米小斑病分子育种提供更丰富的遗传资源。利用诱变育种与基因编辑相结合等手段创制新的抗病资源是未来玉米小斑病抗性育种的发展方向之一。一方面可以进行定点编辑产生新的抗病位点,另一方面也可以“删除”感病基因创制新的抗病材料。在玉米小斑病抗性品种创制过程中,要充分根据不同玉米种植区小斑病菌的种群分布特征与变化规律,对抗病基因进行优化组合,并通过分子生物学技术控制抗病基因的精确表达,从而增强玉米对小斑病的持久抗性。基于目前来源于正向与反向遗传鉴定到的小斑病抗性基因的有限性,更要进一步分离克隆小斑病抗性基因,深入解析其抗病分子机制。从基因功能的角度出发,解析玉米与小斑病菌的相互识别、相互作用的分子机制,为小斑病的防治提供理论支撑。
小斑病的发生是严重影响玉米产量与质量的重要因素之一。20世纪80到90年代随着抗病品种的培育和推广,小斑病的发生和危害得到了基本控制,但近些年,由于单一抗病品种连续多年种植、耕作制度的改变以及气候变化等原因,玉米小斑病再次成为危害玉米生产的重要病害。做好玉米小斑病的防治,已经成为玉米生产中必须重点关注的研究领域。因此,在相关研究基础之上,加强对玉米小斑病的科学研究,并提出具有针对性和有效性的防治技术与方法,以便最大程度地减少小斑病对玉米生产的影响,为我国粮食安全生产保驾护航。

