小麦黄矮病及其抗性育种研究进展
李朝阳, 张朝阳, 刘 艳, 孔令让*
(1. 山东农业大学农学院,小麦育种全国重点实验室,泰安 271000;2. 中国农业科学院植物保护研究所,植物病虫害综合治理全国重点实验室,北京 100193)
由介体蚜虫传播的大麦黄矮病毒(barley yellow dwarf viruses, BYDVs) 是多种禾谷黄矮病毒的统称,侵染小麦后引起的小麦黄矮病是世界小麦种植区的重要病害,其在20世纪50年代美国加利福尼亚州首次发现并报道,随后北美洲、欧洲、大洋洲和亚洲等国家也陆续发现[1-3]。感病植株主要表现为叶片失绿、植株矮小、分蘖减少,严重时甚至不能结实。据报道,BYDVs发病率每增加1%,小麦产量损失为13~45 kg/hm2,在BYDVs流行年份可造成小麦减产20%~30%,严重时可达50%以上[4]。我国华北、东北及西北等冬小麦种植区域由于冬春季干旱少雨,十分有利于该病害的传播。近年来,随着全球气候变暖,蚜虫寄生性天敌的寄生率明显降低,使得蚜虫顺利越冬、繁殖,BYDVs毒源保存的几率大大增加[4]。此外,研究人员通过模拟自然寄主蚜虫传毒竞争试验,发现BYDVs编码的病毒沉默抑制子发生碱基突变可增强其在高温环境中的稳定性与沉默抑制子活性,提高其适应气候变暖的能力,从而导致病毒的持续流行和暴发[5]。因此,当前小麦黄矮病仍具有较大的潜在危害性,尤其在温带区域,黄矮病逐渐出现蔓延之势[2]。深入了解并有效防治黄矮病对于我国乃至世界小麦产业的发展至关重要。
BYDVs通过介体蚜虫以持久、循回、非增殖方式进行传播[6]。目前防治黄矮病以化学药物防治蚜虫为主,但这种措施会带来一系列环境与安全问题,通过发掘筛选抗黄矮病基因并选育抗病品种越来越受到人们的重视。
本文将从生物学、致病机理、抗性育种等方面对引起小麦黄矮病的BYDVs进行综述,旨在为小麦黄矮病防治及抗性育种提供参考。
1 BYDVs的生物学特性及分类地位
1.1 BYDVs对小麦的危害
在田间,BYDVs可在全生育期内侵染小麦并引起根系发育不良、植株不同程度矮化[6];发病叶叶尖出现倒“V”字形黄化,呈现表面光滑似有蜡质层的金黄色,尤其以旗叶发病症状最为明显,全株自上而下发病的病害特征是小麦黄矮病引起的叶片黄化与缺素缺水引起的叶片生理性黄化的主要区别[7]。有研究表明,BYDVs可以限制光合产物的运输,导致植物韧皮部退化,叶片变色,矮化,分蘖数与穗粒数减少,根系生长和籽粒重量受到显著影响[8]。小麦感染BYDVs后产量损失可达到5%~80%[2]。同时,感染BYDVs的时期越早,产量损失越大,如果在幼苗期感染BYDVs,平均产量损失将达到30%[9]。目前BYDVs已经成为全球谷物中最具经济损害性的病毒,加深对BYDVs的了解对小麦生产与粮食安全具有重要意义。
1.2 BYDVs的传播
蚜虫是传播BYDVs的唯一介体[10]。当蚜虫刺吸带毒植株的韧皮部时,BYDVs通过蚜虫食管到达肠道(中肠和后肠),在肠受体蛋白介导的胞吞和胞吐作用下穿过上皮细胞进入血淋巴进行循回,并在血淋巴中与次级共生菌Rickettsia相互作用以保持自身结构与功能的稳定[11-12]。BYDVs随后到达蚜虫副唾液腺并穿过唾液腺基底膜进入唾液,并随着蚜虫取食继续侵染其他健康的寄主植物。病毒在蚜虫体内循回过程中不能自我复制,并且一种BYDVs只能够特异性地穿过一种或少数几种介体蚜虫的基底膜,这也是传播BYDVs的介体蚜虫具有特异性的原因[11]。
当BYDVs通过蚜虫口针进入寄主植物韧皮部后,在最初侵入的细胞内进行复制与组装,并在运动蛋白的帮助下通过胞间连丝扩散到邻近的细胞,随植物韧皮部汁液进入维管组织,再扩散到其他组织中,完成对植物的系统性侵染。虽然BYDVs是一种系统侵染性病毒,但其在感病植株中的自我复制几乎完全局限于韧皮部组织内[13]。
2012年,Ingwell等发现,蚜虫获得BYDVs后更趋向于取食其他未感病的植株,感染BYDVs的小麦植株也可以通过释放某种挥发性物质吸引未携带BYDVs的介体蚜虫前来取食,由此提出了介体操纵假说(vector manipulation hypothesis,VMH)[14]。Hu等研究发现,BYDVs通过诱导感病小麦释放反式-2-己烯醛和癸醛来吸引未携带病毒的蚜虫取食,以便自身的广泛传播[10]。随后,越来越多的证据表明,病毒可以通过改变介体的行为促进自身的传播。Guo等详细阐明了病毒沉默抑制子对介体蚜虫行为和植物抗性的调控作用,发现病毒侵染使得植物活性氧(ROS)信号增强,进而增加蚜虫在不同植物上的转移扩散频率与刺吸频率,从而有利于蚜虫获毒及病毒转移扩散[15]。2021年,Shi等研究发现,当蚜虫取食寄主植物时,体内初级共生菌Buchneraaphidicola的动态变化介导调节宿主植物体内挥发性物质的改变,使得蚜虫更偏好取食健康寄主植物[16]。近期,Swayamjit等详细综述了寄主植物-病毒-介体之间相互关系的研究进展,指出在分子协同作用中,病毒或介体效应子可能已经进化到改变宿主植物,使双方在相互作用中受益[17]。因此,在田间小麦生长过程中,由于介体蚜虫的这种选择偏好的差异使得BYDVs往往从一个发病中心快速扩散传播,极大增强了病害控制的挑战性。
1.3 BYDVs的分类
早期,Rochow等根据介体蚜虫传毒的特异性将美国纽约州的BYDVs划分为PAV、MAV、RMV、RPV、SGV 共 5 个株系[18]。随后,根据基因组序列结构的差异,MAV、PAV 以及SGV被划分为亚组Ⅰ,仍被称为大麦黄矮病毒(barley yellow dwarf viruses, BYDVs),MAV与PAV在后续分类中被划入黄症病毒属Luteovirus,而RMV与RPV被划分为亚组Ⅱ,更名为禾谷黄矮病毒(cereal yellow dwarf viruses, CYDVs),后被归入马铃薯卷叶病毒属Polerovirus,这两个属随后被划入黄症病毒科Luteoviridae[19]。2002年,国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)将CYDV-RPV与BYDV-PAV中的强毒株系RPV-Mex1与PAV-129分别调整为CYDV-RPS与BYDV-PAS[20]。2013年,ICTV将RMV(CYDV-RMV)更名为玉米黄矮病毒RMV(maize yellow dwarf virus-RMV, MYDV-RMV),仍属于马铃薯卷叶病毒属[21]。与此同时,Svanella-Dumas等发现了两种新的大麦黄矮病毒,分别命名为BYDV-kerⅡ和 BYDV-kerⅢ,后被划入黄症病毒属中[22]。随着深度测序技术的发展,侵染麦类作物的新的黄矮病毒种类陆续被发现。如2016年在韩国发现侵染大麦的大麦病毒G(barley virus G,BVG)[23]以及在我国发现的通过玉米蚜Rhopalosiphummaidis传播的玉米黄花叶病毒(maize yellow mosaic virus, MaYMV)(也被称为MYDV-RMVⅡ)[24]。最新的报道表明MaYMV可侵染小麦[25]。新的技术也催生了新的分类方式。2021年,ICTV使用编码RNA依赖的RNA聚合酶(RdRp)的结构作为RNA病毒分类的基本单位,由此去除了黄症病毒科,并把黄症病毒属与马铃薯卷叶病毒属分别划分到番茄丛矮病毒科Tombusviridae及南方菜豆一品红花叶病毒科Solemoviridae[26]。
在我国,周广和等首次鉴定出4个BYDVs株系,分别是GPV、GAV、PAV与RMV[27]。早些年间,BYDV-GAV一直被认为是我国发生最普遍的小麦黄矮病病原[28-29],但近期研究表明,BYDV-PAV逐渐取代BYDV-GAV成为我国最为流行的黄矮病病原[30-32]。2020年,Khine等对我国及捷克共和国的BYDV-PAV的遗传多样性进行了分析,发现我国的BYDV-PAV群体具有更多的核酸变异性和差异性,因此,BYDV-PAV-CN很可能是黄症病毒属的新种[33]。除上述病毒外,近年来我国学者又陆续发现与BYDVs相似的小麦黄叶相关病毒(wheat leaf yellowing-associated virus, WLYaV)和小麦黄矮病毒(wheat yellow dwarf virus, WYDV)等两种侵染小麦的马铃薯卷叶病毒属新种[34-35]。
如前文所述,随着ICTV新报告的发布,BYDVs的很多名称可能会有所改变,但为了方便描述,我们在这里仍使用BYDVs代指原黄症病毒科的多种病毒,即黄症病毒属的BYDV-PAV、BYDV-PAS、BYDV-MAV、BYDV-kerⅡ和BYDV-ker Ⅲ,马铃薯卷叶病毒属的CYDV-RPV、CYDV-RPS和MYDV-RMV,以及尚未正式归属的BYDV-GPV和BYDV-SGV[26,36]。被ICTV正式承认的BYDVs相关病毒分类及相应的传毒介体蚜虫种类如下表所示(表1)。
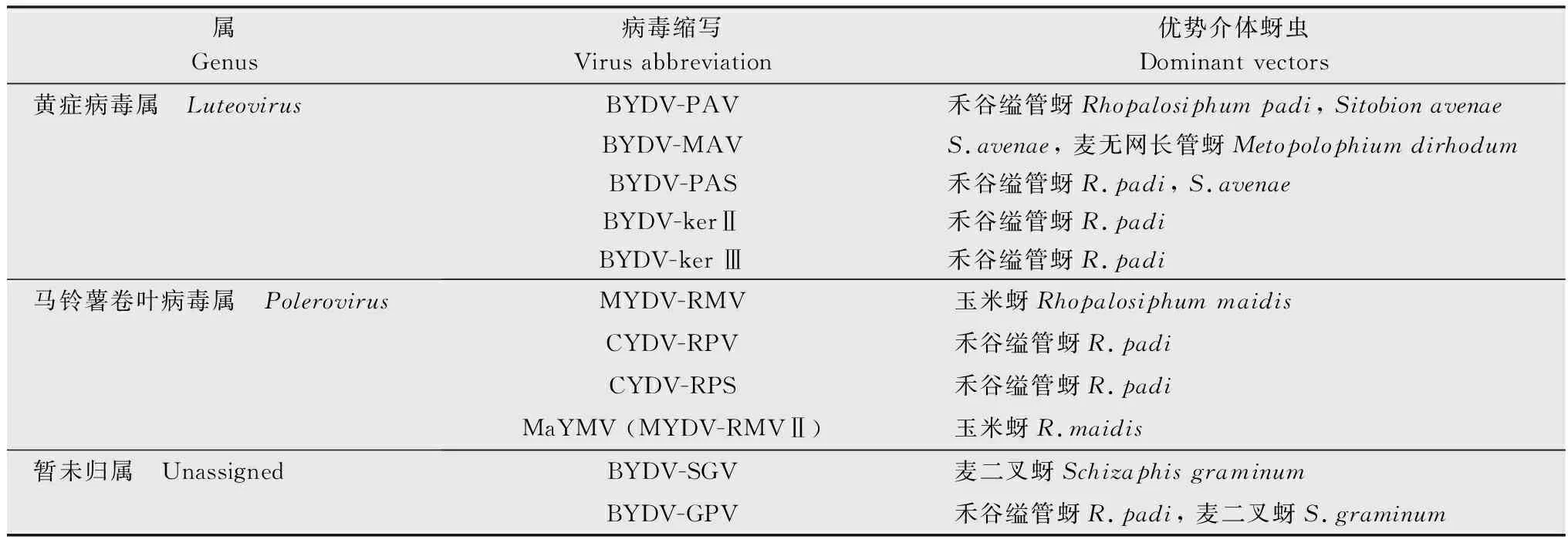
表1 BYDVs分类及优势介体蚜虫Table 1 Classification of BYDVs and dominant vector aphids
1.4 BYDVs的病害循环
在我国冬麦区、春麦区以及冬春麦混种区,BYDVs引起的小麦黄矮病的发生受到种植制度与麦蚜生活习性的影响。在冬麦区6月份左右,小麦成熟前,带毒有翅麦蚜迁飞至诸如小画眉草Eragrostisminor、野燕麦Avenafatua等越夏寄主上取食、繁殖并传播BYDVs。在成功越夏后,随着秋麦苗的生长,有翅带毒麦蚜从越夏寄主迁飞回麦苗上取食并传毒,BYDVs侵染麦苗后随麦苗越冬,而麦蚜以若虫、成虫或卵的形式在土壤缝隙、小麦茎基部等处藏匿越冬。次年春季,随着温度回暖,麦蚜大量繁殖并以冬前感病小麦为发病中心将病毒传播至整个麦田。一般情况下,小麦生育期内会出现返青拔节期及抽穗期两个发病高峰。而在春麦区,麦蚜无法正常越冬,因此会转移至利于越冬的冬麦区越冬,翌年再迁回春麦区传播病毒。在冬、春麦混种区,有翅麦蚜从冬麦区回迁至春麦区越夏,待秋季冬麦区小麦出苗后迁飞至冬小麦上取食并传播BYDVs[37]。
综上所述,BYDVs是经由介体蚜虫传播,病原众多,极具破坏力的病毒,该病毒在经由介体蚜虫传播至易感植株后会形成发病中心,并诱导感病植株释放相关挥发物质从而促进自身的传播。
2 BYDVs的致病机理
BYDVs为正义单链RNA,病毒粒子为球状正二十面体(T=3),直径25~30 nm,基因组全长5.7 kb,无3′端多聚腺苷酸Poly(A)尾巴和5′端帽子等特殊结构[38-39]。分属于黄症病毒属与马铃薯卷叶病毒属的BYDVs与CYDVs的基因组结构如图1和图2所示。这种高精简的基因组结构是长期进化选择的结果,既保障了遗传信息的完整性又为表达调控提供了可能[4,26]。加强基因组结构与致病机理研究有助于通过生物育种选育优良抗病品种及实施靶标药物的研制。

图1 BYDVs基因组结构示意图Fig.1 Diagram of the genome organization of BYDVs
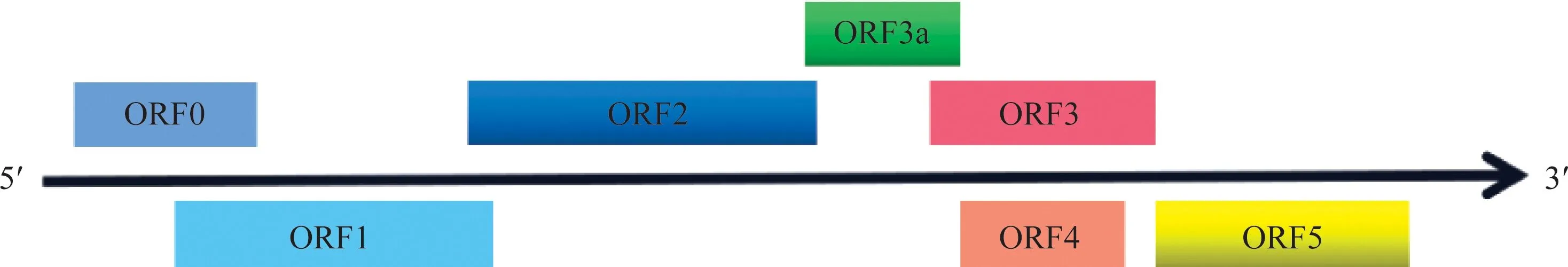
图2 CYDVs基因组结构示意图Fig.2 Diagram of the genome organization of CYDVs
ORF1与ORF2分别编码P1与P2蛋白,其被证实与BYDVs基因组的复制有关。P2蛋白包含RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase, RdRp)活性区域,然而,目前研究表明P2蛋白只能与P1蛋白形成融合蛋白发挥作用[40]。此外,值得注意的是,与BYDVs不同,CYDVs的5′端ORF0编码一种病毒沉默抑制子(viral suppressor of RNA silencing, VSR),可以与宿主体内E3-泛素连接酶相互作用,使得植物免疫应答反应体系中的重要元件AGO1(argonaute protein 1)泛素化后通过自噬途径降解,进而导致寄主体内RNA诱导沉默复合体(RNA-induced silencing complex, RISC)的形成受到抑制[41-44],即对寄主的抗病毒防御系统进行破坏,这可能是CYDVs具有更强致病力的原因[45-47]。
ORF3编码分子量约20 kD的BYDVs外壳蛋白(coat protein, CP),ORF5编码分子量约70 kD的外壳蛋白C端通读区域(the readthrough protein, RTP),在相关蛋白酶剪切后形成截短的蛋白,与外壳蛋白融合形成CP-RTP。因此,CP是病毒粒子外壳的基本单位。众多研究表明,在蚜虫特异性传播的过程中,完整的CP-RTP蛋白赋予了高度特异性的蚜虫传播特性,使用点突变对CP-RTP蛋白进行破坏后,病毒粒子虽然可以在蚜虫血淋巴中循回,但却无法穿过蚜虫副唾液腺基底膜进入寄主植物[48-49]。此外,RTP的N端可以与蚜虫体内的共生菌互作从而达到稳定病毒粒子的作用,并且可能在促进蚜虫获得病毒粒子方面发挥作用[50],RTP的C端则参与限制病毒在韧皮部的移动[51]。总之,完整的CP-RTP蛋白对维持寄主植物体内BYDVs形态结构稳定和BYDVs积累及扩散具有重要作用[26]。
ORF4编码的P4蛋白约17 kD,是BYDVs运动蛋白(movement protein, MP),研究表明,MP在病毒特异性穿过细胞胞间连丝完成细胞间运动过程中发挥重要作用[52-53]。近期,研究者筛选鉴定出12个与GAV的P4蛋白相互作用的宿主蛋白,这些蛋白主要包括促进ROS产生的蛋白、控制光形态建成和应激反应的蛋白相关的转录因子[54]。ROS是植物针对病原体的非特异性防御机制,因此,P4可能是诱导多个宿主防御反应的关键效应子;与此同时,P4还有一个功能,即破坏植物有丝分裂,引起细胞分裂的延迟,从而导致植株矮化症状[54]。除此之外,对于缺乏P0蛋白的BYDVs,P4蛋白还具备VSR功能,可以充当病毒毒力因子[55]。近期,Jin等阐述了大麦可以通过磷酸化“诱降”病毒P4蛋白来增强抗病毒RNAi的新机制,并提出了可以通过降低与P4蛋白相关的核酸酶基因SDN1的表达来增强植物抗病毒能力[56],暗示P4蛋白作为BYDVs毒力因子在靶标药物研制及转基因抗性育种方面的巨大潜力。
ORF6编码的P6蛋白是根据相关基因组的序列信息推测得到的,在BYDVs上特异性存在,然而时至今日还未在感病植株中检测到P6蛋白的存在[26]。2012年,Liu等证明BYDV-GAV的P6蛋白具有VSR功能[57]。然而,2017年,Fusaro等发现BYDV-PAV与BYDV-PAS的P4蛋白具备更强的RNA沉默抑制的功能,这表明相较于P6,一些BYDVs的P4蛋白更有可能具有毒力因子的功能[55]。因此,ORF6编码的P6蛋白的存在与相关功能仍然是一个谜,值得进一步探索。此外,与ORF6不同,通过生物信息学手段预测分析出的ORF3a编码的P3a蛋白目前已经通过血清学方法在寄主植物及原生质体中检测到,后通过研究证实,P3a协助P4蛋白促进细胞内和细胞间的运动,从而与P4蛋白及RTP蛋白C端部分共同在病毒粒子在植物韧皮部运输及扩散方面发挥重要作用[58]。
3 小麦黄矮病抗性育种
目前,对小麦黄矮病的防控主要采用化学药剂,例如通过药剂拌种以及田间喷施杀虫剂等方法控制田间介体蚜虫种群数量[39]。然而,使用化学药剂虽然可以有效控制黄矮病的发生,但我国小麦种植面积较大,大规模使用化学药剂防治黄矮病不仅需要付出较高的经济成本,而且还会产生众多环境问题。因此,通过将抗性基因导入培育优良抗性品种并加以推广是防治黄矮病的最优策略。
3.1 小麦及大麦中的BYDVs抗性资源
目前为止,尚未在小麦的初级基因库中发现对BYDVs具有显著抗性的基因。Bdv1是迄今为止报道的小麦中唯一的BYDVs耐病基因,该基因位于巴西春小麦品种‘Frontana’的7D染色体短臂上[59],但是经过表型鉴定发现其只对BYDV-MAV存在一定的耐病性,对其他BYDVs并未有明显的耐病性,反映出育种应用的局限性[60]。随后,对335份已知对BYDVs具有抗性或感病性的小麦材料进行了全基因组关联研究(genome-wide association studies, GWAS),发现了4个与BYDVs抗性显著相关的QTL位点[61],但由于连锁累赘等原因,尚未得到有效应用。
在大麦中陆续发现了4个BYDVs耐病基因,分别为Ryd1、Ryd2、Ryd3与Ryd4Hb。其中,位于3H染色体长臂上的Ryd2提供了对BYDV-PAV、BYDV-MAV和BYDV-SGV的耐病性[62-63],并培育出多种不同类型的大麦品种,譬如,在法国推广应用的‘Amistar’和‘Domino’冬性大麦品种[64]。但是,关于Ryd2的克隆与抗病机理仍处于探索阶段,暂未实现突破。Ryd3定位于大麦 6H 染色体短臂靠近着丝粒区域[65],目前已转移至春、冬大麦品种中[62]。2009年,在四倍体野生球茎大麦‘A17’中发现对BYDV-PAV具有完全抗性的Ryd4Hb[66],随后的研究表明,Ryd4Hb可能通过干扰介体蚜虫对植物韧皮部的取食而不是通过对BYDVs本身的耐病性实现对病毒的抗性,这充分体现了BYDVs抗性基因抗病机制的复杂性[67]。
3.2 小麦近缘物种中的BYDVs抗性资源
研究表明,在小麦野生近缘植物中存在着许多优良的黄矮病抗源材料,其中以中间偃麦草Thinopyrumintermedium研究最为广泛深入[60],研究表明中间偃麦草至少存在3个BYDVs抗性基因,分别为Bdv2、Bdv3与Bdv4。
Bdv2定位于中间偃麦草的第七同源群7X染色体长臂上,对BYDV-GAV、BYDV-PAV 以及BYDV-GPV 均具有很好的抗性[68]。众多研究者通过组织培养、‘中国春’(Chinese spring, CS)ph1b突变体诱导、γ射线照射等方式实现小麦背景下外缘染色质中靶基因的导入,从而创制出一系列可用于后续小麦抗黄矮病育种的种质材料。例如利用细胞组织培养技术创制出包括‘TC5-TC6’‘TC8-TC10’‘TC14’等7D-7Ai#1易位系,以及‘TC7’类型的7B-7Ai#1易位系[69-70]。利用ph1b突变体成功诱导小麦-中间偃麦草二体附加系L1的7X染色体与普通小麦染色体发生重组,从而培育出一批具有Bdv2的7DL-7Ai#1L易位系,如‘Yw642’‘Yw443’和‘Yw243’等[71-72]。Ayala-Navarrete等利用ph1b突变体成功将Bdv2与Lr19进行聚合,创制出一批既抗叶锈病又对BYDVs具有耐病性的种质材料[73]。2021年,Anderson等利用‘TC14’培育了新的抗黄矮病品种‘MN-Washburn’[74]。
Bdv3首次报道发现于小麦-中间偃麦草7E/7D代换系‘P29’中,随后被定位于中间偃麦草7E染色体上,对CYDV-RPV具有完全抗性,对BYDV-PAV和BYDV-MAV具有中等抗性[75-76]。前人将‘P29’与普通小麦品种‘Caldwell’杂交后代经γ射线进行照射处理后,产生了‘P961341’‘P98134’等一系列对BYDVs具有抗性的小麦-中间偃麦草7D-7E易位系[77-78]。Bdv4首次报道发现于小麦-中间偃麦草部分双二倍体‘无芒中4’中,被定位于中间偃麦草 2Ai-2 染色体上[60]。Lin 等进一步利用普通小麦‘中8601’ 与高抗 BYDVs 的小麦-中间偃麦草二体异附加系‘Z6’进行杂交并通过对杂种F1代进行组织培养,从中培育出携带Bdv4的抗BYDVs的小麦-中间偃麦草2Ai-2/2D 代换系‘N431’和‘N452’,2Ai-2/2B 代换系‘N420’ 和 ‘N439’,以及一个易位系‘Y5579’[79],极大地丰富了我国小麦抗黄矮病育种的种质资源。虽然前人取得了一系列成果,遗憾的是,除上述基因位点外,目前没有发现其他新的黄矮病抗性位点,而且这些已知抗性基因的克隆与机理解析也未取得重大突破,因此进一步扩大黄矮病抗性基因挖掘与克隆势在必行。
4 展望
由BYDVs侵染引起的小麦黄矮病是一种重要的植物病害,对小麦产量具有重要影响。多年来,众多研究者们对BYDVs传播、致病机理、抗性育种等方面进行了大量的研究,产生了一系列研究成果,在黄矮病防治及抗性品种培育方面做出了重要贡献。但是,依然存在一系列问题有待解决。
首先,有大量研究证实了寄主植物-BYDVs-介体蚜虫之间的相互作用关系,但相关研究还未在介体蚜虫群体控制及相关药剂开发方面得到充分应用,未来可以通过进一步加强对相关药剂的研发,从而对蚜虫进行综合治理,实现对黄矮病的绿色防治。
其次,多年来,科学家致力于BYDVs相关致病机理的研究并取得一定进展,但仍存在一些亟须探究的问题,例如ORF6的存在与具体功能,CP-RTP影响介体蚜虫特异性的确切原因等,此外,由于ORF4完全位于ORF3内部且编码如此重要的功能蛋白,因此关于两者的进化关系及趋势值得深入研究。阐明这些问题将有助于完善BYDVs致病机理,推动基于RNA沉默等手段应用于抗性育种,从而培育出抗黄矮病小麦新品种。
至目前为止,将相关抗性基因导入拟定小麦品种中从而培育抗性品种是黄矮病抗性育种的重要手段之一。但是,近期相关研究成果较少。因此,有关黄矮病抗性育种,建议可以从以下几个方面展开。首先,加强黄矮病抗性基因挖掘,进一步丰富抗病基因资源。其次,加快对已知抗病基因Bdv2、Bdv3等的克隆及机理解析,从而更好地实现抗性基因的有效利用。最后,有研究表明,Bdv2与Bdv4之间存在加性效应[80],暗示将相关抗性基因进行聚合可能会产生更强的抗病效果,从而培育出更具广谱抗性的优良品种。

