多黏菌素B雾化吸入在机械通气重症肺炎患者中的有效性和安全性Δ
杨依磊,张 虎,曹 佳,衣巧艳,黄 欣,李 妍,杨 蕊#[.山东第一医科大学第一附属医院(山东省千佛山医院)临床药学科,山东省儿童药物临床评价与研发工程技术研究中心,山东省医药卫生临床药学重点实验室,济南 5004;.山东第一医科大学第一附属医院(山东省千佛山医院)健康医疗大数据研究中心,济南 5004]
多黏菌素类药物自20 世纪50 年代问世后,虽安全性欠佳,但因其独特的作用机制和临床耐药率低的优势,被誉为抗击革兰氏阴性菌感染的“最后一道防线”[1]。多黏菌素类药物的临床定位是多重耐药(multi-drug resistance,MDR)革兰氏阴性菌引起的重症感染治疗,尤其是用于近年来日益增多的碳青霉烯类耐药革兰氏阴性菌(carbapenem-resistant organisms,CRO)感染的治疗[2—3]。
重症肺炎是临床中最常见的感染类型之一,伴随着重症支持治疗措施的增多,医院获得性肺炎(hospitalacquired pneumonia,HAP)和呼吸机相关肺炎(ventilatorassociated pneumonia,VAP)的发病率日益增高,其常见致病菌多为CRO。多黏菌素对CRO携带的碳青霉烯酶A 类KPC 酶、B 类金属酶以及D 类OXA 酶均有抑制作用,因此在国内外指南中被作为MDR相关HAP/VAP等抗感染治疗的一线推荐药物[4—5]。
作为一种多肽类大分子药物,多黏菌素在肺组织的穿透性值得商榷;同时,其最高耐受剂量有所限制,导致其在肺炎患者静脉用药时的肺组织药物浓度存在争议,因此部分指南/共识建议尽量在多黏菌素静脉用药基础上辅助多黏菌素雾化吸入用于多重耐药菌肺炎治疗[2—3,6—7]。然而,2022 年美国感染病学会指南、2022 年欧洲临床微生物与感染性疾病学会指南考虑到多黏菌素雾化吸入的安全性及有效性证据不足,并不推荐该给药方式[4,8—9]。目前,临床实践中是否在静脉给药基础上联合雾化吸入仍因循证证据不足而存在争议。此外,伴随国内近几年耐药形势的日益严峻,多黏菌素的应用与国外相比逐渐增多,但其在雾化吸入方面依旧缺乏来自真实世界的循证证据。基于此,本研究拟采用回顾性队列研究方法,对我院2021 年以来使用硫酸多黏菌素B 雾化吸入治疗机械通气重症肺炎患者的有效性和安全性进行分析,以期为多黏菌素B的雾化吸入使用提供真实世界的数据支持。
1 资料与方法
1.1 研究对象
选取我院2021年1月至2023年2月使用多黏菌素B雾化吸入联合静脉滴注(联合组)或多黏菌素B 单独静脉滴注(常规组)进行抗感染治疗的机械通气重症肺炎患者,根据给药途径不同分组。
本研究的纳入标准为:(1)符合重症肺炎诊断标准的住院患者[5,10];(2)住院期间使用多黏菌素B;(3)多黏菌素B 给药途径是静脉滴注或者联合雾化吸入;(4)多黏菌素B 的用药时间≥3 d;(5)住院期间进行机械通气。
本研究的排除标准为:(1)患者的治疗数据无法获得,如实验室指标缺失等;(2)妊娠期或哺乳期妇女。
1.2 治疗方法
常规组患者单独给予注射用硫酸多黏菌素B(上海上药第一生化药业有限公司,国药准字H31022631,规格为50万单位)静脉滴注,每次50万单位,q12 h;联合组患者除给予上述静脉给药方案外,同时给予注射用硫酸多黏菌素B雾化吸入,每次25万单位,q12 h。疗程通常为14 d,根据患者临床疗效进行具体调整。
1.3 数据采集
依托我院健康医疗大数据单病种云平台系统,采用回顾性队列研究方法,按纳排标准采集患者,记录其人口特征、合并疾病、合并状态以及合并感染情况,采集多黏菌素B给药前后的实验室检查指标,记录给药后患者转归、不良事件发生情况等,从而进行两组患者的有效性和安全性判断。对于无法从系统中得到的数据,则通过查询医院管理信息系统等进行数据补充。本研究方案已通过我院医学伦理委员会审批[批件号为YXLLKY-2022(026)号]。
1.4 结局指标及判别标准
1.4.1 有效性指标
(1)死亡率:“死亡”包括住院期间死亡以及出院后30 d内死亡。其中,住院死亡指患者住院期间因疾病恶化等原因死亡、出院诊断明确为死亡的患者。按下式计算死亡率:死亡率(%)=(住院期间死亡例数+出院后30 d内死亡例数)/纳入患者总例数×100%。
(2)临床有效率:“临床有效”定义为治疗后患者的临床症状、体征恢复正常或较治疗前好转,辅助检查结果如病原学及实验室检查结果均正常或较治疗前改善。与之相反,“治疗无效”指治疗后患者的临床症状、体征和病原学及实验室检查结果均无好转甚至加重[11]。按下式计算临床有效率:临床有效率(%)=临床有效例数/纳入患者总例数×100%。
(3)细菌清除率:“细菌清除”指治疗后来自原感染部位的标本未培养出原感染的致病菌,或者患者临床有效但其微生物检查未得到结果。“细菌未清除”指治疗后标本中仍培养出原感染的致病菌,或者患者临床无效的同时其微生物检查未得到结果[11]。按下式计算细菌清除率:细菌清除率(%)=细菌清除例数/用药前细菌检查阳性患者总例数×100%。
1.4.2 安全性指标
多黏菌素B的常见不良反应包括肾毒性、支气管痉挛(吸入时发生)以及皮肤色素沉着等[2]。因此,本研究选择的安全性指标包括血肌酐升高、支气管痉挛、皮肤色素沉着等不良事件的发生率。参照CTCAE 5.0版不良事件评价标准[12],血肌酐升高指血肌酐>正常上限(基线值正常)或1.5倍基线值(基线值不正常);支气管痉挛指给药后出现憋喘、呼吸困难、气促等症状;皮肤色素沉着指皮肤颜色加深,往往发生在头颈部等。不良事件发生率(%)=发生该不良事件的患者例数/纳入患者总例数×100%。
1.5 统计学分析
使用SPSS 25.0和R语言进行统计学分析。计数资料以频数/百分率(%)表示,使用χ2检验进行组间比较;符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Wilcoxon 秩和检验。死亡率是本研究的主要结局指标,故进一步对影响死亡率的因素进行单因素和多因素分析,其中单因素分析采用χ2检验,多因素分析采用Logistic回归分析。检验水准α=0.05。
2 结果
2.1 基本资料
共纳入87 例患者,其中联合组24 例、常规组63 例。两组患者的基线特征比较,差异无统计学意义(P>0.05),具有可比性。详情见表1。
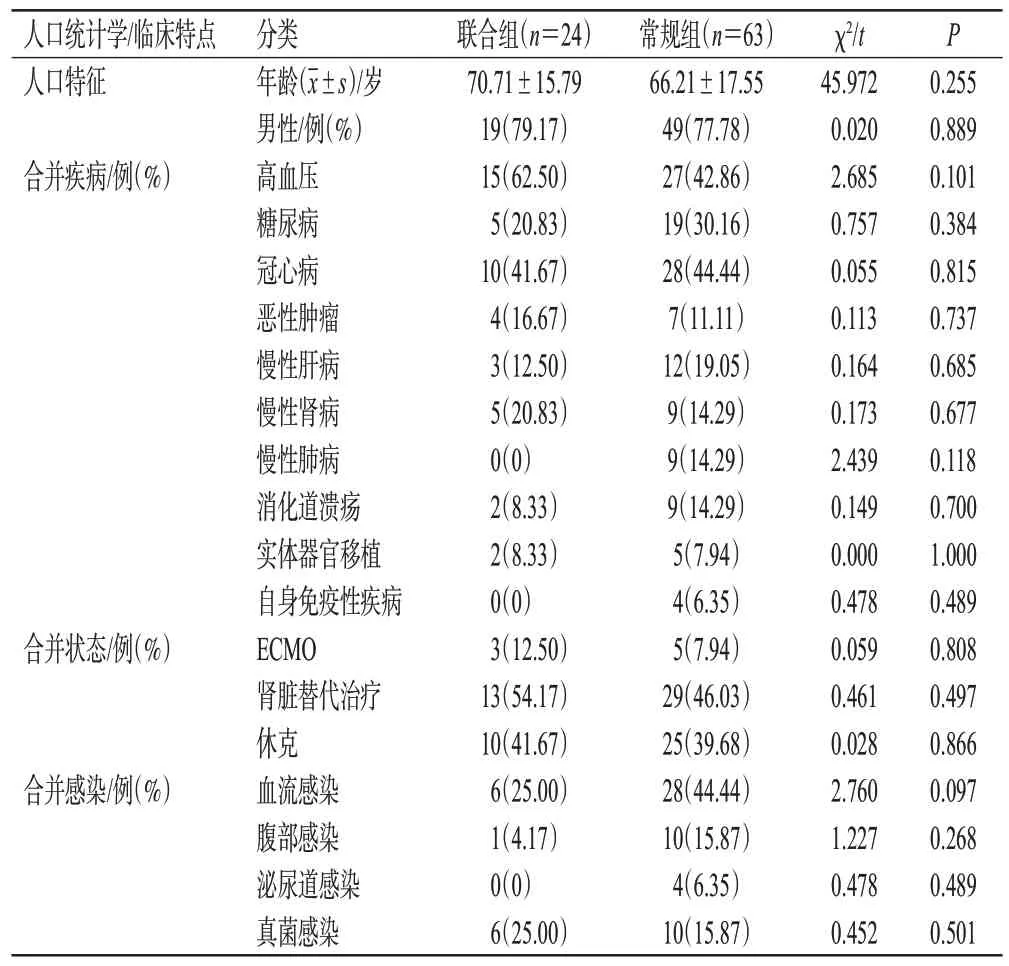
表1 两组患者的基线特征
2.2 有效性分析结果
两组患者共有35例患者死亡,总死亡率为40.23%;两组间总死亡率比较,差异无统计学意义(37.50% vs.41.27%,P=0.749)。联合组中有13例患者临床有效,临床有效率为54.17%;常规组中有35例患者临床有效,临床有效率为55.56%,两组间差异无统计学意义(P=0.907)。联合组患者的细菌清除率为45.83%,常规组为44.44%,两组间差异无统计学意义(P=0.907)。详情见表2。
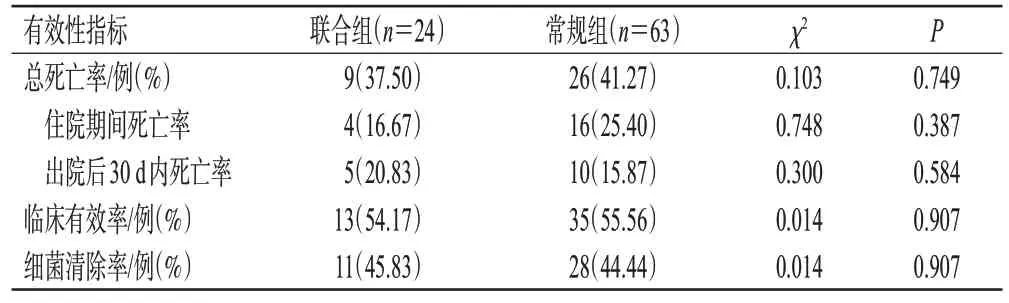
表2 两组患者有效性分析结果比较
2.3 安全性分析结果
联合组患者的支气管痉挛发生率显著高于常规组(12.50% vs. 0,P=0.028)。两组患者间的血肌酐升高和皮肤色素沉着发生率比较,差异均无统计学意义(P分别为0.693、0.129)。详情见表3。
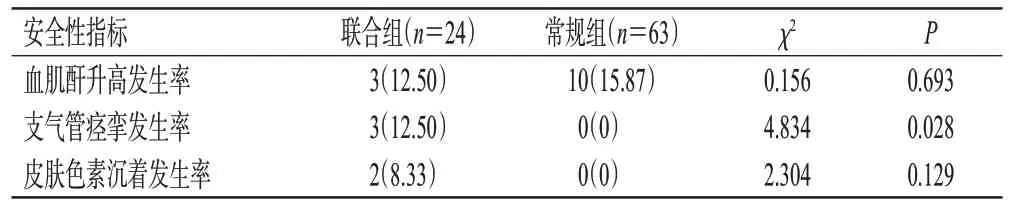
表3 两组患者安全性分析结果比较[例(%)]
2.4 影响死亡率的相关因素分析结果
2.4.1 单因素分析结果
根据患者的主要结局指标死亡率,将纳入患者分为死亡组(35 例)和非死亡组(52 例)。死亡率的单因素分析结果显示,感染鲍曼不动杆菌、感染肺炎克雷伯菌以及联用喹诺酮类药物的机械通气重症肺炎患者的死亡率较高(P<0.05)。详情见表4。

表4 影响患者死亡率的单因素分析结果
2.4.2 多因素Logistic回归分析结果
根据上述单因素分析结果,以感染鲍曼不动杆菌、感染肺炎克雷伯菌以及联用喹诺酮类药物作为自变量,进行影响患者死亡率的多因素Logistic回归分析。结果表明,感染鲍曼不动杆菌(OR=3.36,P=0.014)和联用喹诺酮类药物(OR=3.54,P=0.013)与患者死亡率独立相关(P<0.05)。详情见表5。
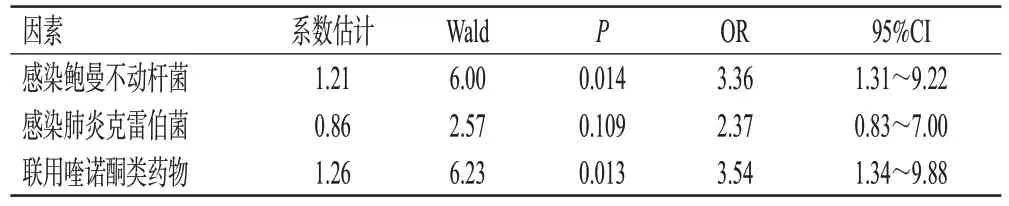
表5 影响患者死亡率的多因素Logistic回归分析结果
3 讨论
机械通气重症肺炎患者常见病原体是MDR革兰氏阴性杆菌,尤其是CRO。这些病原体耐药机制复杂,不仅是造成HAP/VAP 感染的主要病原体,也是导致重症肺炎高发病率、高死亡率的原因之一。多黏菌素是CRO的主要治疗药物之一,为增加肺部药物浓度,临床会在该药静脉给药的基础上联合其雾化吸入,但注射剂雾化吸入可导致呼吸道纤毛损伤、气道痉挛、急性肺水肿,且非雾化吸入制剂的药物无法达到有效雾化制剂的颗粒要求,会影响治疗效果。因此,不同指南/共识针对多黏菌素雾化吸入的推荐意见也存在差异[2,6,8,13—14]。但上述推荐意见基于的证据来源于体外细胞实验,且研究用剂量远超人体给药剂量,因此与临床实践存在较大差异[15]。另外,多黏菌素B主要限于国内使用,国内大规模使用集中于近两年,因此在雾化吸入方面发表的临床研究较少。值得注意的是,多黏菌素B的雾化吸入在我国属于超说明书用药,相关循证证据尚需进一步研究证实,在临床实践中要遵循医疗机构超说明书用药管理规定,权衡利弊后应用于潜在受益人群。本研究通过考察多黏菌素B 在雾化吸入联合静脉给药方面的有效性和安全性,可为临床提供真实世界数据支持。
3.1 有效性
(1)死亡率:本研究中联合组患者的总死亡率低于常规组,但差异不具有统计学意义(P=0.749),与近期发表的多项Meta分析结果类似[16—18]。Vardakas等[16]研究发现,多黏菌素联合组与常规组患者的死亡率分别为44.2%和51.4%,也与本研究结果类似。这些均提示机械通气重症肺炎患者的死亡率较高,需要临床早干预、早治疗。
(2)临床有效率和细菌清除率:本研究中联合组患者的临床有效率和细菌清除率与常规组相比,差异均无统计学意义(P均为0.907)。Cui 等[18]的Meta 分析结果显示,与单独静脉注射黏菌素相比,联合雾化吸入方案的临床治愈率显著提高(OR=1.72,95%CI 为1.15~2.59)。最新的系统评价和Meta 分析结果表明,黏菌素联合组在临床治疗效果方面与常规组无异(OR=1.39,95%CI为0.87~2.20),但联合组具有更高的微生物根除率(OR=2.21,95%CI 为1.25~3.92)[19]。上述文献结果与本研究结果存在一定差异,可能原因之一是黏菌素和多黏菌素B的作用不同,文献中黏菌素的国内通用名是甲磺酸多黏菌素E,该品种为多肽类前体药物,进入体内后需要逐步活化发挥作用,而硫酸多黏菌素B不需活化,可直接发挥杀菌作用,这提示在临床选择药物时需要注意不同品种之间的差异;另一个原因可能是本研究纳入的样本量有限,因此需要更大规模的临床研究进行验证。
3.2 安全性
(1)血肌酐升高:多黏菌素引起的肾毒性报道较多,发生率为0~76%,其中多数报道集中于30%~60%[2]。本研究中两组患者的血肌酐升高发生率差异无统计学意义(P=0.693),提示多黏菌素B 尤其是在其高剂量使用时需注意定期监测患者的血肌酐等指标,避免合用其他肾毒性药物(如氨基糖苷类),有条件的患者建议进行血药浓度监测。
(2)支气管痉挛:支气管痉挛是多黏菌素雾化吸入常见的不良反应,其原因与注射剂含有防腐剂、抗氧剂、pH值过高或过低等有关。最新的系统评价和Meta分析结果提示,多黏菌素吸入给药时发生支气管痉挛的风险与静脉给药组相比显著增加(OR=5.19,95%CI 为1.05~25.52)[17]。本研究结果显示,多黏菌素B雾化吸入导致支气管痉挛的发生率为12.50%,显著高于常规组的发生率(P<0.05),提示在多黏菌素B 雾化吸入过程中,要警惕支气管痉挛的发生,尤其是在患者初始给药时;一旦发生该不良反应,应立即停止吸入,并给予解痉平喘的药物,必要时给予抗组胺、糖皮质激素治疗。
(3)皮肤色素沉着:多黏菌素B 所致的皮肤色素沉着主要表现为头颈部皮肤颜色加深,其具体机制不明,考虑与多黏菌素B引起组胺释放,刺激朗格汉斯细胞增生,使皮肤真皮内的白细胞介素6过度表达引起表皮黑色素细胞大量着色有关[19]。有关共识报道的皮肤色素沉着发生率为8%~15%[2],与本研究中联合组患者8.33%的发生率相符。目前,皮肤色素沉着因不影响多黏菌素B的抗感染效果,暂无治疗对策,部分患者停用3个月后能自行恢复。
3.3 死亡率的影响因素
机械通气重症肺炎患者通常具有高龄、合并基础疾病、住院时间长且使用多种抗菌药物的特点,这些因素均可能影响患者的抗感染治疗效果。本研究的结局指标包括死亡率、有效率、细菌清除率,因死亡率是终点结局指标,故相对于其他中间结局指标更有临床意义。因此,本研究采用单因素分析法和多因素Logistic 回归分析法分析影响患者死亡率的相关因素。
结果表明,感染鲍曼不动杆菌和联用喹诺酮类药物与患者死亡率独立相关(P<0.05),是引起患者死亡率升高的危险因素。其中,鲍曼不动杆菌是临床常见分离菌,尤其常见于重症患者,多为碳青霉烯耐药鲍曼不动杆菌(carbapenem-resistantAcinetobacter baumannii,CRAB)。2022 年中国细菌耐药监测网(China antimicrobial surveillance network,CHINET)的数据表明,CRAB 近年来的耐药情况日益严重,其对多黏菌素和替加环素以外的抗菌药物的耐药率均超过了70%,是重症感染患者死亡的高危因素之一[20]。此外,根据2022 年CHINET 数据,我国HAP/VAP 常见病原体包括鲍曼不动杆菌、肺炎克雷伯菌和铜绿假单胞菌,这3种病原体对左氧氟沙星的耐药率分别为54.3%、30.2%、20.1%,对环丙沙星的耐药率分别为66.2%、40.3%、14.5%,可见这3 种常见病原体对喹诺酮类药物的耐药率偏高,值得临床警惕[20]。
综上所述,对于机械通气重症肺炎患者,多黏菌素B静脉滴注联合雾化吸入与单独静脉滴注相比,患者的死亡率、临床有效率和细菌清除率相当,血肌酐升高和皮肤色素沉着的不良反应发生率也无明显差异,反而雾化吸入提高了支气管痉挛的发生率,因此联合用药方案没有显示出治疗优势,临床选择时需要慎重。此外,感染鲍曼不动杆菌、联用喹诺酮类药物与机械通气重症肺炎患者的死亡率独立相关。但本研究为回顾性队列研究,资料收集可能存在一定程度的偏倚风险,同时受到样本量限制,因此所得结论仍需大样本、多中心、前瞻性临床研究证实。

