高良姜素促进骨质疏松模型大鼠骨折愈合的机制研究Δ
吴永铁,申雄成[遵义市第一人民医院(遵义医科大学第三附属医院)骨科二病区,贵州 遵义 563000]
骨质疏松(osteoporosis,OP)是一种以低骨量和骨组织微结构破坏为特征的常见老年疾病,因其易导致骨脆性增加和骨折的发生,所以OP患者的致残率较高[1]。目前临床上用来治疗OP 的药物多以雌激素类药物为主,但其会对人体产生不同程度的副作用[2]。因此,积极开发新的安全有效、副作用小的抗OP 天然活性成分显得尤为重要。高良姜素(galangin,Gal)是一种天然的类黄酮化合物,具有抗肿瘤、抗炎、抗糖尿病和神经保护等多种药理活性[3]。Gal可以减缓软骨细胞外基质降解,改善骨关节炎进展,可能是治疗骨关节炎的潜在候选药物[4]。据报道,Gal 可诱导人骨肉瘤MG-63 和U-2OS 细胞的成骨分化[5]。也有报道称,Gal可以通过抑制丝裂原激活蛋白激酶(mitogen activation protein kinase,MAPK)和核因子κB(nuclear factor-κB,NF-κB)信号通路抑制破骨细胞形成,从而有效抑制OP 的发展[6]。缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)/血管内皮生长因子(vascular endothelial growth factor,VEGF)介导的血管生成在骨折愈合中发挥重要作用。研究表明,HIF-1α/VEGF信号通路被激活后,HIF-1α活性增强,VEGF表达升高,可促进血管生成,预防骨质流失,最终增强骨折愈合[7—8]。但Gal 是否能通过调节HIF-1α/VEGF 信号通路促进OP 模型大鼠骨折愈合尚不清楚。因此,本研究基于HIF-1α/VEGF信号通路探讨Gal对OP模型大鼠骨折愈合的影响及可能的作用机制,以期为临床治疗OP 提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有HBS-ScanX 型多功能全自动酶标仪(南京德铁实验设备有限公司)、μCT-100型微计算机断层扫描(micro-computed tomography,micro-CT)设备(丹东奥龙射线仪器集团有限公司)、CX31型光学显微镜(日本Olympus公司)、EPS-300型电泳仪(上海天能科技有限公司)、DW-86L348型超低温冰箱(青岛澳柯玛股份有限公司)、BSA124S/BSA224S 型分析天平(德国Sartorius公司)。
1.2 主要药品与试剂
Gal对照品(批号LA1806,纯度≥98%)购自北京康瑞纳生物科技有限公司;PX-478(HIF-1α/VEGF 信号通路抑制剂,批号M00231-CVW)购自北京百奥莱博科技有限公司;骨钙素(osteocalcin,OCN)、Ⅰ型胶原交联C末端肽(C-terminal telopeptides of type Ⅰ collagen,CTX-Ⅰ)、骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)酶联免疫吸附测定(ELISA)试剂盒(批号分别为E-EL-R0243c 、E-EL-R1456c、E-EL-R0002c)购自武汉伊莱瑞特生物科技股份有限公司;蛋白提取试剂盒(批号YT8951)购自北京伊塔生物科技有限公司;兔源碱性磷酸酶(alkaline phosphatase,ALP)、HIF-1α、VEGF、血小板内皮细胞黏附分子1(platelet endothelial cell adhesion molecule-1,PECAM-1)、甘油醛-3-磷酸脱氢酶(GAPDH)一 抗(批 号 分 别 为ab83259、ab179483、ab214424、ab222783、ab9485)以及辣根过氧化物酶标记的羊抗兔IgG二抗(批号ab6721)均购自美国Abcam公司。
1.3 动物
本研究所用动物为SPF 级健康雌性SD 大鼠,共72只,8~10 周龄,体重180~200 g,购自贵州医科大学实验动物中心,生产许可证号为SCXK(黔)2018-0001。大鼠饲养环境温度为22 ℃,湿度为55%~60%,12 h 光暗循环,饲养期间自由摄食和饮水。适应性喂养1周后进行实验。本研究获得了本院伦理委员会的批准,批准号为伦审(2022)-2-08号。
2 方法
2.1 动物建模、分组与给药
取72 只大鼠分为造模组(n=60)和假手术(Sham)组(n=12)。造模组大鼠采用双侧卵巢切除手术构建OP大鼠模型,具体操作如下:对造模组大鼠行双侧卵巢切除术,卵巢切除后缝合伤口。12 周后利用小动物micro-CT 检测造模大鼠的腰椎骨密度(bone mineral density,BMD),当造模组大鼠BMD与Sham组相比显著降低时,即表明OP大鼠造模成功。腹腔注射3%戊巴比妥钠(50 mg/kg)麻醉大鼠,钢锯横向切断股骨中段,并用克氏针在髓腔内固定,缝合切口,以构建骨折模型,具体操作参考文献[9]。Sham组大鼠仅在卵巢周围结扎并切除相当大小的脂肪组织。将造模成功的60 只大鼠按照随机数字表法分成模型(Model)组和Gal低、中、高剂量组以及抑制剂组(HIF-1α/VEGF 信号通路抑制剂PX-478),每组12 只。Gal 低、中、高剂量组腹腔注射2.5、5、10 mg/kg 的Gal[6],抑制剂组腹腔注射10 mg/kg 的Gal 和100 mg/kg 的PX-478[10],Sham 组和Model 组腹腔注射等量生理盐水;每天1次,连续90 d。
2.2 大鼠股骨显微结构分析
各组取6 只大鼠麻醉处死,取出两侧股骨,漂洗干净,进行micro-CT。使用VGStudio Max 2.2 软件定量分析,获得BMD、骨体积分数(bone volume/total volume,BV/TV)、骨小梁数(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)。
2.3 大鼠股骨生物力学检测
将“2.2”项下大鼠左侧股骨水平放在跨度为20 mm的测试仪器的2 个支撑点上,以10 mm/min 的速率下压探头,至股骨中段断裂,利用仪器自带软件分析得到骨生物力学指标最大负载。
2.4 大鼠骨组织损伤及新生血管情况检测
采用苏木素-伊红(HE)染色观察骨组织损伤及新生血管情况。取“2.2”项下大鼠的右侧股骨骨折处骨痂组织,经多聚甲醛固定、乙二胺四乙酸脱钙、梯度乙醇脱水、包埋切片(厚度为5 μm)、脱蜡和水化后进行HE 染色,最后在显微镜下观察大鼠骨组织损伤并分析新生血管数量和面积。
2.5 大鼠股骨中PECAM-1表达情况检测
采用免疫荧光染色法检测大鼠股骨中PECAM-1表达。取“2.2”项下大鼠左侧股骨,经固定、脱钙、包埋切片(5 μm)、磷酸盐缓冲液(PBS)漂洗后加入PECAM-1 一抗,4 ℃避光孵育过夜;加入辣根过氧化物酶标记的羊抗兔IgG 二抗,室温下避光孵育1 h,经PBS 洗涤、DAPI 避光复染5 min、封片后,采用荧光显微镜观察并拍摄照片。采用Image J软件计算PECAM-1的平均荧光强度。
2.6 大鼠血清中OCN、CTX-Ⅰ、BMP-2含量测定
采用ELISA 法进行检测。取每组剩余的6 只大鼠的腹主动脉血,以3 000 r/min离心15 min,取上层血清,根据试剂盒说明书方法检测大鼠血清中OCN、CTX-Ⅰ、BMP-2的含量。
2.7 大鼠骨痂组织中ALP、HIF-1α、VEGF 蛋白表达检测
采用Western blot法进行检测。麻醉处死“2.6”项下取血后的大鼠,提取其骨痂组织中的总蛋白,通过BCA法测定总蛋白浓度。将蛋白高温变性,取120 μg变性蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(电压120 V,电泳时间60 min),转膜(电流250 mA,转膜时间60 min),以5%脱脂奶粉室温封闭2 h;分别加入ALP(稀释比例1∶1 000)、HIF-1α(稀释比例1∶2 000)、VEGF(稀释比例1∶1 000)、GAPDH(稀释比例1∶1 000)一抗,4 ℃孵育过夜;洗膜后加入辣根过氧化物酶标记的羊抗兔IgG二抗(稀释比例1∶2 000),室温孵育90 min;洗膜后,采用ECL 发光显影。以Image J 软件分析蛋白条带的灰度值,以目的蛋白与内参蛋白(GAPDH)条带灰度值的比值表示目的蛋白的相对表达水平。
2.8 统计学方法
实验数据用GraphPad Prism 9.0 软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,两组间比较采用SNK-q检验。检验水准α=0.05。
3 结果
3.1 Gal对大鼠股骨显微结构的影响
与Sham 组比较,Model 组大鼠股骨BMD、BV/TV、Tb.N、Tb.Th 均显著降低(P<0.05);与Model 组比较,Gal低、中、高剂量组大鼠股骨BMD、BV/TV、Tb.N、Tb.Th均显著升高(P<0.05),且具有明显的剂量依赖性;与Gal 高剂量组比较,抑制剂组大鼠股骨BMD、BV/TV、Tb.N、Tb.Th均显著降低(P<0.05)。结果见图1、表1。
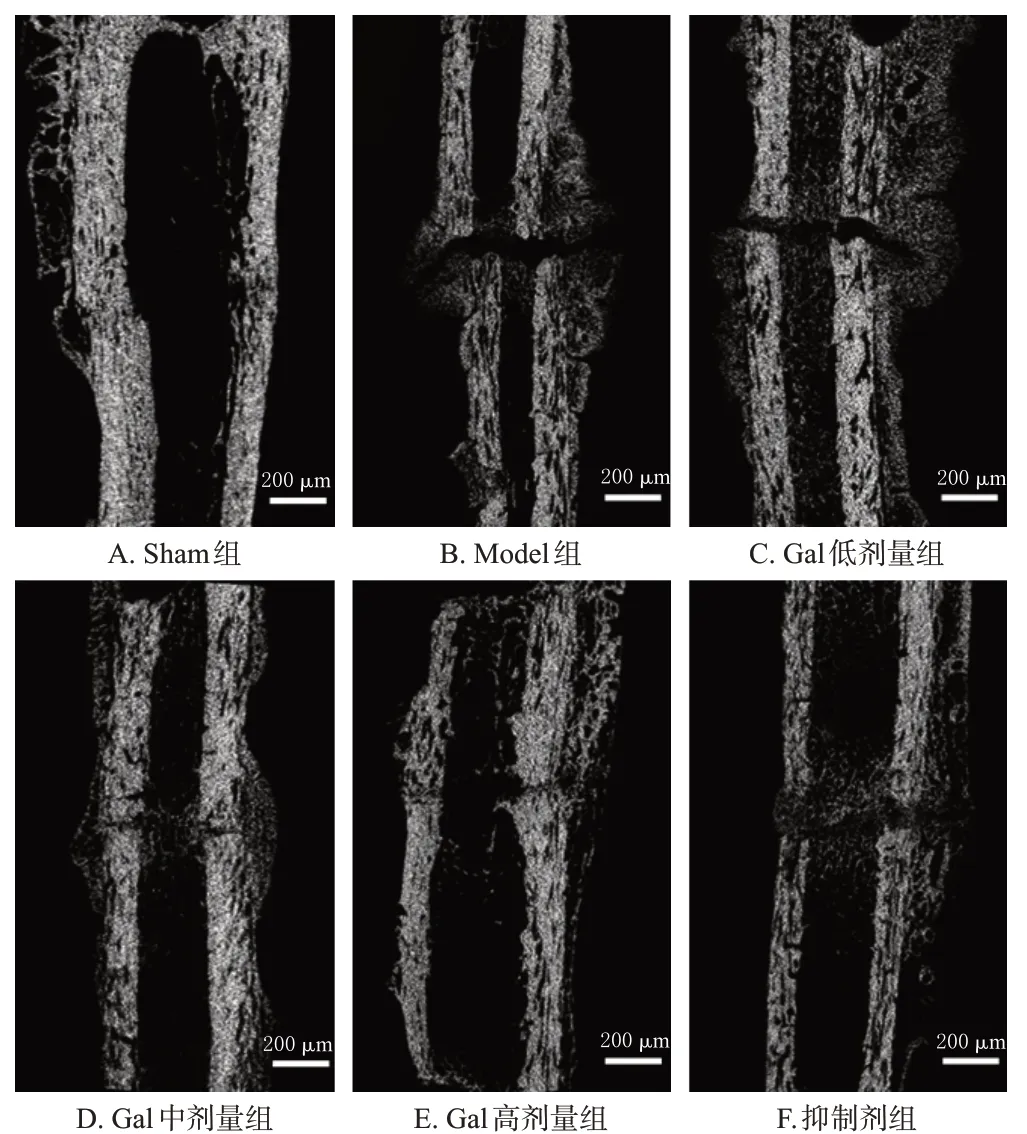
图1 各组大鼠股骨Micro-CT结果
表1 各组大鼠股骨显微结构指标的比较(±s,n=6)
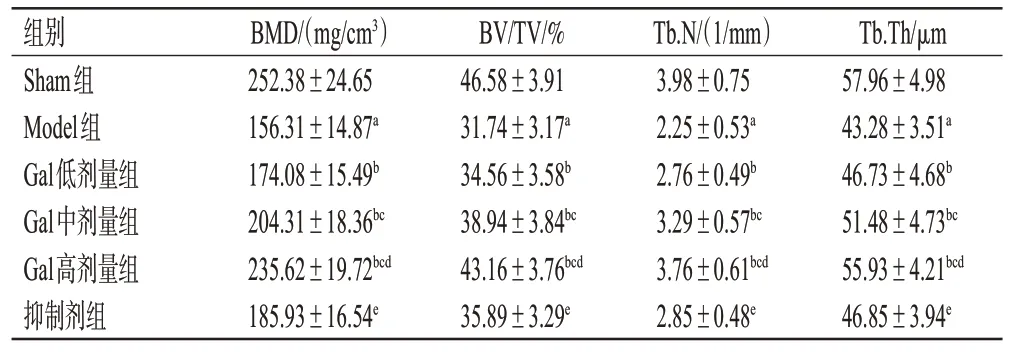
表1 各组大鼠股骨显微结构指标的比较(±s,n=6)
a:与Sham组比较,P<0.05;b:与Model组比较,P<0.05;c:与Gal低剂量组比较,P<0.05;d:与Gal中剂量组比较,P<0.05;e:与Gal高剂量组比较,P<0.05。
BMD/(mg/cm3)252.38±24.65 156.31±14.87a 174.08±15.49b 204.31±18.36bc 235.62±19.72bcd 185.93±16.54e Tb.Th/μm 57.96±4.98 43.28±3.51a 46.73±4.68b 51.48±4.73bc 55.93±4.21bcd 46.85±3.94e组别Sham组Model组Gal低剂量组Gal中剂量组Gal高剂量组抑制剂组BV/TV/%46.58±3.91 31.74±3.17a 34.56±3.58b 38.94±3.84bc 43.16±3.76bcd 35.89±3.29e Tb.N/(1/mm)3.98±0.75 2.25±0.53a 2.76±0.49b 3.29±0.57bc 3.76±0.61bcd 2.85±0.48e
3.2 Gal对大鼠股骨生物力学的影响
与Sham 组[(49.48±3.76) N]比较,Model 组大鼠股骨最大负载[(23.68±2.59) N]显著降低(P<0.05);与Model 组比较,Gal 低、中、高剂量组大鼠股骨最大负载[分别为(27.36±2.84)、(32.54±3.17)、(37.83±3.69) N]均显著升高(P<0.05),且具有明显的剂量依赖性;与Gal 高剂量组比较,抑制剂组大鼠股骨最大负载[(28.46±2.75) N]显著降低(P<0.05)。
3.3 Gal对大鼠骨组织病理损伤的影响
Sham组大鼠骨组织中骨小梁数量多、较粗、致密分布;与Sham 组比较,Model 组大鼠骨组织中骨小梁数量减少、变薄、间隙增大、结构较乱和疏松,新生血管数量和血管面积均显著减少/减小(P<0.05);与Model 组比较,Gal 低、中、高剂量组大鼠骨组织中骨小梁数量和厚度明显改善、间距减小、结构更密集、排列整齐,新生血管数量和血管面积均显著增多/增大(P<0.05),且具有明显的剂量依赖性;与Gal高剂量组比较,抑制剂组大鼠骨组织中骨小梁数量减少、变细、间距增大、结构较为疏松,新生血管数量和血管面积均显著减少/减小(P<0.05)。结果见图2和表2。
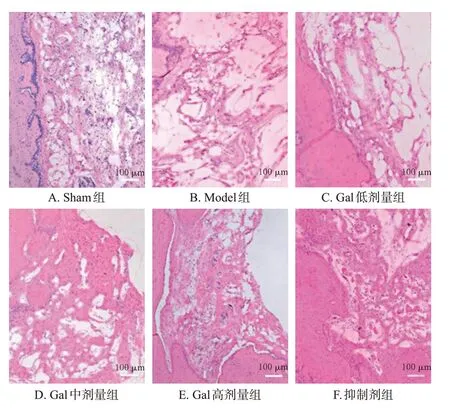
图2 各组大鼠骨组织的HE染色显微图
表2 各组大鼠新生血管数量、血管面积和PECAM-1表达的比较(±s,n=6)
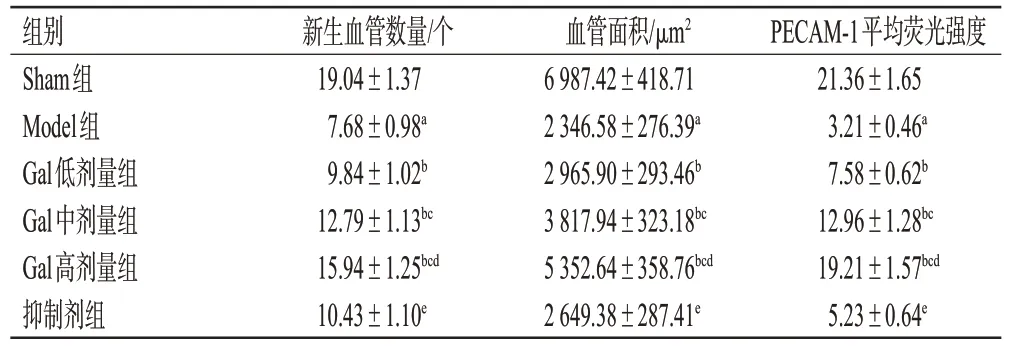
表2 各组大鼠新生血管数量、血管面积和PECAM-1表达的比较(±s,n=6)
a:与Sham组比较,P<0.05;b:与Model组比较,P<0.05;c:与Gal低剂量组比较,P<0.05;d:与Gal中剂量组比较,P<0.05;e:与Gal高剂量组比较,P<0.05。
血管面积/μm2 6 987.42±418.71 2 346.58±276.39a 2 965.90±293.46b 3 817.94±323.18bc 5 352.64±358.76bcd 2 649.38±287.41e PECAM-1平均荧光强度21.36±1.65 3.21±0.46a 7.58±0.62b 12.96±1.28bc 19.21±1.57bcd 5.23±0.64e组别Sham组Model组Gal低剂量组Gal中剂量组Gal高剂量组抑制剂组新生血管数量/个19.04±1.37 7.68±0.98a 9.84±1.02b 12.79±1.13bc 15.94±1.25bcd 10.43±1.10e
3.4 Gal对大鼠股骨中PECAM-1表达的影响
与Sham 组比较,Model 组大鼠股骨中PECAM-1 平均荧光强度显著降低(P<0.05);与Model 组比较,Gal低、中、高剂量组大鼠股骨中PECAM-1平均荧光强度均显著升高(P<0.05),且具有明显的剂量依赖性;与Gal高剂量组比较,抑制剂组大鼠股骨中PECAM-1 平均荧光强度显著降低(P<0.05)。结果见图3、表2。
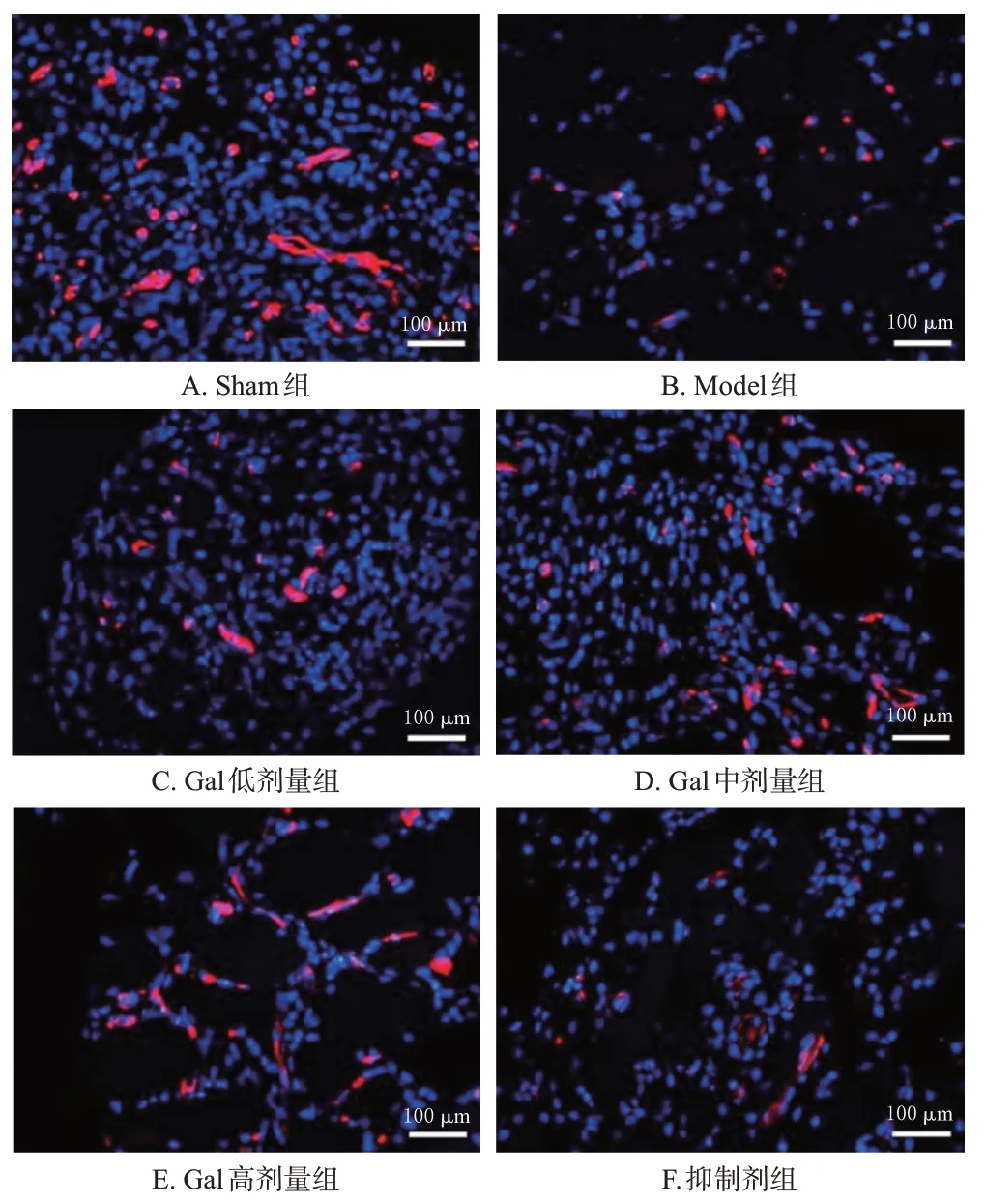
图3 各组大鼠股骨中PECAM-1表达的免疫荧光图
3.5 Gal 对大鼠血清中OCN、CTX-Ⅰ、BMP-2 含量的影响
与Sham 组比较,Model 组大鼠血清中OCN、BMP-2含量均显著降低(P<0.05),CTX-Ⅰ含量显著升高(P<0.05);与Model组比较,Gal低、中、高剂量组大鼠血清中OCN、BMP-2 含量均显著升高(P<0.05),CTX-Ⅰ含量均显著降低(P<0.05),且具有明显的剂量依赖性;与Gal 高剂量组比较,抑制剂组大鼠血清中OCN、BMP-2含量均显著降低(P<0.05),CTX-Ⅰ含量显著升高(P<0.05)。结果见表3。
表3 各组大鼠血清中OCN、CTX-Ⅰ、BMP-2含量的比较(±s,n=6,ng/mL)
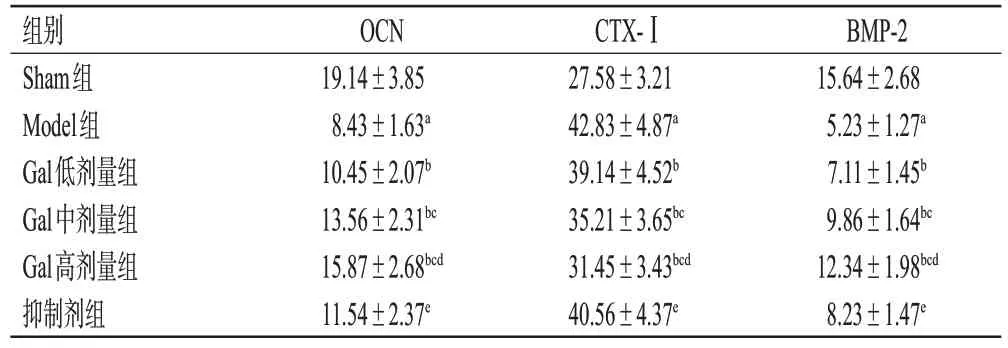
表3 各组大鼠血清中OCN、CTX-Ⅰ、BMP-2含量的比较(±s,n=6,ng/mL)
a:与Sham组比较,P<0.05;b:与Model组比较,P<0.05;c:与Gal低剂量组比较,P<0.05;d:与Gal中剂量组比较,P<0.05;e:与Gal高剂量组比较,P<0.05。
BMP-2 15.64±2.68 5.23±1.27a 7.11±1.45b 9.86±1.64bc 12.34±1.98bcd 8.23±1.47e组别Sham组Model组Gal低剂量组Gal中剂量组Gal高剂量组抑制剂组OCN 19.14±3.85 8.43±1.63a 10.45±2.07b 13.56±2.31bc 15.87±2.68bcd 11.54±2.37e CTX-Ⅰ27.58±3.21 42.83±4.87a 39.14±4.52b 35.21±3.65bc 31.45±3.43bcd 40.56±4.37e
3.6 Gal 对大鼠骨痂组织中ALP、HIF-1α、VEGF 蛋白表达的影响
与Sham 组比较,Model 组大鼠骨痂组织中ALP、HIF-1α、VEGF 蛋白表达水平均显著降低(P<0.05);与Model 组比较,Gal 低、中、高剂量组大鼠骨痂组织中ALP、HIF-1α、VEGF 蛋白表达水平均显著升高(P<0.05),且具有明显的剂量依赖性;与Gal高剂量组比较,抑制剂组大鼠骨痂组织中ALP、HIF-1α、VEGF蛋白表达水平均显著降低(P<0.05)。结果见图4、表4。
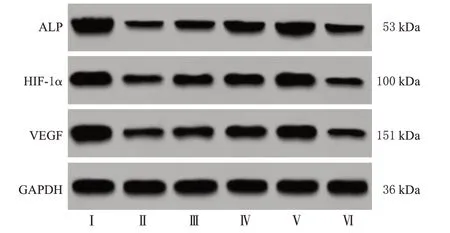
图4 各组大鼠骨痂组织中ALP、HIF-1α、VEGF 蛋白表达的电泳图
表4 各组大鼠骨痂组织中ALP、HIF-1α、VEGF 蛋白表达水平比较(±s,n=6)

表4 各组大鼠骨痂组织中ALP、HIF-1α、VEGF 蛋白表达水平比较(±s,n=6)
a:与Sham组比较,P<0.05;b:与Model组比较,P<0.05;c:与Gal低剂量组比较,P<0.05;d:与Gal中剂量组比较,P<0.05;e:与Gal高剂量组比较,P<0.05。
VEGF/GAPDH 1.67±0.18 0.29±0.03a 0.60±0.07b 0.94±0.08bc 1.42±0.13bcd 0.37±0.04e组别Sham组Model组Gal低剂量组Gal中剂量组Gal高剂量组抑制剂组ALP/GAPDH 1.86±0.21 0.31±0.02a 0.67±0.07b 1.15±0.10bc 1.65±0.15bcd 0.72±0.09e HIF-1α/GAPDH 1.47±0.12 0.36±0.04a 0.69±0.08b 1.08±0.10bc 1.35±0.12bcd 0.53±0.05e
4 讨论
OP是全身性代谢性骨病,随着年龄的增长,发病率在逐渐升高,尤其在绝经后的女性中表现得更加明显;OP 与骨痂形成、骨生长减少、骨密度降低、生物力学强度降低以及骨折愈合过程中细胞分化延迟有关[1—2]。因此,积极探索安全有效的促进骨折愈合的药物对临床治疗OP具有重要意义。本研究采用双侧卵巢切除手术构建OP 大鼠模型,对其进行研究发现,Model 组大鼠BMD、BV/TV、Tb.N、Tb.Th 均降低,股骨显微结构显著受损,最大负载显著下降,生物力学强度降低,与前人研究结果一致[9],提示OP模型大鼠构建成功。
黄酮类化合物作为一大类天然化合物,普遍存在于食物和植物中,并且可通过调节不同途径来影响OP。例如芦丁通过调节蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路,抑制绝经后的OP[11];槲皮素通过G 蛋白偶联受体C族6成员A/AMP活化蛋白激酶/哺乳动物雷帕霉素靶蛋白信号通路调节葡萄糖和脂质代谢来减轻小鼠睾丸切除术后的OP[12]。Gal 是一种天然黄酮类化合物,也是高良姜的主要活性成分,因其对骨骼相关疾病显示出良好的药理活性而备受关注。Gal通过减弱NFκB受体激活蛋白配体活性,诱导Jun激酶和NF-κB途径的激活,进而防止破骨细胞前体和胶原蛋白诱导的关节炎模型小鼠的骨破坏[13]。Gal可上调人羊膜间充质干细胞中早期成骨细胞特异性标志物(即ALP、Runt 相关转录因子2 蛋白、成骨细胞特异性转录因子Osterix)以及晚期成骨细胞特异性标志物(Ⅰ型胶原α1链蛋白、骨桥蛋白和OCN)的mRNA和蛋白表达,促进人羊膜间充质干细胞的成骨分化[14]。Gal通过激活富含脯氨酸/精氨酸的亮氨酸末端重复蛋白,在体内外显著改善骨关节炎的进展[4]。Li 等[6]研究还表明,Gal 可通过调节胞外信号调节激酶和NF-κB 途径,抑制破骨形成来抑制OP。但目前Gal 对OP 模型大鼠骨折愈合的影响尚不清楚。本研究发现,Gal 可减轻OP 模型大鼠股骨显微结构损伤,提高骨密度,增加最大负载,改善骨生物力学性能,升高血清中OCN 和BMP-2 含量,上调ALP 蛋白表达,并降低CTX-Ⅰ含量。ALP可在一定程度上反映细胞矿化及成骨分化的能力[14]。OCN是骨中最丰富的非胶原蛋白,也是成骨分化过程中晚期阶段的标志性物质,在成骨细胞中特异性表达,维持骨重建、吸收和矿化[15]。BMP-2 参与调节成骨细胞分化,是软骨和骨形成的主要诱导因子[15]。CTX-Ⅰ是骨Ⅰ型胶原的降解产物,可作为骨吸收的标志物[15]。这提示,Gal可能是通过调节骨代谢,抑制去卵巢OP模型大鼠骨流失,促进骨折愈合,从而发挥抗大鼠OP的作用。
骨是一种高度血管化的组织,其广泛的血管和毛细血管网络,可为骨的形成和发育提供氧气和营养,血管生成在OP过程中起着至关重要的作用[16]。骨微环境中的血管生成是骨骼生长发育、骨折后修复和维持骨骼健康所必需的,OP 或骨质减少患者的血液供应量相对低于骨量正常的人,表明骨血液供应与骨矿物质密度高度相关[17]。因此,激活骨微环境中的血管生成可能是预防OP的重要策略。HIF1-α信号通路的激活增加了骨血管的形成,并参与了骨重塑;成骨细胞中HIF1-α基因的敲除导致骨血管化和成骨减少;成骨细胞中HIF1-α信号通路的激活不仅可以抑制雌激素缺乏引起的骨质流失,还可以促进骨形成和血管生成[18—19]。VEGF是HIF1-α的下游基因,成骨细胞分化过程中VEGF 的表达增加,可促进血管生成、骨形成和重塑[18—19]。PECAM-1广泛分布于血管内皮细胞中,主要参与血管形成等生理活动,可作为评估血管形成的标记分子[20]。本研究发现,在OP模型大鼠中PECAM-1、HIF-1α和VEGF蛋白表达降低,OP 模型大鼠的血管数量和血管面积也显著减少/减小;Gal 可促进PECAM-1、HIF-1α 和VEGF 蛋白表达,增加血管数量和血管面积。而使用HIF1-α/VEGF 信号通路抑制剂后,大鼠血管数量和血管面积减少,减弱了Gal对OP模型大鼠的骨折愈合促进作用。这提示,Gal可通过HIF1-α/VEGF 信号通路调节骨代谢,改善OP 模型大鼠骨密度,促进骨折愈合。
综上所述,Gal 可调节骨代谢,改善OP 模型大鼠骨密度,促进骨折愈合;其作用机制可能与激活HIF1-α/VEGF 信号通路,促进血管生成有关。然而本研究尚存在不足之处,仅验证了Gal对HIF1-α/VEGF信号通路的作用,未对其他靶点、途径进行验证,后续研究将会进一步明确Gal在OP中的作用机制。

