当归多糖改善先兆流产模型大鼠Th1/Th2失衡及保胎作用Δ
孙 哲,刘 莲,张泰魏,王 琪,周意园,张昌容,华诏召#(.贵州中医药大学第一附属医院妇科,贵阳 55000;.贵州医科大学临床微生物与免疫学教研室,贵阳 55000;.贵州中医药大学第一附属医院优生研究中心,贵阳 55000;.贵州中医药大学第二附属医院产科,贵阳 55000)
先兆流产是女性妊娠早期出现的腰痛、下腹痛或阴道出血等症状,若不及时进行干预治疗最终会导致流产,甚至给母体生命安全带来危害,严重影响孕妇身心健康及家庭幸福。免疫细胞分化异常及其产生的细胞因子失衡是妊娠失败及流产的重要原因,纠正Th1/Th2型细胞因子的病理偏移状态可改善先兆流产患者内分泌水平,并减轻其症状[1—2]。此外,磷脂酰肌醇3激酶(phosphoinositide 3-kinases,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路与细胞代谢、免疫调节和激素水平调节有关,参与介导了药对黄芩-白术对先兆流产的治疗过程[3]。激活PI3K/AKT信号通路可降低Th1/Th2比值,减轻免疫炎症,进而促进肾移植存活[4];还可减轻巨噬细胞M1 极化,进而通过抑制炎症来改善脂多糖诱导的小鼠流产症状[5]。由此可知,通过激活PI3K/AKT信号通路来改善Th1/Th2平衡可能是防治先兆流产的重要手段。
当归多糖是中药当归中的天然多糖类物质,可通过减少促炎因子的表达和释放,进而抑制妊娠期易栓症模型大鼠的血栓形成[6]。此外,胡燕等[7]研究表明,当归多糖可上调PI3K/AKT 信号通路相关蛋白表达,并降低复发性流产模型大鼠的胚胎死亡率。但当归多糖是否可通过激活PI3K/AKT信号通路来改善先兆流产患者Th1/Th2平衡,并发挥保胎作用目前还不清楚。鉴于此,本研究通过构建先兆流产大鼠模型,探究当归多糖调节PI3K/AKT 信号通路对其Th1/Th2 平衡及胚胎存活的影响,旨在阐明当归多糖防治先兆流产的作用机制。
1 材料
1.1 主要仪器
RAYTO RT-2100C 型自动酶标仪购自北京华仪通泰环保科技有限公司;HS-3090 型冰冻切片机购自北京德耳斯仪器有限公司;EVOS M7000 型显微镜、AttuneTMNxT 型流式细胞仪均购自赛默飞世尔科技(中国)有限公司;DYY-6C型双稳电泳仪、HE-120型电泳槽、VE-186型转印电泳槽均购自南京普阳科学仪器研究所。
1.2 主要药品与试剂
当归多糖(批号CY110320,纯度98%)购自陕西慈缘生物技术有限公司;米非司酮(批号410003-201301,纯度99.5%)、米索前列醇(批号410004-201502,纯度98.9%)购自南京森贝伽生物科技有限公司;PI3K/AKT信号通路抑制剂LY294002(批号L9908,纯度≥98%)购自美国Sigma公司;大鼠雌激素、孕激素、干扰素γ(interferon-γ,IFN-γ)、白细胞介素4(interleukin-4,IL-4)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(批号分别为CB10268-Ra、CB11530-Ra、CB10173-Ra、CB10216-Ra、CB11057-Ra)购自上海科艾博生物技术有限公司;苏木素-伊红(HE)染色试剂盒、FITC 标记的抗大鼠CD4 抗体、APC 标记的抗大鼠IFN-γ 抗体、PE标记的抗大鼠IL-4 抗体和兔源抗大鼠磷酸化PI3K(p-PI3K)、PI3K、磷酸化AKT(p-AKT)、AKT、GAPDH 一抗以及HRP 标记的山羊抗兔IgG 二抗购自上海优宁维生物科技股份有限公司;外周血单个核细胞(peripheral blood mononuclear cell,PBMC)分离试剂盒购自北京汇智和源生物技术有限公司。
1.3 动物
本研究所用动物为SPF级SD大鼠(雄性大鼠27只,约7周龄,体重215~245 g;雌性大鼠54只,约8周龄,体重210~240 g),购自陆军军医大学医学实验动物中心,生产合格证号为SCXK(渝)2022-0011。所有大鼠均饲养于贵州中医药大学第一附属医院SPF级动物房内,动物房内环境条件设为温度22~25 ℃、相对湿度55%~60%、光照/昼夜各12 h循环。本研究通过了贵州中医药大学动物伦理委员会批准(批号为20220018)。
2 方法
2.1 造模、分组与给药
取SD 雌性大鼠,灌胃己烯雌酚(2 mg/kg)1 次使其发情[8],然后与SD 雄性大鼠以2∶1 的比例合笼过夜,次日清晨检查选出成功受孕的雌鼠(成功受孕特征为雌鼠阴道中有阴栓),此时记为妊娠第1天。取成功受孕的雌鼠50只,采用随机数字表法将其分为对照组、模型组、当归多糖组、LY294002组和当归多糖+ LY294002组,每组10只。于妊娠第1天开始给药处理:对照组和模型组大鼠均灌胃10 mL/kg 生理盐水+腹腔注射10 mL/kg 生理盐水,当归多糖组大鼠灌胃200 mg/kg 当归多糖[7]+腹腔注射10 mL/kg生理盐水,LY294002组大鼠灌胃10 mL/kg生理盐水+腹腔注射5 mg/kg LY294002[9],当归多糖+LY294002 组大鼠灌胃200 mg/kg 当归多糖+腹腔注射5 mg/kg LY294002;每天给药1 次,连续给药7 d。于妊娠第8天,模型组和各给药组大鼠参照文献[8]制备先兆流产大鼠模型,即上午8:00灌胃8.3 mg/kg米非司酮,并于下午6:00灌胃100 μg/kg米索前列醇诱发先兆流产。对照组大鼠以同样步骤灌胃等量生理盐水。然后于妊娠第9天,各组大鼠继续按照上述给药方法给药4 d。
2.2 样本收集及处理
于妊娠第13天,通过吸入乙醚麻醉各组大鼠后自腹主动脉采集血液,离心后分组采集血清保存在—80 ℃冰箱中备用;再次采集适量腹主动脉血,按PBMC 分离试剂盒说明书方法操作分离出其中PBMC,以含有10%胎牛血清的RPMI-1640培养基培养备用;称定大鼠体重后断头处死,开腹摘取子宫及卵巢备用。
2.3 大鼠血清中激素和Th1、Th2型细胞因子水平测定
取“2.2”项下大鼠血清于冰水浴中解冻后,按照ELISA 试剂盒方法检测血清中雌激素、孕激素、IFN-γ、TNF-α、IL-4水平。
2.4 大鼠子宫卵巢指数及胚胎死亡率测定
取“2.2”项下各组大鼠的子宫及卵巢,使用小剪刀剪开子宫后观察胚胎生长情况并计数,正常发育胚胎呈淡红色且个体较大,胎鼠轮廓清晰且胎膜完整;死亡胚胎个体小并呈“竹节状”,胎膜结构不完整或不存在,胚胎呈黑褐色并有消失迹象或已经消失。按下述公式计算各组孕鼠胚胎死亡率:胚胎死亡率=死亡胚胎数/(正常胚胎数+死亡胚胎数)×100%。取出胚胎后,剥离宫腔及卵巢的脂肪组织,称定子宫和卵巢质量,按下述公式计算各组孕鼠子宫卵巢指数:子宫卵巢指数(mg/g)=[子宫质量+卵巢质量(mg)]/体重(g)。
2.5 大鼠子宫组织形态观察
剪下“2.2”项下各组大鼠的一部分子宫组织,包埋后于液氮内速冻,修剪为小方块后置于冰冻切片机内进行连续切片,得到厚约5 µm的切片进行复温;以预冷丙酮固定10 min,再进行HE染色,经洗涤、封片后,采用光学显微镜观察并任选6个视野采集图像。
2.6 大鼠外周血中Th1、Th2细胞比例及两者比值测定
取“2.2”项下各组大鼠的PBMC 并计数,每组取约2×106个PBMC,以FITC 标记的抗大鼠CD4 抗体孵育,洗涤后以固定/透化稀释液和透化缓冲液孵育;依次孵育APC 标记的抗大鼠IFN-γ 抗体和PE 标记的抗大鼠IL-4抗体,再次洗涤后用流式细胞仪检测其中Th1、Th2细胞的比例并计算Th1/Th2比值。
2.7 大鼠子宫组织中PI3K/AKT 信号通路相关蛋白表达测定
取“2.2”项下各组大鼠的子宫组织,提取其总蛋白并于沸水浴中加热变性,对总蛋白进行定量分析。取20µg 总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(在120 V 恒压下电泳80 min),然后在40 mA 稳定电流下湿转90 min至聚偏二氟乙烯(PVDF)膜上,以3%牛血清白蛋白封闭2 h;依次加入兔源抗大鼠p-PI3K、PI3K、p-AKT、AKT、GAPDH 一抗(稀释比例均为1∶2 000),4 ℃孵育过夜;洗膜后,加入HRP标记的山羊抗兔IgG二抗(稀释比例为1∶1 000),室温孵育2 h。化学发光法显色后采集各组蛋白条带图像,运用Image-pro 6.0图像分析软件分析条带灰度值。以目的蛋白和内参蛋白(GAPDH)条带灰度值的比值表示目的蛋白的相对表达水平,PI3K、AKT的磷酸化水平分别以p-PI3K与PI3K相对表达水平的比值和p-AKT与AKT相对表达水平的比值表示。
2.8 统计学分析
采用SPSS 26.0软件进行统计分析。计量资料采用±s表示,组间比较采用单因素方差分析和SNK-q检验。检验水准α=0.05。
3 结果
3.1 大鼠血清中雌激素与孕激素水平测定结果
与对照组比较,模型组大鼠血清中雌激素、孕激素水平均显著降低(P<0.05)。与模型组比较,当归多糖组大鼠血清中雌激素、孕激素水平均显著升高(P<0.05),而LY294002组大鼠血清中雌激素、孕激素水平均显著降低(P<0.05)。与当归多糖组比较,当归多糖+LY294002 组大鼠血清中雌激素、孕激素水平均显著降低(P<0.05)。结果见表1。
表1 各组大鼠血清中激素和Th1、Th2 型细胞因子水平测定结果(±s,n=10,pg/mL)

表1 各组大鼠血清中激素和Th1、Th2 型细胞因子水平测定结果(±s,n=10,pg/mL)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与当归多糖组比较,P<0.05。
IL-4 19.84±3.59 6.23±1.02a 17.52±3.14b 2.20±0.43b 7.49±1.15c组别对照组模型组当归多糖组LY294002组当归多糖+LY294002组雌激素1.28±0.14 0.59±0.07a 1.23±0.16b 0.29±0.05b 0.63±0.08c孕激素154.81±32.40 83.25±11.73a 146.34±30.12b 27.96±5.50b 91.12±12.06c IFN-γ 2.64±0.35 5.87±0.63a 2.95±0.40b 7.74±0.75b 5.53±0.58c TNF-α 23.79±4.10 64.82±8.25a 29.35±4.33b 86.43±9.41b 56.10±7.94c
3.2 大鼠血清中Th1、Th2型细胞因子水平测定结果
与对照组比较,模型组大鼠血清中IFN-γ、TNF-α水平均显著升高(P<0.05),IL-4水平显著降低(P<0.05)。与模型组比较,当归多糖组大鼠血清中IFN-γ、TNF-α水平均显著降低(P<0.05),IL-4水平显著升高(P<0.05);而LY294002组大鼠血清中IFN-γ、TNF-α水平均显著升高(P<0.05),IL-4 水平显著降低(P<0.05)。与当归多糖组比较,当归多糖+LY294002 组大鼠血清中IFN-γ、TNF-α 水平均显著升高(P<0.05),IL-4 水平显著降低(P<0.05)。结果见表1。
3.3 大鼠子宫卵巢指数及胚胎死亡率测定结果
与对照组比较,模型组大鼠子宫卵巢指数显著降低(P<0.05),胚胎死亡率显著升高(P<0.05)。与模型组比较,当归多糖组大鼠子宫卵巢指数显著升高(P<0.05),胚胎死亡率显著降低(P<0.05);而LY294002 组大鼠子宫卵巢指数显著降低(P<0.05),胚胎死亡率显著升高(P<0.05)。与当归多糖组比较,当归多糖+LY294002 组大鼠子宫卵巢指数显著降低(P<0.05),胚胎死亡率显著升高(P<0.05)。结果见表2。
表2 各组大鼠子宫卵巢指数及胚胎死亡率测定结果(±s,n=10)

表2 各组大鼠子宫卵巢指数及胚胎死亡率测定结果(±s,n=10)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与当归多糖组比较,P<0.05。
胚胎死亡率/%3.35±0.82 71.54±9.36a 9.42±1.75b 94.62±12.31b 68.95±10.11c组别对照组模型组当归多糖组LY294002组当归多糖+LY294002组子宫卵巢指数/(mg/g)11.42±2.46 2.28±0.43a 10.03±2.21b 1.37±0.10b 2.65±0.39c
3.4 大鼠子宫组织形态观察结果
对照组大鼠子宫内膜形态正常,细胞结构规则且排列紧密;模型组大鼠子宫内膜变薄且结构不完整,细胞排列疏松,间质内有炎症细胞浸润,产生病理损伤;当归多糖组大鼠子宫组织病理损伤相比模型组减轻,LY294002 组大鼠子宫组织病理损伤相比模型组加重;当归多糖+LY294002 组大鼠子宫组织病理损伤相比当归多糖组加重。结果见图1。

图1 各组大鼠子宫组织形态观察显微图(HE染色)
3.5 大鼠外周血中Th1、Th2细胞比例及两者比值测定结果
与对照组比较,模型组大鼠外周血中Th2细胞比例显著降低(P<0.05),Th1细胞比例、Th1/Th2比值均显著升高(P<0.05)。与模型组比较,当归多糖组大鼠外周血中Th2 细胞比例显著升高(P<0.05),Th1 细胞比例、Th1/Th2 比值均显著降低(P<0.05);而LY294002 组大鼠外周血中Th2细胞比例显著降低(P<0.05),Th1细胞比例、Th1/Th2比值均显著升高(P<0.05)。与当归多糖组比较,当归多糖+LY294002 组大鼠外周血中Th2 细胞比例显著降低(P<0.05),Th1细胞比例、Th1/Th2比值均显著升高(P<0.05)。结果见图2、表3。

图2 各组大鼠外周血中Th1、Th2 细胞比例检测的流式细胞图
表3 各组大鼠外周血中Th1、Th2 细胞比例及两者比值测定结果(±s,n=10)

表3 各组大鼠外周血中Th1、Th2 细胞比例及两者比值测定结果(±s,n=10)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与当归多糖组比较,P<0.05。
组别对照组模型组当归多糖组LY294002组当归多糖+LY294002组Th1细胞比例/%1.87±0.40 6.23±0.85a 2.04±0.51b 10.12±0.96b 5.86±0.72c Th2细胞比例/%5.42±0.76 1.14±0.23a 5.03±0.83b 0.60±0.08b 1.37±0.22c Th1/Th2比值0.35±0.05 5.46±0.94a 0.41±0.08b 16.87±1.85b 4.28±0.72c
3.6 大鼠子宫组织中PI3K、AKT磷酸化水平测定结果
与对照组比较,模型组大鼠子宫组织中p-PI3K/PI3K、p-AKT/AKT 比值均显著降低(P<0.05)。与模型组比较,当归多糖组大鼠子宫组织中p-PI3K/PI3K、p-AKT/AKT 比值均显著升高(P<0.05),而LY294002 组大鼠子宫组织中p-PI3K/PI3K、p-AKT/AKT 比值均显著降低(P<0.05)。与当归多糖组比较,当归多糖+LY294002组大鼠子宫组织中p-PI3K/PI3K、p-AKT/AKT 比值均显著降低(P<0.05)。结果见图3、表4。

图3 各组大鼠子宫组织中PI3K/AKT信号通路相关蛋白表达电泳图
表4 各组大鼠子宫组织中PI3K、AKT 磷酸化水平测定结果(±s,n=10)
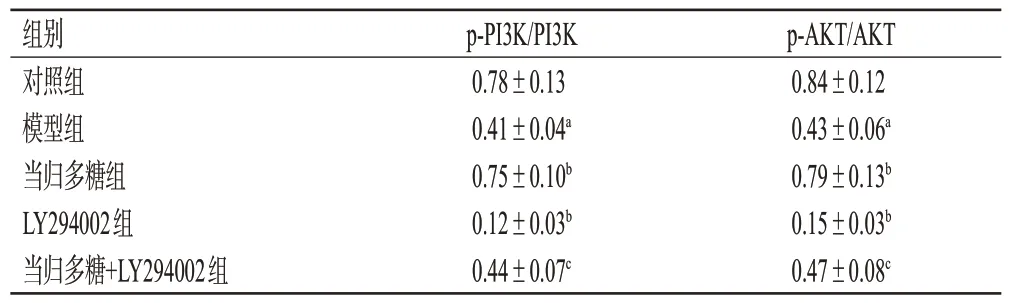
表4 各组大鼠子宫组织中PI3K、AKT 磷酸化水平测定结果(±s,n=10)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与当归多糖组比较,P<0.05。
组别对照组模型组当归多糖组LY294002组当归多糖+LY294002组p-PI3K/PI3K 0.78±0.13 0.41±0.04a 0.75±0.10b 0.12±0.03b 0.44±0.07c p-AKT/AKT 0.84±0.12 0.43±0.06a 0.79±0.13b 0.15±0.03b 0.47±0.08c
4 讨论
目前,临床对先兆流产的治疗以服用孕激素、注射黄体酮等方法为主,但长期采用上述方法治疗存在局限性并有一定副作用,因此寻找更安全有效的防治流产的方法具有重要临床意义[1—2]。Th1/Th2 的动态平衡在妊娠过程中起到重要作用。Th1/Th2型细胞应答出现生理性失衡,会导致Th1细胞分泌的促炎因子IFN-γ、TNF-α等增加及Th2 细胞分泌的抑炎因子IL-4、IL-10 等减少,进而引发免疫炎症,这是造成先兆流产的主要病理基础。相关研究发现,通过增强妊娠期妇女Th1/Th2 的动态平衡向Th2偏移可促使胚胎正常发育生长,降低流产的发生概率[10—11]。本研究通过灌胃米非司酮和米索前列醇建立先兆流产大鼠模型,结果显示,造模大鼠雌激素与孕激素分泌异常降低,Th1/Th2 免疫失衡且偏向Th1,促使Th1 型细胞因子表达并减轻Th2 型细胞因子表达,诱发免疫炎症,造成子宫及卵巢形态受损,引发胚胎死亡,最终导致先兆流产,这提示模型构建成功。
先兆流产在中医中属于“胎动不安”“胎漏”“滑胎”,治疗以扶脾固肾、养血益气为主[8]。当归作为常用中药材具有补肾益精、补血益气的功效,可调节子宫局部免疫细胞分化及其分泌的与妊娠相关的细胞因子表达,进而降低诱导性流产模型小鼠胚胎死亡率[12]。当归多糖作为当归的主要活性成分之一,可通过促进微血管形成而增加子痫前期模型大鼠胎盘血流灌注,促使其胎鼠存活,最终改善其不良妊娠结局[13]。本研究以当归多糖干预先兆流产模型大鼠后,可减轻其子宫组织病理损伤,促使其雌激素、孕激素分泌,升高其血清中IL-4水平、子宫卵巢指数、Th2 细胞比例,并降低其胚胎死亡率、Th1细胞比例、Th1/Th2比值和血清中IFN-γ、TNF-α水平,表明当归多糖可调控Th1/Th2免疫平衡并纠正其偏向Th1的失衡状态,减轻免疫炎症及子宫损伤,促使胚胎存活,最终改善大鼠先兆流产症状。该结果提示,当归多糖在先兆流产的临床治疗中具有广阔应用前景。
PI3K/AKT 信号通路可通过调控免疫、激素分泌及细胞存活等介导妊娠过程,并与先兆流产的发生及治疗相关[3],增强PI3K/AKT信号通路活性可促进血管内皮生长因子表达及子宫变厚,进而改善控制性超促排卵大鼠的子宫内膜容受性并促进胚胎植入[14]。Yang 等[15]研究发现,PI3K/AKT信号通路参与介导了菟丝子-茯苓药对治疗先兆流产的过程;且胡燕等[7]研究表明,当归多糖可激活PI3K/AKT 信号通路,进而改善复发性流产模型大鼠激素水平和凝血指标并降低其流产率。因而笔者预测,当归多糖改善先兆流产模型大鼠Th1/Th2 平衡发挥保胎作用的药理机制可能是激活了PI3K/AKT 信号通路。本研究结果显示,先兆流产模型大鼠子宫组织中p-PI3K/PI3K、p-AKT/AKT 比值相比对照组大鼠降低,即PI3K、AKT 的磷酸化水平降低,以当归多糖处理后可逆转其变化趋势;而以该通路抑制剂LY294002 干预先兆流产模型大鼠,可加重免疫炎症及子宫损伤,进一步损害胚胎发育并升高其死亡率,使大鼠先兆流产病情加重。这表明PI3K/AKT信号通路参与了先兆流产的发生过程,并介导了当归多糖对先兆流产模型大鼠的保胎作用及Th1/Th2 平衡的改善过程。本研究以当归多糖和LY294002 联合处理先兆流产模型大鼠,可减弱当归多糖单独处理对大鼠Th1/Th2免疫平衡偏向Th2的促进作用,消除其对免疫炎症及子宫损伤的减轻作用,最终逆转其对大鼠先兆流产症状的改善作用。这进一步证实了当归多糖改善先兆流产模型大鼠Th1/Th2平衡并对其发挥保胎作用是通过激活PI3K/AKT信号通路实现的。
综上所述,当归多糖可通过激活PI3K/AKT 信号通路,进而调控Th1/Th2平衡并促使其偏向Th2,抑制免疫炎症的发生及进展,减轻子宫损伤并促使胚胎存活,从而发挥对先兆流产模型大鼠的保胎作用。

