2型糖尿病相关射血分数保留的心力衰竭患者心脏结构功能特点:基于倾向性评分匹配的分析
彭可玲 刘永铭 贾晓艳 王华 苟春丽 薛丽丽 邹全 张文珺
摘要:目的 研究2型糖尿病(T2DM)相關射血分数保留的心力衰竭(HFpEF)患者心脏结构功能的特点,并分析其影响因素。方法 连续入选2009年4月至2020年12月兰州大学第一医院老年心血管科收住的新诊断HFpEF患者783例,应用超声心动图和组织多普勒技术系统评价心脏结构功能,根据是否合并T2DM将其分为HFpEF+T2DM组(n=332)和HFpEF组(n=451),采用倾向性评分匹配方法进行1∶1匹配,HFpEF+T2DM组、HFpEF组各成功匹配264例;根据尿白蛋白排泄率(UAER),将配对后的HFpEF+T2DM组进一步分为尿蛋白正常组(UAER<20 μg/min)、微量蛋白尿组(UAER 20~200 μg/min)和大量蛋白尿组(UAER>200 μg/min)3个亚组。比较不同组间合并症、病情严重程度以及心脏结构功能的差异,采用多元线性回归分析血压、血糖、糖化血红蛋白、UAER等指标与心脏结构功能损害的关系。结果 HFpEF+T2DM组高血压(P=0.001)、冠心病(P=0.036)患病率高于HFpEF组,体重指数(P=0.005)大于而年龄(P=0.020)小于HFpEF组,糖尿病病程10(3,17)年。采用倾向性评分匹配后两组年龄和合并症比例接近,差异无统计学意义(P均>0.05);HFpEF+T2DM组室间隔厚度(P=0.015)、左心室后壁厚度(P=0.040)、左心室质量(P=0.012)均大于HFpEF组,舒张早期二尖瓣环室间隔部(P=0.030)及侧壁部(P=0.011)运动速度小于HFpEF组,二尖瓣早期充盈速度与二尖瓣环舒张早期速度比值大于HFpEF组(P=0.036);糖化血红蛋白与左心室质量独立相关(P=0.011),尿白蛋白排泄率自然对数值与反映心脏结构功能的室间隔厚度(P=0.004)、左心室后壁厚度(P=0.006)、左心室质量(P<0.001)、二尖瓣舒张早期最大充盈速度与二尖瓣舒张早期最大速度比值(P=0.049)独立相关。结论 T2DM相关HFpEF患者左心室室壁更厚,左心室质量更大,向心性重塑更明显,左心室舒张功能减退及充盈压升高更严重,上述改变可能与高血糖及糖尿病微血管病变有关。
关键词:射血分数保留的心力衰竭;2型糖尿病;倾向性评分匹配;心脏结构功能;尿白蛋白排泄率
中图分类号: R541.6文献标志码: A文章编号:1000-503X(2023)02-0264-09
DOI:10.3881/j.issn.1000-503X.15275
Cardiac Structural and Functional Features in Patients With Type 2 Diabetes Mellitus and Heart Failure With Preserved Ejection Fraction:A Study Based on Propensity Score Matching
PENG Keling LIU Yongming JIA Xiaoyan WANG Hua GOU Chunli XUE Lili ZOU Quan ZHANG Wenjun3
ABSTRACT:Objective To investigate the cardiac structural and functional characteristics in the patients with heart failure with preserved ejection fraction (HFpEF) and type 2 diabetes mellitus (T2DM),and predict the factors influencing the characteristics.Methods A total of 783 HFpEF patients diagnosed in the Department of Geriatric Cardiology,the First Hospital of Lanzhou University from April 2009 to December 2020 were enrolled in this study.Echocardiography and tissue Doppler technique were employed to evaluate cardiac structure and function.According to the occurrence of T2DM,the patients were assigned into a HFpEF+T2DM group (n=332) and a HFpEF group (n=451).Propensity score matching (PSM)(in a 1∶1 ratio) was adopted to minimize confounding effect.According to urinary albumin excretion rate (UAER),the HFpEF+T2DM group was further divided into three subgroups with UAER<20 μg/min,of 20-200 μg/min,and>200 μg/min,respectively.The comorbidities,symptoms and signs,and cardiac structure and function were compared among the groups to clarify the features of diabetes related HFpEF.Multivariate linear regression was conducted to probe the relationship of systolic blood pressure,blood glucose,glycosylated hemoglobin,and UARE with cardiac structural and functional impairment.Results The HFpEF+T2DM group had higher prevalence of hypertension (P=0.001) and coronary heart disease (P=0.036),younger age (P=0.020),and larger body mass index (P=0.005) than the HFpEF group,with the median diabetic course of 10 (3,17) years.After PSM,the prevalence of hypertension and coronary heart disease,body mass index,and age had no significant differences between the two groups(all P>0.05).In addition,the HFpEF+T2DM group had higher interventricular septal thickness (P=0.015),left ventricular posterior wall thickness (P=0.040),and left ventricular mass (P=0.012) and lower early diastole velocity of mitral annular septum (P=0.030) and lateral wall (P=0.011) than the HFpEF group.Compared with the HFpEF group,the HFpEF+T2DM group showed increased ratio of early diastolic mitral filling velocity to early diastolic mitral annular velocity (E/e) (P=0.036).Glycosylated hemoglobin was correlated with left ventricular mass (P=0.011),and the natural logarithm of UAER with interventricular septal thickness (P=0.004),left ventricular posterior wall thickness (P=0.006),left ventricular mass (P<0.001),and E/e ratio (P=0.049).Conclusion The patients with both T2DM and HFpEF have thicker left ventricular wall,larger left ventricular mass,more advanced left ventricular remodeling,severer impaired left ventricular diastolic function,and higher left ventricular filling pressure than the HFpEF patients without T2DM.Elevated blood glucose and diabetic microvascular diseases might play a role in the development of the detrimental structural and functional changes of the heart.
Key words:heart failure with preserved ejection fraction;type 2 diabetes mellitus;propensity score matching;cardiac structure and function;urinary albumin excretion rate
Acta Acad Med Sin,2023,45(2):264-272
随着人口老龄化和人类疾病谱的改变,射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)的患病率迅速增加,虽然过去数10年心力衰竭研究取得了巨大进展,但现有的治疗并未改变HFpEF的预后,究其原因可能与HFpEF的病因及病理生理机制的高度异质性有关。2型糖尿病(type 2 diabetes mellitus,T2DM)是HFpEF的重要危险因素之一,在心力衰竭中占30%~40%,流行病学研究显示T2DM相关的HFpEF患者全因死亡率及心血管死亡率进一步增高,但T2DM与HFpEF相互影响的许多问题尚未阐明,其中心脏结构功能损害特征及其病理生理机制仍然是研究焦点。然而,由于T2DM众多合并症如高血压、肥胖等的影响,容易导致研究结果的偏倚和不确定性。为此,本研究纳入大样本的HFpEF患者,采用倾向性评分匹配(propensity score matching,PSM)有效降低混杂因素的干扰,以期进一步认识HFpEF合并T2DM的心脏结构功能损害特点。
对象和方法
对象 连续入选2009年4月至2020年12月兰州大学第一医院老年心血管科收住的HFpEF患者共1011例。纳入标准:(1)符合2007年欧洲心脏病学会提出的HFpEF诊断标准[1];(2)入院时纽约心脏学会心功能分级Ⅱ~Ⅳ级;(3)同一患者反复住院以首次病例资料为准。排除先天性心脏病、瓣膜性心脏病、肺源性心脏病或心肌病、免疫系统及血液系统疾病等引起的心力衰竭,入院时伴有严重创伤、感染者、合并1型糖尿病、有严重精神疾病患者、无完整的心脏结构功能资料者等共228例,最终纳入783例。根据是否合并T2DM,分为HFpEF+T2DM组(n=332)和HFpEF组(n=451)。经PSM 1∶1匹配后,HFpEF+T2DM组和HFpEF组每组各264例。根据尿白蛋白排泄率(urinary albumin excretion rate,UAER)进一步将匹配后的HFpEF+T2DM组分为尿蛋白正常组(UAER<20 μg/min)、微量蛋白尿组(UAER 20~200 μg/min)和大量蛋白尿组(UAER>200 μg/min)。本研究经兰州大学第一医院伦理委员会批准(伦理审查编号:LDYYLL2019-34),所有患者均签署知情同意书。
资料收集 详细记录患者病史并行体格检查和血液常规、生化检查及糖化血红蛋白(glycosylated hemoglobin,HbA1c)、UAER及N末端B型利钠肽原(N-terminal pro-B-type natriuretic peptide,NT-proBNP)等的测定。HbA1c测定使用免疫乳胶凝集抑制法,尿微量白蛋白测定使用免疫比浊法,根据8 h尿量计算UAER,NT-proBNP测定使用电化学发光法,试剂购自瑞士Roche公司。
超声心动图检查 采用美国PHILIPS-IE33超声诊断仪进行检查,固定2名经严格培训的超声医学专业医师操作,每个指标测定3~5个连续心动周期,取平均值。根据有关指南[2-3]选择心脏结构功能指标,具体方法同文献[4]。(1)左心结构主要参数:收缩末期及舒张末期左心室内径、收缩末期室间隔厚度、舒张末期室间隔厚度(interventricular septal thickness at end-diastolic,IVSTd)、收缩末期左室后壁厚度、舒张末期左室后壁厚度(left ventricular posterior wall thickness at end-diastolic,PWTd)、相對室壁厚度(relative wall thickness,RWT)(RWT=2×PWTd/舒张末期左室内径)、左心室质量(left ventricular mass,LVM)及其指数(left ventricular mass index,LVMi)、左心室收缩及舒张末期容积、左心室射血分数、左心房容积及其指数。有关指标的指数均由相应指标体表面积计算,体表面积以Stevenson方法计算。(2)左心功能主要参数:舒张早期和晚期最大充盈速度(E峰、A峰),计算E峰与A峰的比值(E/A),E峰减速时间;测量等容舒张时间,二尖瓣环侧壁和室间隔部收缩期、舒张早期二尖瓣环侧壁最大速度(peak early diastole lateral mitral annual velocity,eL)、舒张早期二尖瓣环室间隔部最大速度(maximum velocity of the septum of the mitral compartment in early diastole,eS),并计算E/eL、E/eS以及E峰与eL和eS均值的比值(E/e)。
统计学处理 采用SPSS 25.0软件进行数据分析。PSM过程利用SPSS的PSM扩展程序实现。以是否合并T2DM为应变量,以性别、年龄、腰臀比、体重指数及合并症等为匹配变量,通过Logistic回归分析估计倾向性评分值,采用1∶1进行匹配,匹配容差设置为0.02。计量资料以均数±标准差(正态分布)或M(P25,P75)(非正态分布)表示。两组间均数比较采用独立样本t检验,非正态分布资料比较用Mann-Whitney U检验。多组间均数比较采用方差分析,两两比较采用LSD法(方差齐时)或Dunnett T3法(方差不齐时),非正态分布资料比较用Kruska-Wallis检验。计数资料采用例、率或百分比表示,组间比较采用卡方检验。因素间关系采用多元线性回归分析。P<0.05为差异有统计学意义。
结果
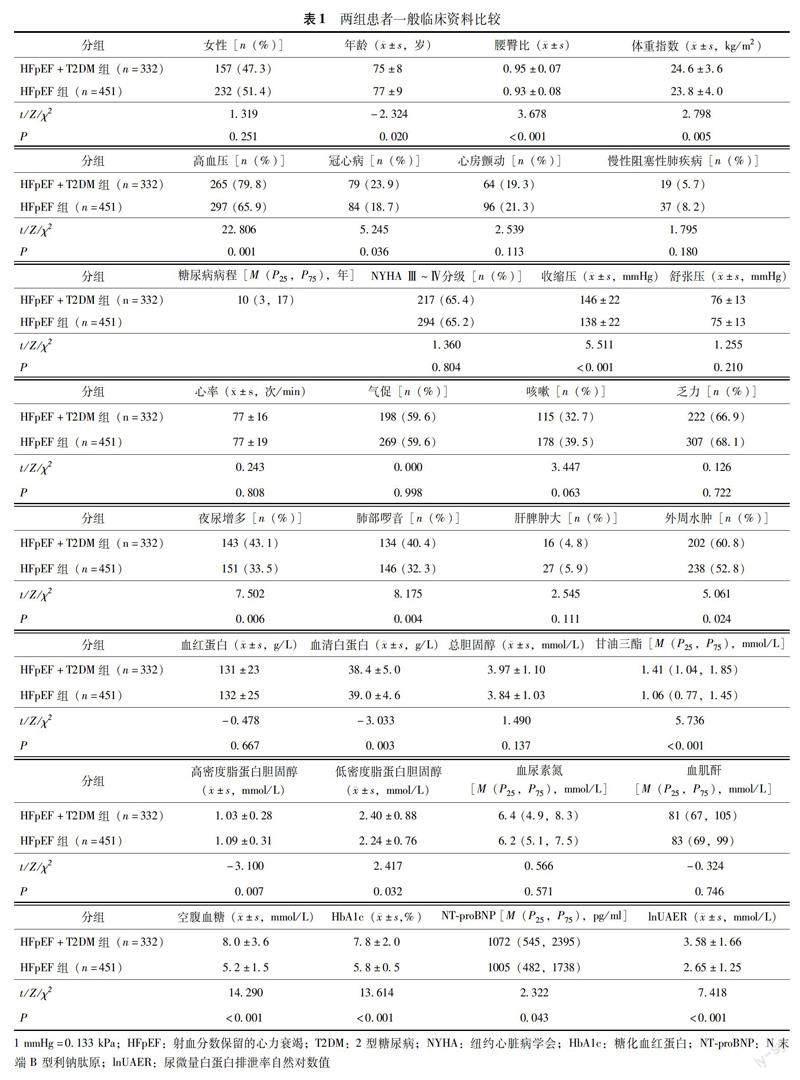
一般资料 纳入的783例HFpEF患者中,332例 (42.4%) 有T2DM病史,病程中位數为10(3,17)年。 HFpEF+T2DM组腰臀比(P<0.001)、体重指数(P=0.005)和收缩压(P<0.001)更高,年龄(P=0.020)较小,水钠潴留症状肺部啰音(P=0.004)、外周水肿(P=0.024)更明显,高血压(P=0.001)及冠心病(P=0.036)合并症比例更高。此外,HFpEF+T2DM组甘油三酯(P<0.001)、低密度脂蛋白胆固醇(P=0.032)、空腹血糖(P<0.001)、HbA1c(P<0.001)、尿微量白蛋白排泄率自然对数值(natural logarithm of urinary microalbumin excretion rate,lnUAER)(P<0.001)及NT-proBNP(P=0.043)均高于HFpEF组,而血清白蛋白(P=0.003)、高密度脂蛋白胆固醇(P=0.007)均低于HFpEF组(表1)。
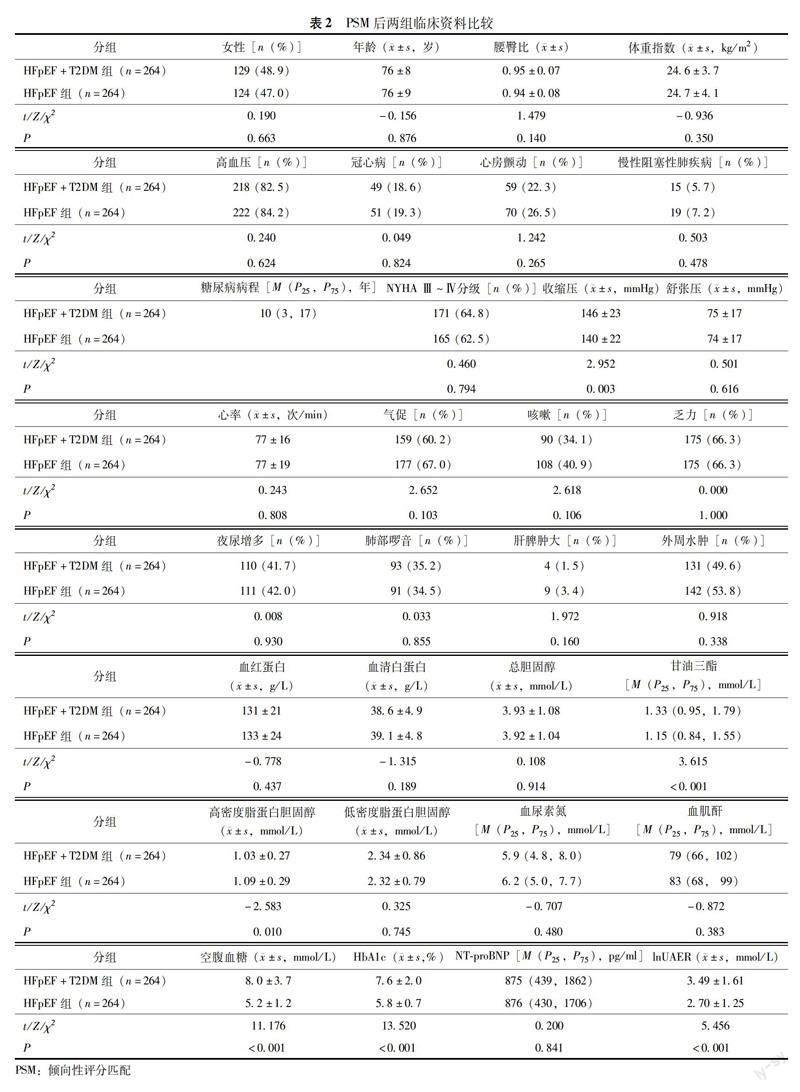
匹配后特征 以HFpEF+T2DM为基准组进行1∶1匹配,两组共264对匹配成功。匹配后年龄、腰臀比、体重指数、高血压和冠心病患病率两组比较差异均无统计学意义(表2)。
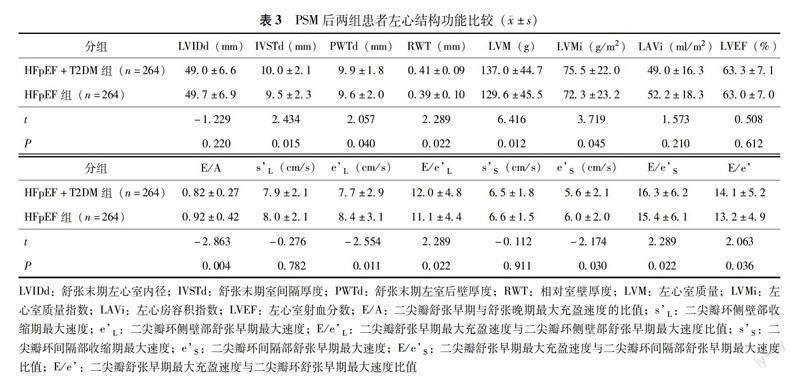
PSM后两组患者心脏结构功能 HFpEF+T2DM组反映左心室大小的参数IVSTd(P=0.015)、PWTd(P=1 mmHg=0.133 kPa;HFpEF:射血分数保留的心力衰竭;T2DM:2型糖尿病;NYHA:纽约心脏病学会;HbA1c:糖化血红蛋白;NT-proBNP:N末端 B 型利钠肽原;lnUAER:尿微量白蛋白排泄率自然对数值0.040)、RWT(P=0.022)、LVM(P=0.012)、LVMi(P=0.045)均大于HFpEF组,舒张功能指标eL(P=0.011)、eS(P=0.030)均小于HFpEF组,反映左心室充盈压的参数E/eL(P=0.022) 、E/eS(P=0.022)、E/e(P=0.036)均大于HFpEF组,反映收缩功能的指标LVEF、sS和sL两组比较差异均无统计学意义(P均>0.05)(表3)。
PSM后HFpEF+T2DM组亚组间心脏结构功能 方差分析显示,以UAER划分的3个亚组间多个心脏结构功能参数差异有统计学意义。其中,反映左心室大小的参数PWTd(P=0.041)、LVM(P=0.044)、LVMi(P=0.032)及左心室充盈压的参数E/eL(P<0.001) 、E/eS (P<0.001)、E/e(P<0.001)大量蛋白尿亚组均大于尿蛋白正常亚组和微量蛋白尿亚组;而舒张功能指标eL(P=0.001)、eS(P=0.011)大量蛋白尿亚组均小于尿蛋白正常亚组和微量蛋白尿亚组(表4)。
心脏结构功能改变的影响因素 以PSM筛选的264例HFpEF合并T2DM患者心脏结构功能指标为因变量,以收缩压、空腹血糖、HbA1c、lnUAER、高密度脂蛋白胆固醇等为自变量做多元线性回归,结果显示HbA1c与LVM(P=0.007)、LVMi(P=0.011)独立相关,lnUAER与IVSTd(P=0.004)、PWTd(P=0.006)、LVM(P<0.001)、LVMi(P<0.001)、eL(P=0.021)、E/eL(P=0.042)、E/eS(P=0.042)、E/e(P=0.049)独立相关(表5)。
LVIDd:舒张末期左心室内径;IVSTd:舒张末期室间隔厚度;PWTd:舒张末期左室后壁厚度;RWT:相对室壁厚度;LVM:左心室质量;LVMi:左心室质量指数;LAVi:左心房容积指数;LVEF:左心室射血分数;E/A:二尖瓣舒张早期与舒张晚期最大充盈速度的比值;sL:二尖瓣环侧壁部收缩期最大速度;eL:二尖瓣环侧壁部舒张早期最大速度;E/eL:二尖瓣舒张早期最大充盈速度与二尖瓣环侧壁部舒张早期最大速度比值;sS:二尖瓣环间隔部收缩期最大速度;eS:二尖瓣环间隔部舒张早期最大速度;E/eS:二尖瓣舒张早期最大充盈速度与二尖瓣环间隔部舒张早期最大速度比值;E/e:二尖瓣舒张早期最大充盈速度与二尖瓣环舒张早期最大速度比值
讨论
本研究在纳入大样本HFpEF患者的基础上,使用PSM方法平衡了年龄、性别、高血压及冠心病分布,减少了混杂因素对结果的干扰。本研究除采用超声心动图的传统指标外,还使用组织多普勒技术观察室间隔和左心室侧壁组织运动速度,多指标多方位综合反映心脏结构和功能,能更加客观准确地显示T2DM相关HFpEF的特点。结果显示HFpEF合并T2DM组左心室向心性肥厚更加显著,左心室舒张功能减退更加严重,而HbA1c、UAER水平与上述改变独立相关。
本研究HFpEF中T2DM占42.4%,合并T2DM的HFpEF患者体重指数更大、高血压及冠心病患病率更高,而年龄却小于不合并T2DM的HFpEF,与国外大规模临床研究结果[5-7]一致。本研究合并T2DM的HFpEF患者外周水肿及肺部啰音更多,提示水钠潴留更加严重。另外,本研究HFpEF患者均为新诊断者,心力衰竭病史短而糖尿病病程长(中位数为10年),符合T2DM致心脏慢性损害的因果关系。
经过PSM均衡匹配后,T2DM相关HFpEF组与HFpEF组比较,年龄、性别、体重指数、高血压患病率、合并房颤及冠心病的比例相似。在心脏结构方面,T2DM相关HFpEF组左心室壁更厚,左心室质量更高,向心性重塑更严重;功能方面,T2DM相关HFpEF组二尖瓣环室间隔部和侧壁部舒张速度均小于非糖尿病HFpEF组,表明舒张功能损害更加严重,但两组间二尖瓣环收缩速度差异无统计学意义,提示收缩功能无差异,与Lejeune等[8]及Paiman等[9]的研究一致,但这方面的研究还比较少。在有效控制多种危险因素的情况下,T2DM相关HFpEF结构功能损害更加严重,反映了其特殊性。但在心脏结构方面,目前仍有争论。Paiman等[9]使用心脏磁共振成像影像技术发现,亚洲人群T2DM相关HFpEF左心室重塑和肥厚更加严重,但在欧洲人群两组之间差异无统计学意义,提示糖尿病相关HFpEF心脏损害存在种族差异,需要更加深入细致的研究。
在无并发症的T2DM患者,左心室向心性重塑和亚临床心脏舒张功能下降较为普遍[10-11],上述改变甚至在糖尿病早期就存在。T2DM心臟组织形态表现为心肌细胞肥大和纤维化,是导致舒张功能下降的基础。本研究显示糖化血红蛋白与左心室质量独立相关,基础研究已证实高血糖本身可导致心肌损伤[12]。除血糖外,脂毒性、胰岛素抵抗、肥胖、高血压等也是糖尿病心肌损伤的重要原因[13]。内皮损伤、氧化应激、炎症反应、胰岛素信号传导异常[14]、脂肪酸代谢异常[15]和心肌细胞能量代谢异常[16]是主要发病机制。本研究显示随着UAER的上升心脏结构功能损害加重。事实上,心脏结构功能损害与尿微量白蛋白的相关性在无心力衰竭的T2DM中就存在[17-18]。UAER上升不但是糖尿病肾病的特征表现,也是全身系统性微血管病变的标志,而冠状动脉微血管病变是HFpEF的致病因素之一[19],因此,微血管病变既是T2DM相关HFpEF心功能损害的重要原因,也是其特征之一。
与无糖尿病的心力衰竭相比,糖尿病相关HFpEF及射血分数减低心力衰竭的全因死亡率及心血管死亡率进一步增高[20-21]。本研究显示T2DM相关HFpEF患者E/e更高,而E/e升高可预测HFpEF患者心血管事件,因此,可以推测更严重的心功能损害是T2DM相关HFpEF不良预后的原因之一。此外,糖尿病肾病、更严重的水钠潴留、糖尿病大小血管病变、免疫功能失调[22]也是导致HFpEF不良预后的可能因素。
本研究存在一定的局限性。首先,本研究为单中心研究,可能存在选择性偏倚;其次,本研究为横断面研究,虽然观察到HbA1c及UAER与T2DM相关HFpEF的心脏结构功能之间的相关性,但不能说明因果关系。T2DM相关HFpEF的心脏结构功能损害更加严重的临床意义,尚需要在前瞻性研究中证实。
参 考 文 献
[1]Paulus WJ,Tschpe C,Sanderson JE,et al.How to diagnose diastolic heart failure:a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology[J].Eur Heart J,2007,28(20):2539-2550.DOI:10.1093/eurheartj/ehm037.
[2]Lang RM,Bierig M,Devereux RB,et al.Recommendations for chamber quantification:a report from the American Society of Echocardiographys Guidelines and Standards Committee and the Chamber Quantification Writing Group,developed in conjunction with the European Association of Echocardiography,a branch of the European Society of Cardiology[J].J Am Soc Echocardiogr,2005,18(12):1440-1463.DOI:10.1016/j.echo.2005.10.005.
[3]Nagueh SF,Appleton CP,Gillebert TC,et al.Recommendations for the evaluation of left ventricular diastolic function by echocardiography[J].Eur J Echocardiogr,2009,10(2):165-193.DOI:10.1093/ejechocard/jep007.
[4]刘永铭,马苏美,杨琳.二尖瓣血流频谱和二尖瓣环舒张速度对射血分数保留的心力衰竭的诊断价值[J].中华心血管病杂志,2016,44(2):150-155.DOI:10.3760/cma.j.issn.0253-3758.2016.02.013.
[5]Lindman BR,Dávila-Román VG,Mann DL,et al.Cardiovascular phenotype in HFpEF patients with or without diabetes:a RELAX trial ancillary study[J].J Am Coll Cardiol,2014,64(6):541-549.DOI:10.1016/j.jacc.2014.05.030.
[6]Aguilar D,Deswal A,Ramasubbu K,et al.Comparison of patients with heart failure and preserved left ventricular ejection fraction among those with versus without diabetes mellitus[J].Am J Cardiol,2010,105(3):373-377.DOI:10.1016/j.amjcard.2009.09.041.
[7]Kristensen SL,Mogensen UM,Jhund PS,et al.Clinical and echocardiographic characteristics and cardiovascular outcomes according to diabetes status in patients with heart failure and preserved ejection fraction:a report from the Ⅰ-preserve trial (irbesartan in heart failure with preserved ejection fraction)[J].Circulation,2017,135(8):724-735.DOI:10.1161/circulationaha.116.024593.
[8]Lejeune S,Roy C,Slimani A,et al.Diabetic phenotype and prognosis of patients with heart failure and preserved ejection fraction in a real life cohort[J].Cardiovasc Diabetol,2021,20(1):48.DOI:10.1186/s12933-021-01242-5.
[9]Paiman EHM,van Eyk HJ,Bizino MB,et al.Phenotyping diabetic cardiomyopathy in Europeans and South Asians[J].Cardiovasc Diabetol,2019,18(1):133.DOI:10.1186/s12933-019-0940-z.
[10]侯亚利,刘永铭,马苏美.2型糖尿病患者心脏功能变化的研究[J].中国糖尿病杂志,2011,19(11):834-837.DOI:10.3969/j.issn.1006-6187.2011.11.011.
[11]Minciun IA,Hilda Oran O,Minciun I,et al.Assessment of subclinical diabetic cardiomyopathy by speckle-tracking imaging[J].Eur J Clin Invest,2021,51(4):e13475.DOI:10.1111/eci.13475.
[12]Cai L,Li W,Wang G,et al.Hyperglycemia-induced apoptosis in mouse myocardium:mitochondrial cytochrome C-mediated caspase-3 activation pathway[J].Diabetes,2002,51(6):1938-1948.DOI:10.2337/diabetes.51.6.1938.
[13]Petrie JR,Guzik TJ,Touyz RM.Diabetes,hypertension,and cardiovascular disease:clinical insights and vascular mechanisms[J].Can J Cardiol,2018,34(5):575-584.DOI:10.1016/j.cjca.2017.12.005.
[14]Zamora M,Villena JA.Contribution of impaired insulin signaling to the pathogenesis of diabetic cardiomyopathy[J].Int J Mol Sci,2019,20(11).DOI:10.3390/ijms20112833.
[15]Ritchie RH,Abel ED.Basic mechanisms of diabetic heart disease[J].Circ Res,2020,126(11):1501-1525.DOI:10.1161/CIRCRESAHA.120.315913.
[16]Bertero E,Maack C.Calcium signaling and reactive oxygen species in mitochondria[J].Circ Res,2018,122(10):1460-1478.DOI:10.1161/circresaha.118.310082.
[17]Nobakhthaghighi N,Kamgar M,Bekheirnia MR,et al.Relationship between urinary albumin excretion and left ventricular mass with mortality in patients with type 2 diabetes[J].Clin J Am Soc Nephrol,2006,1(6):1187-1190.DOI:10.2215/cjn.00750306.
[18]Jrgensen PG,Biering-Srensen T,Mogelvang R,et al.Presence of micro-and macroalbuminuria and the association with cardiac mechanics in patients with type 2 diabetes[J].Eur Heart J Cardiovasc Imaging,2018,19(9):1034-1041.DOI:10.1093/ehjci/jex231.
[19]Shah SJ,Lam CSP,Svedlund S,et al.Prevalence and correlates of coronary microvascular dysfunction in heart failure with preserved ejection fraction:PROMIS-HFpEF[J].Eur Heart J,2018,39(37):3439-3450.DOI:10.1093/eurheartj/ehy531.
[20]Johansson I,Edner M,Dahlstrm U,et al.Is the prognosis in patients with diabetes and heart failure a matter of unsatisfactory management? An observational study from the Swedish Heart Failure Registry[J].Eur J Heart Fail,2014,16(4):409-418.DOI:10.1002/ejhf.44.
[21]Targher G,Dauriz M,Laroche C,et al.In-hospital and 1-year mortality associated with diabetes in patients with acute heart failure:results from the ESC-HFA Heart Failure Long-Term Registry[J].Eur J Heart Fail,2017,19(1):54-65.DOI:10.1002/ejhf.679.
[22]Sava RI,Pepine CJ,March KL.Immune dysregulation in HFpEF:a target for mesenchymal stem/stromal cell therapy[J].J Clin Med,2020,9(1):241.DOI:10.3390/jcm9010241.
(收稿日期:2022-09-05)
基金項目:甘肃省重点研发计划(20YF8FA079)

