肾组织血小板反应蛋白1型结构7A域及神经表皮生长因子样蛋白-1检测在M型磷脂酶A2受体阴性膜性肾病中的临床意义
汤绚丽 杜园园 余瑾 叶田 朱虹 陈银凤 李晓虹
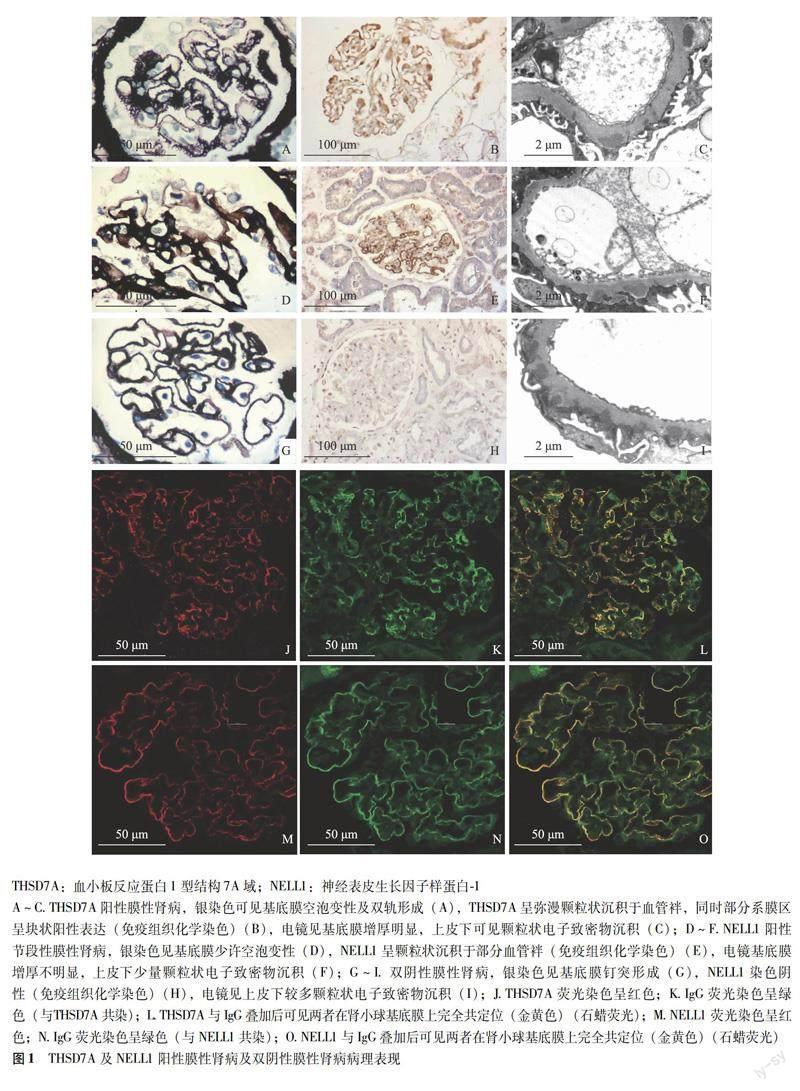
摘要:目的 探討肾组织血小板反应蛋白1型结构7A域(THSD7A)及神经表皮生长因子样蛋白-1 (NELL1)检测在M型磷脂酶A2受体(PLA2R)阴性膜性肾病中的诊断及治疗指导意义。方法 选取浙江中医药大学附属杭州市中医院2014至2021年肾穿刺活检确诊为PLA2R阴性膜性肾病共116例,通过免疫组织化学方法检测肾组织THSD7A及NELL1的阳性表达情况,比较各组间临床病理特征及治疗与预后。结果 116例PLA2R阴性膜性肾病中THSD7A阳性23例,NELL1阳性9例,其中两者双阳性1例。THSD7A阳性较阴性者IgG4阳性率更高(P=0.010);膜性肾病 Ⅰ 期占比更少,Ⅱ 期占比更多(P=0.002);基底膜增厚更明显(P=0.034)。NELL1阳性较阴性者C1q及IgG2的阳性率更低(P=0.029,P=0.001);炎细胞浸润更多(P=0.033);多部位沉积物更少(P=0.001);基底膜增厚更不明显(P<0.001);不典型膜性肾病比例更低(P=0.010)。继发因素分析显示THSD7A阳性者有1例确诊为乙状结肠癌,NELL1阳性者均未发现恶性肿瘤。生存分析提示THSD7A阳性组肾病复合缓解率(完全缓解或部分缓解)显著低于阴性组(P=0.016),而NELL1阳性组肾病复合缓解率显著优于阴性组(P=0.015),两指标单一阳性组间比较显示NELL1单一阳性组肾病复合缓解率显著优于THSD7A单一阳性组(P<0.001)。结论 THSD7A及NELL1阳性膜性肾病更倾向于原发性膜性肾病,且无恶性肿瘤提示价值,但对膜性肾病患者的预后具有一定的预测价值。
关键词:膜性肾病;血小板反应蛋白1型结构7A域;神经表皮生长因子样蛋白-1;M型磷脂酶A2受体
中图分类号: R692.6 文献标志码: A 文章编号:1000-503X(2023)02-0235-10
DOI:10.3881/j.issn.1000-503X.15212
Clinical Significance of Thrombospondin Type 1 Domain-Containing 7A and Neural Epidermal Growth Factor-Like 1 Protein in M-Type Phospholipase A2 Receptor-Negative Membranous Nephropathy
TANG Xuanli,DU Yuanyuan,YU Jin,YE Tian,ZHU Hong,CHEN Yinfeng,LI Xiaohong
ABSTRACT:Objective To investigate the clinical significance of thrombospondin type 1 domain-containing 7A (THSD7A) and neural epidermal growth factor-like 1 protein (NELL1) in phospholipase A2 receptor (PLA2R)-negative membranous nephropathy (MN).Methods A total of 116 PLA2R-negative MN patients treated in Hangzhou TCM Hospital Affiliated to Zhejiang Chinese Medical University from 2014 to 2021 were enrolled in this study.Immunohistochemistry was employed to detect THSD7A and NELL1 in the renal tissue.The pathological characteristics,treatment,and prognosis were compared between positive and negative groups.Results The 116 PLA2R-negative MN patients included 23 THSD7A-positive patients and 9 NELL1-positive patients.One patient was tested positive for both proteins.The THSD7A-positive group showed higher positive rate of IgG4 (P=0.010),more obvious glomerular basement membrane (GBM) thickening (P=0.034),and higher proportion of stage Ⅱ MN and lower proportion of stage I MN (P=0.002) than the THSD7A-negative group.The NELL1-positive group had lower positive rates of C1q and IgG2 (P=0.029,P=0.001),less obvious GBM thickening (P<0.001),more extensive inflammatory cell infiltration (P=0.033),lower proportion of deposits on multi-locations (P=0.001),and lower proportion of atypical MN (P=0.010) than the NELL1-negative group.One patient with THSD7A-positive MN was diagnosed with colon cancer,while none of the NELL1-positive patients had malignancy.Survival analysis suggested that THSD7A-positive MN had worse composite remission (either complete remission or partial remission) of nephrotic syndrome than the negative group (P=0.016),whereas NELL1-positive MN exhibited better composite remission of nephrotic syndrome than the negative group (P=0.015).The MN patients only positive for NELL1 showed better composite remission of nephrotic syndrome than the MN patients only positive for THSD7A (P<0.001).Conclusions THSD7A- and NELL1-positive MN is more likely to be primary MN,and there is no significant malignancy indication.However,it might have a predictive value for the prognosis of MN.
Key words:membranous nephropathy;thrombospondin type 1 domain-containing 7A;neural epidermal growth factor-like 1 protein;M-type phospholipase A2 receptor
Acta Acad Med Sin,2023,45(2):235-244
尽管M型磷脂酶A2受体(phospholipase A2 receptor,PLA2R)是膜性肾病(membranous nephropathy,MN)最重要的靶抗原,仍有30%~40% 膜性肾病是PLA2R阴性且其中10%~20%病因不明,因而给临床诊治带来了极大的挑战[1]。2014年后研究显示11%~33%恶性肿瘤相关膜性肾病患者肾组织血小板反应蛋白1型结构7A域(thrombospondin type 1 domain-containing 7A,THSD7A)及神经表皮生长因子样蛋白-1 (neural epidermal growth factor-like 1 protein,NELL1)阳性表达,因此认为这两个指标可能是肿瘤相关靶抗原[2-6];而另一些研究并未显示这两个指标与肿瘤的相关性[7-8]。本研究回顾性分析肾组织THSD7A及NELL1在116例PLA2R阴性膜性肾病患者中的表达情况,探讨THSD7A及NELL1在PLA2R阴性膜性肾病中的表达及其与继发因素特别是肿瘤的相关性,并分析患者的临床病理特征以及治疗和预后情况,为这两个指标在临床诊断及治疗中的应用提供一定的指导意义。
资料和方法
资料来源 从浙江中医药大学附属杭州市中医院2014至2021年肾穿刺活检确诊的712例膜性肾病中,选取肾组织PLA2R阴性膜性肾病共116例,包括继发因素(如结缔组织病、乙型肝炎、肿瘤)明确的膜性肾病39例,继发因素不明确(检查及检验结果提示无结缔组织病、乙型肝炎、肿瘤继发可能)的膜性肾病55例,以及常规排查未发现继发因素的膜性肾病22例。排除标准为:(1)经过特殊治疗的复诊病例;(2)合并其他肾脏疾病(包括糖尿病肾病、单克隆免疫球蛋白沉积病、遗传性肾病等)以及临床病理和治疗随访资料不完整病例。本研究符合《赫尔辛基宣言》章程,并获得浙江中医药大学附属杭州市中医院伦理委员会批准(伦理审查批号:2020LH004)。
肾组织THSD7A及NELL1检测 石蜡包埋组织3 μm厚切片,脱蜡至水,柠檬酸盐或EDTA抗原修复液微波修复,自然冷却后,用3% H2O2 除去內源性过氧化物酶,而后胰蛋白酶37 ℃修复15 min。山羊血清封闭20 min后加一抗(THSD7A:美国Sigma公司,1∶400;NELL1:美国Sigma公司,1∶50),4 ℃孵育过夜。次日滴加增强剂(福州迈新公司)37 ℃孵育30 min、二抗(EliVision Plus 免疫组织化学广谱试剂盒,福州迈新公司) 37 ℃孵育30 min后DAB显色,苏木素复染,封片。选取微小病变肾病作为阴性对照。阳性判断:阳性部位为肾小球基底膜,呈黄褐色颗粒状着色,阳性强度高于周围肾小管。免疫组织化学染色阳性的病例用石蜡荧光共染法进行验证,一抗及前处理同免疫组织化学染色方法,次日,AF594标记抗兔荧光二抗(杭州达文生物公司,1∶100)37 ℃孵育30 min,洗净后滴加异硫氰酸荧光素标记兔抗人IgG一抗(DAKO公司,1∶50)室温孵育1 h,洗净后封片,荧光共聚焦显微镜(徕卡STELLARIS5)观察。
血清THSD7A及NELL1抗体检测 收集部分患者-80 ℃留存血清,间接免疫荧光法半定量检测血清抗THSD7A及NELL1抗体,阳性者收集随访终止时的血清再次检测两个抗体滴度。
临床病理资料分析 临床及实验室资料包括性别、年龄、发病时间、24 h尿蛋白、血肌酐、白蛋白、估算肾小球滤过率(estimated glomerular filtration rate,eGFR);膜性肾病风险等级依据2021年改善全球肾脏病预后组织风险等级标准分为低、中、高、极高危4个等级[9]。病理资料包括膜性肾病分期,IgG、C3、C1q及IgG 4个亚型的阳性强度,球性硬化、间质纤维化及炎症浸润程度,电镜下沉积物是否为多部位(上皮下加内皮下)及肾小球基底膜(glomerular basement membrane,GBM)厚度,并将C1q阳性及电镜下多部位沉积的膜性肾病定义为不典型膜性肾病(atypical membranous nephropathy,AMN)。根据靶抗原表达分组,比较组间差异。
继发因素分析 收集血抗核抗体、乙型肝炎抗原及肿瘤特异性标志物数据;收集影像学(胸腹部CT、磁共振、B超、PET-CT)数据;收集肿瘤(胃肠镜、淋巴结活检、肝脏穿刺及手术切除)病理诊断数据。继发性膜性肾病依据狼疮性肾炎、干燥综合征相关肾损害及乙型肝炎相关性肾炎各自诊断标准[10-12]。
治疗及随访资料分析 治疗方案分为保守治疗(血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂为主)、免疫抑制治疗(激素和/或免疫抑制剂)、肾脏替代治疗(透析或移植),具体治疗方案依据2012版及2021版改善全球肾脏病预后组织治疗指南。预后分析包含完全缓解(尿蛋白<0.3 g/d伴血清白蛋白及肌酐正常)、部分缓解(尿蛋白<3.5 g/d且减少≥50%,血清白蛋白>30 g/L,肌酐稳定)、无缓解(尿蛋白无减少或减少<50%,eGFR降低<30%)、肾功能不全(eGFR降低≥30%或低于 60 ml/min)[13],并将完全缓解或部分缓解归类为复合缓解。
统计学处理 采用SPSS 20.0统计软件进行数据分析,正态性检验采用Kolmogorov-Smirnov检验,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验或F检验;非正态分布的计量资料以中位数(四分位数)表示,组间比较采用Kruskal-Wallis非参数检验。计数分类资料采用卡方检验或Fisher精确概率法。预后危险因素采用Logistic回归分析。采用Kaplan-Meier法绘制生存曲线,Log-rank检验对生存曲线进行比较。P<0.05为差异有统计学意义。
结 果
一般资料 PLA2R阴性膜性肾病占总膜性肾病的16.3%,其中男性65例,占56%,平均年龄为(48.6±13.6)岁。肾病综合征表现者为56例,占48.3%;24 h尿蛋白定量为(2.0±0.9) g,血肌酐为(71.1±28.9) μmol/L,处于中低风险的膜性肾病占87.9%。33例(28.4%)有高血压病史,11例(9.5%)有糖尿病病史,但均无糖尿病肾病,各组间合并高血压及糖尿病情况差异均无统计学意义(P均>0.05)。明确诊断的继发性膜性肾病者为34例(包括25例狼疮性肾炎、9例干燥相关肾损害);疑似继发性膜性肾病者为46例(包括32例自身免疫标志物阳性但达不到狼疮诊断标准、14例乙型肝炎抗原血症但肾组织乙型肝炎抗原检测阴性)。肿瘤筛查结果显示病理确诊恶性肿瘤者5例(肺癌2例、纵隔转移性腺癌1例、乙状结肠癌1例、淋巴瘤1例),影像学高度提示恶性肿瘤(CT提示肺部磨玻璃/毛刺状结节;肝脏、前列腺占位提示恶性可能;B超提示多发淋巴结肿大而无感染依据)者9例,仅血肿瘤特异性标志物阳性或升高(癌胚抗原、前列腺特异抗原、甲胎蛋白、鳞状上皮癌抗原阳性或CA199、CA125升高5倍以上)者35例。
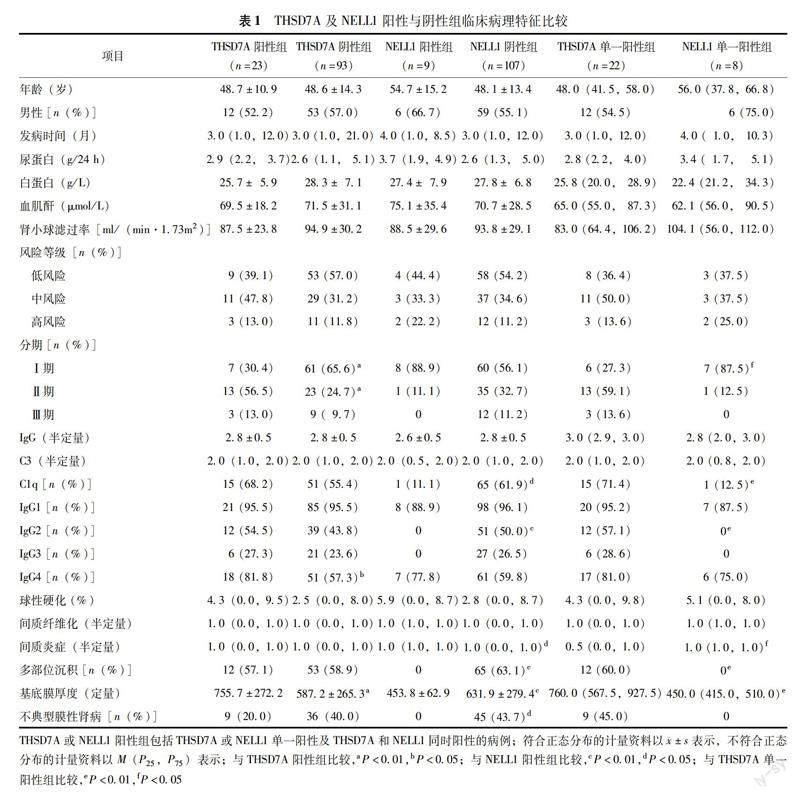
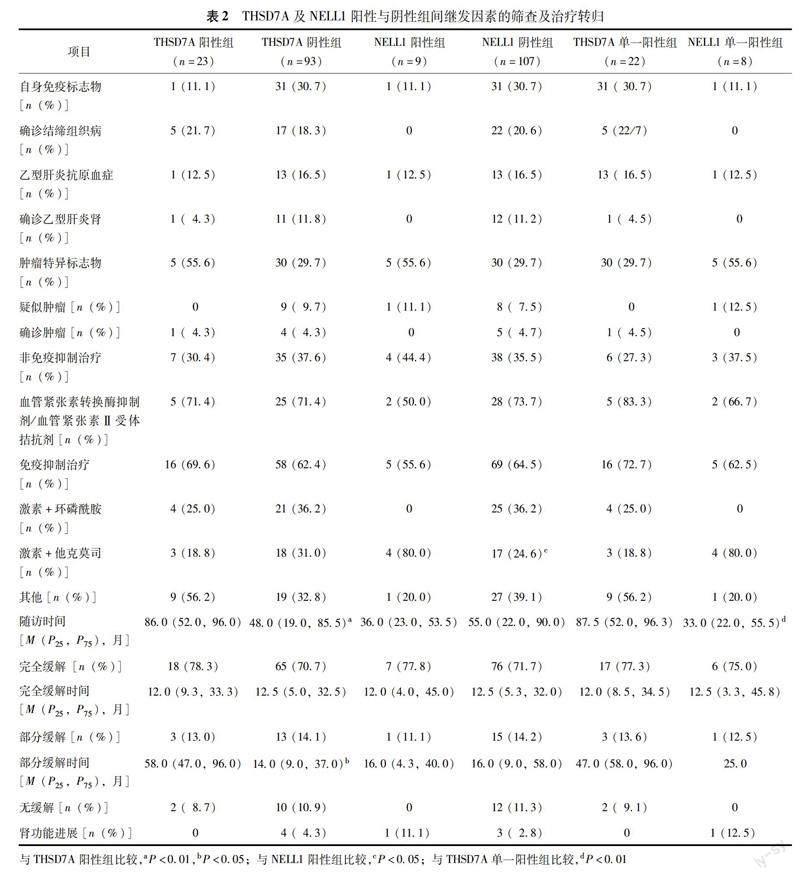
THSD7A阳性表达情况与临床病理特征及继发因素 肾组织THSD7A阳性表达者23例,沿肾小球基底膜呈颗粒状表达且与IgG共定位,阳性强度为1+~2+,占总膜性肾病的3.2%,占PLA2R阴性膜性肾病的19.8%(图1)。临床病理资料分析显示THSD7A阳性者IgG1阳性率最高,其次为IgG4;THSD7A阳性较阴性者IgG4阳性率更高(P=0.010),膜性肾病Ⅰ期占比更少,Ⅱ期占比更多(P=0.002),GBM显著增厚(P=0.034)(表1)。继发因素分析结果显示5例THSD7A阳性膜性肾病确诊为结缔组织病,1例确诊为乙型肝炎相关性膜性肾病,1例确诊为乙状结肠癌,THSD7A阳性与阴性病例差异无统计学意义(P>0.05)。
NELL1阳性表达情况与临床病理特征及继发因素 肾组织NELL1阳性表达者9例,沿肾小球基底膜呈颗粒状表达且与IgG共定位,阳性强度为2+~3+,占总膜性肾病的1.3%,占PLA2R阴性膜性肾病的7.8%(图1)。9例NELL1阳性膜性肾病中2例为节段性膜性肾病,占节段性膜性肾病的50%(另2例节段性膜性肾病为THSD7A及NELL1双阴性)。临床病理资料分析显示NELL1阳性者IgG1阳性率最高,其次为IgG4;NELL1阳性较阴性者C1q及IgG2的阳性率更低(P=0.029,P=0.001),间质炎细胞浸润更多(P=0.033),电镜下多部位沉积者更少(P=0.001),GBM增厚更不明显(P<0.001),AMN比例更低(P=0.010)(表1)。继发因素分析结果显示NELL1阳性者均无明确的自身免疫、感染或恶性肿瘤,仅1例表现为抗核抗体阳性,1例为乙型肝炎抗原血症,1例肺CT提示恶性肿瘤可能,NELL1阳性与阴性病例差异无统计学意义(P>0.05)。
THSD7A与NELL1单一阳性膜性肾病组间比较结果 116例PLA2R阴性膜性肾病患者中仅1例为THSD7A及NELL1双阳性,剩余THSD7A单一阳性者膜性肾病Ⅰ期及间质炎细胞浸润显著少于NELL1单一阳性者(P=0.014,P=0.039),而C1q及IgG2阳性率、GBM厚度及多部位沉积占比则显著高于NELL1单一阳性者(P=0.019,P=0.009)(表1)。继发因素及肾病的治疗及转归结果显示除THSD7A随访时间更长外,其余指标THSD7A与NELL1单一阳性者差异均无统计学意义(P均>0.05)。
治疗及预后 36.2%患者接受非免疫抑制治疗,其中71.4%患者使用血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂治疗,各组间非免疫抑制治疗使用率差异无统计学意义(P>0.05)。63.8%患者接受免疫抑制治疗,其中33.8%使用激素+环磷酰胺方案,28.4%使用激素+他克莫司(FK506)方案,剩余37.8%接受雷公藤或利妥昔单抗等其他治疗方案。中位随访时间为52个月,THSD7A阳性随访时间显著长于阴性组(P=0.001),THSD7A单一阳性组随访时间显著长于NELL1单一阳性组(P=0.002)。53.3% AMN接受免疫抑制治疗,81.8%表现为肾病复合缓解(68.2%完全缓解、13.6%部分缓解),AMN组与非AMN组治疗方案及肾病缓解率差异均无统计学意义(P均>0.05)。5例(4.3%)出现膜性肾病复发,其中2例为THSD7A陽性病例(1例完全缓解、1例部分缓解),其余3例均为双阴性病例(1例完全缓解、2例部分缓解)。THSD7A及NELL1阳性与阴性组间免疫抑制治疗使用率差异无统计学意义(P>0.05),仅NELL1阳性组激素+他克莫司使用率显著高于NELL1阴性组(P=0.037)。THSD7A阳性及NELL1阳性膜性肾病不论有无明确继发因素,其治疗方案及膜性肾病复合缓解率差异均无统计学意义(P均>0.05)。THSD7A阳性患者膜性肾病部分缓解时间显著长于阴性患者(P=0.039),而NELL1阳性较阴性患者治疗及缓解情况差异均无统计学意义(P均>0.05)(表2)。2例NELL1阳性的节段性膜性肾病中1例接受保守治疗,1例使用激素联合他克莫司;另2例NELL1阴性的节段性膜性肾病中1例接受保守治疗,1例仅使用激素治疗;4例患者蛋白尿均达到完全缓解且肾功能稳定。Logistic回归分析显示无THSD7A或NELL1是肾病不缓解或进展的危险因素,但Log-rank生存分析提示THSD7A阳性组肾病复合缓解率显著低于阴性组(P=0.016),而NELL1阳性组肾病复合缓解率则显著优于阴性组(P=0.015),两指标单一阳性组间比较显示NELL1单一阳性组肾病复合缓解率显著优于THSD7A单一阳性组(P<0.001)(图2)。
血清THSD7A及NELL1抗体分析结果 检测14例留存血清样本的THSD7A及NELL1抗体,其中1例患者血清THSD7A抗体阳性,滴度为1∶640,肾组织THSD7A亦阳性表达,激素+环磷酰胺方案治疗7个月肾病综合征完全缓解,随访结束时血清THSD7A抗体阴性。另外1例血清NELL1抗体阳性,滴度为1∶100,肾组织NELL1亦阳性表达,患者由于肺部CT提示多发小结节且T淋巴细胞酶联免疫斑点法试验阳性,在预防性抗结核治疗的基础上仅使用激素治疗,3年多后肾病综合征完全缓解,随访结束时血清NELL1抗体阴性。
讨 论
THSD7A抗原表达于足细胞足突,存在于膜性肾病患者肾小球上皮侧,与相应抗体形成原位免疫复合物破坏足细胞骨架结构,其抗体亚型以IgG4为主[14-15]。1%~5%的原发膜性肾病肾组织中可检测到THSD7A[2]。研究显示THSD7A相关膜性肾病患者平均年龄为67岁,且均为男性,肾病综合征表现,其肿瘤发生率更高,占恶性肿瘤相关膜性肾病的11%,见于胆管癌、前列腺癌、乳腺癌、皮肤癌及肾细胞癌[2]。在肿瘤组织及肾组织中可同时检测到THSD7A抗原,研究认为这是由于肿瘤细胞呈递了THSD7A抗原表位,导致机体对THSD7A抗原产生体液免疫反应从而诱发膜性肾病[3-4,14]。研究报道THSD7A阳性患者的肿瘤及死亡风险均为阴性患者的5倍,且约有20%的THSD7A相关膜性肾病患者在随访过程中(中位随访时间为3个月)被检出患有恶性肿瘤[15-16]。之后通过类似的激光显微切割-质谱分析法,又发现另一伴发肿瘤的膜性肾病靶抗原NELL1,占PLA2R阴性膜性肾病的23%,占恶性肿瘤相关膜性肾病的33%,成为除PLA2R外第二大类靶抗原[5-6]。这些患者平均年龄为63岁,男性略为多见,其抗体主要为IgG1型[5]。80%患者在肾病综合征发病时或发病后的几个月内查出实体肿瘤,分别为表皮样肺癌、转移性胰腺癌、转移性乳腺癌和浸润性尿路上皮癌,其中1例患者肿瘤治愈后肾病综合征完全缓解,且血清NELL1抗体也随之消失[5]。个别样本除肾组织外,在肿瘤组织上也检测到NELL1阳性[17]。因此,THSD7A及NELL1被认为是肿瘤靶抗原,阳性者需加强肿瘤方面的筛查[6,14-17]。然而,本研究显示THSD7A及NELL1阳性膜性肾病患者的平均年龄低于文献报道,THSD7A在PLA2R阴性膜性肾病中的阳性率高于NELL1,且仅1例THSD7A阳性患者确诊为恶性肿瘤,而NELL1阳性者无确诊的恶性肿瘤;且THSD7A及NELL1阳性与阴性组间常规肿瘤筛查差异无统计学意义,与国内一些研究结果[7-8]类似。因此,笔者认为THSD7A及NELL1阳性膜性肾病与恶性肿瘤并无关联性。另一方面,部分THSD7A及NELL1阳性膜性肾病还存在自身免疫及感染等继发因素以及不典型膜性肾病的表现,部分病例即便膜性肾病发病时无确切肿瘤依据,随访中仍有出现肿瘤筛查阳性或确诊可能,因此,仍需积极排查各种继发因素,减少相关病因漏诊可能,而非直接等同于原发性膜性肾病。
临床特征分析结果显示THSD7A及NELL1阳性与阴性组间及相互之间的比较差异均无统计学意义,与日本最新报道[18]类似。而IgG亚型、补体激活通路及沉积物分布的位置提示THSD7A及NELL1阳性者均更倾向于原发性膜性肾病,这也可能是本研究肿瘤筛查阳性率低的原因之一。病理分期方面有研究认为随着膜性肾病的进展,其IgG亚型可发生从IgG1为主向IgG4亚型为主的转变[19]。本研究显示尽管肾病发病时间在各组之间差异无统计学意义,但THSD7A阳性的膜性肾病大部分处于膜性肾病Ⅱ期,GBM增厚明显,其IgG4阳性率显著高于阴性组;而NELL1陽性者膜性肾病大部分处于 Ⅰ 期,GBM增厚不明显,IgG2阳性率显著低于阴性组。因此,THSD7A阳性膜性肾病与NELL1阳性膜性肾病在膜性肾病分期及IgG亚型上仍表现出差异性。
节段性膜性肾病(25%~75%肾小球基底膜见上皮下沉积物)是一类罕见的膜性肾病,由Kudose等[20]在2021年进行完整的阐述,其报道17例节段性膜性肾病表现的患者中29%为NELL1阳性,33%接受免疫抑制治疗,60%患者蛋白尿缓解,86%肾功能稳定,因此认为节段性膜性肾病患者预后良好。本研究显示4例节段性膜性肾病,尽管在NELL1阳性分布及治疗上存在异质性,但随访中蛋白尿均达到完全缓解且肾功能稳定。因此,笔者认为节段性膜性肾病可能是膜性肾病的早期表现,也可能是一种特殊类型的膜性肾病。
除肿瘤继发外,其余THSD7A阳性膜性肾病的治疗原则与PLA2R相关的原发性膜性肾病类似,依据疾病风险等级进行观察及进一步免疫抑制治疗,但也有使用免疫吸附方法以降低血清抗体浓度,以及B细胞靶向治疗(利妥昔单抗)方案取得良好的肾病缓解的病例报道[21-23]。Hara等[24]报道7例THSD7A阳性病例中5例经免疫抑制治疗后达到完全缓解。Wang等[25]报道12例THSD7A阳性膜性肾病,尽管免疫抑制剂使用率为50%,但缓解率高达92%。与THSD7A阳性膜性肾病类似,安贞医院报道NELL1阳性膜性肾病 83%接受免疫抑制治疗后92%达到完全或部分缓解,缓解率明显高于PLA2R相关膜性肾病[7]。然而,本研究结果与文献报道并不完全一致:尽管THSD7A阳性膜性肾病病理分期较NELL1阳性膜性肾病晚,但各组间膜性肾病风险等级、免疫抑制治疗占比及肾病缓解情况差异无统计学意义。预后分析显示尽管THSD7A阳性组随访时间显著长于阴性组,且整体缓解率阳性组略高,但生存分析显示随着时间的延长,两组间缓解曲线逐渐拉开,THSD7A阳性组肾病复合缓解率显著低于阴性组;而NELL1阳性组肾病复合缓解率显著优于阴性组,且两阳性组间亦表现为NELL1阳性组患者获得更好的肾病缓解,推测这可能与NELL1阳性组膜性肾病处于更早期有关。因此,笔者认为THSD7A及NELL1在PLA2R阴性膜性肾病中的检测意义在于对患者预后具有一定的预测价值,并非提示潜在的恶性肿瘤,但仍需长期随访观察以降低肿瘤漏诊风险。
血清THSD7A抗體的检测具有较高特异性,且随着疾病缓解而下降、疾病复发而升高[26]。Zaghrini等[26]报道49例血清THSD7A抗体阳性膜性肾病中8例(16.3%)有恶性肿瘤病史,但仅3例恶性肿瘤于膜性肾病诊断两年内发现。Wang等[27]报道PLA2R阴性的原发性膜性肾病中,THSD7A阳性占16%(12例),其中50%患者血清THSD7A抗体阳性;继发性膜性肾病中仅1例肿瘤继发膜性肾病为THSD7A抗体阳性,占继发性膜性肾病的0.9%。Tian等[28]报道2.4%(5例)原发性膜性肾病及1.7%(2例)继发性膜性肾病患者血清中存在THSD7A抗体,且2例继发性膜性肾病均为肿瘤相关性膜性肾病。本研究显示1例血清THSD7A抗体阳性及1例NELL1抗体阳性,相应肾组织两抗原亦呈阳性表达,继发因素筛查均无肿瘤依据,接受免疫抑制治疗后肾病均达到完全缓解,随访结束时血清抗体也均转阴。因此,笔者认为THSD7A及NELL1抗体检测与组织学抗原检测意义类似,能反映肾病缓解情况,但随访中尚未发现明确肿瘤依据。本研究不足之处为单中心研究,且NELL1阳性病例数及血清样本偏少,结果的可靠性及临床应用价值仍需后期多中心研究来验证。
综上,THSD7A及NELL1阳性膜性肾病更倾向于原发性膜性肾病,且无显著的恶性肿瘤提示价值,但对患者的预后具有一定的预测价值,血清两抗体检测能反映肾病缓解情况。
参 考 文 献
[1]Beck LH Jr,Bonegio RGB,Lambeau G,et al.M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy[J].N Engl J Med,2009,361(1):11-21.DOI:10.1056/NEJMoa0810457.
[2]Tomas NM,Beck LH Jr,Meyer-Schwesinger C,et al.Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy[J].N Engl J Med,2014,371(24):2277-2287.DOI:10.1056/NEJMoa1409354.
[3]Ronco P,Debiec H.Membranous nephropathy:current understanding of various causes in light of new target antigens[J].Curr Opin Nephrol Hypertens,2021,30(3):287-293.DOI:10.1097/MNH.0000000000000697.
[4]Tomas NM,Beck LH Jr,Meyer-Schwesinger C,et al.Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy[J].N Engl J Med,2014,371(24):2277-2287.DOI:10.1056/NEJMoa1409354.
[5]Sethi S,Debiec H,Madden B,et al.Neural epidermal growth factor-like 1 protein (NELL1) associated membranous nephropathy[J].Kidney Int,2020,97(1):163-174.DOI:10.1016/j.kint.2019.09.014.
[6]Sethi S.New antigens in membranous nephropathy [J].J Am Soc Nephrol,2021,32(2):268-278.DOI:10.1681/ASN.2020071082.
[7]Wang GQ,Sun LJ,Dong HR,et al.Neural epidermal growth factor-like 1 protein-positive membranous nephropathy in Chinese patients [J].Clin J Am Soc Nephrol,2021,16(5):727-735.DOI:10.2215/CJN.11860720.
[8]Zhang D,Zou J,Zhang C,et al.Clinical and histological features of phospholipase A2 receptor-associated and thrombospondin type-I domain-containing 7A-associated idiopathic membranous nephropathy:a single center retrospective study from China[J].Med Sci Monit,2018,24:5076-5083.DOI:10.12659/MSM.909815.
[9]Alsharhan L,Beck LH Jr.Membranous nephropathy:core curriculum 2021 [J].Am J Kidney Dis,2021,77(3):440-453.DOI:10.1053/j.ajkd.2020.10.009.
[10]Aringer M,Costenbader K,Daikh D,et al.2019 European league against rheumatism/American college of rheumatology classification criteria for systemic lupus erythematosus[J].Arthritis Rheumatol,2019,71(9):1400-1412.DOI:10.1002/art.40930.
[11]Shiboski CH,Shiboski SC,Seror R,et al.2016 American college of rheumatology/European league against rheumatism classification criteria for primary sjgrens syndrome:a consensus and data-driven methodology involving three international patient cohorts[J].Arthritis Rheumatol,2017,69(1):35-45.DOI:10.1002/art.39859.
[12]中華内科杂志编委会.乙型肝炎病毒相关性肾炎座谈会纪要[J].中华内科杂志,1990,29(9):519-521.
[13]Zhang BO,Cheng M,Yang M,et al.Analysis of the prognostic risk factors of idiopathic membranous nephropathy using a new surrogate end-point[J].Biomed Rep,2016,4(2):147-152.DOI:10.3892/br.2015.555.
[14]Hoxha E,Reinhard L,Stahl RAK.Membranous nephropathy:new pathogenic mechanisms and their clinical implications [J].Nat Rev Nephrol,2022,18(7):466-478.DOI:10.1038/s41581-022-00564-1.
[15]Tomas NM,Hoxha E,Reinicke AT,et al.Autoantibodies against thrombospondin type 1 domain-containing 7A induce membranous nephropathy [J].J Clin Invest,2016,26(7):2519-2532.DOI:10.1172/JCI85265.
[16]Hanset N,Aydin S,Demoulin N,et al.Podocyte antigen staining to identify distinct phenotypes and outcomes in membranous nephropathy:a retrospective multicenter cohort study[J].Am J Kidney Dis,2020,76(5):624-635.DOI:10.1053/j.ajkd.2020.04.013.
[17]Caza T,Hassen S,Dvanajscak Z,et al.NELL1 is a target antigen in malignancy-associated membranous nephropathy[J].Kidney Int,2020,99(4):967-976.DOI:10.1016/j.kint.2020.07.039.
[18]Iwakura T,Ema C,Isobe S,et al.Prevalence of neural epidermal growth factor-like 1- and exostosin 1/exostosin 2-associated membranous nephropathy:a single-center retrospective study in Japan[J].Sci Rep,2022,12(1):2967.DOI:10.1038/s41598-022-07037-2.
[19]Huang CC,Lehman A,Albawardi A,et al.IgG subclass staining in renal biopsies with membranous glomerulonephritis indicates subclass switch during disease progression[J].Mod Pathol,2013,26(6):799-805.DOI:10.1038/modpathol.2012.237.
[20]Kudose S,Santoriello D,Debiec H,et al.The clinicopathologic spectrum of segmental membranous glomerulopathy[J].Kidney Int,2021,99(1):247-255.DOI:10.1016/j.kint.2020.06.014.
[21]Lutz J.Pathophysiology,diagnosis,and treatment of membranous nephropathy [J].Nephrol Ther,2021,17S(4):S1-S10.DOI:10.1016/j.nephro.2021.03.001.
[22]Weinmann-Menke J,Holtz S,Sollinger D,et al.Treatment of membranous nephropathy in patients with THSD7A antibodies using immunoadsorption [J].Am J Kidney Dis,2019,74(6):849-852.DOI:10.1053/j.ajkd.2019.05.021.
[23]Chen MJ,Zhang L,Zhong W,et al.Case report:THSD7A-positive membranous nephropathy caused by tislelizumab in a lung cancer patient [J].Front Immunol,2021,12:619147.DOI:10.3389/fimmu.2021.619147.
[24]Hara S,Tsuji T,Fukasawa Y,et al.Clinicopathological characteristics of thrombospondin type 1 domain-containing 7A-associated membranous nephropathy[J].Virchows Arch,2019,474(6):735-743.DOI:10.1007/s00428-019-02558-0.
[25]Wang J,Cui Z,Lu J,et al.Circulating antibodies against thrombospondin type-I domain-containing 7A in Chinese patients with idiopathic membranous nephropathy[J].Clin J Am Soc Nephrol,2017,12(10):1642-1651.DOI:10.2215/CJN.01460217.
[26]Zaghrini C,Seitz-Polski B,Justino J,et al.Novel ELISA for thrombospondin type 1 domain-containing 7A autoantibodies in membranous nephropathy [J].Kidney Int,2019,95(3):666-679.DOI:10.1016/j.kint.2018.10.024.
[27]Wang J,Cui Z,Lu J,et al.Circulating antibodies against thrombospondin type-I domain-containing 7A in Chinese patients with idiopathic membranous nephropathy [J].Clin J Am Soc Nephrol,2017,12(10):1642-1651.DOI:10.2215/CJN.01460217.
[28]Tian CX,Li L,Liu TX,et al.Circulating antibodies against M-type phospholipase A2 receptor and thrombospondin type-1 domain-containing 7A in Chinese patients with membranous nephropathy [J].Int Urol Nephrol,2019,51(8):1371-1377.DOI:10.1007/s11255-019-02146-w.
(收稿日期:2022-07-21)
基金項目:浙江省医药卫生科技计划项目(2020KY753、2022KY1002)和浙江省中医药科技计划(2020ZQ040)

